МОБУ СОШ № 1 с.Ивановка
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к занятию элективного курса по химии
Содержание
- 1. Презентация к занятию элективного курса по химии
- 2. « МАЛО ИМЕТЬ ХОРОШИЙ УМ, ГЛАВНОЕ – ХОРОШО ЕГО ПРИМЕНЯТЬ»Р. Декарт
- 3. Задачи определить методы решения химических задач;научиться решать
- 4. .Решение задач на вычисление массовой
- 5. Существует 3 формулы, связанные с расчетом массовой
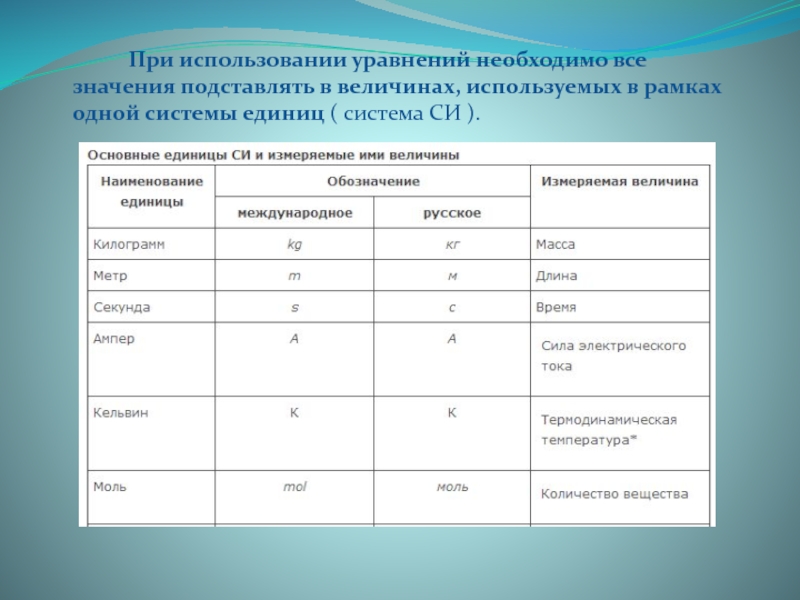
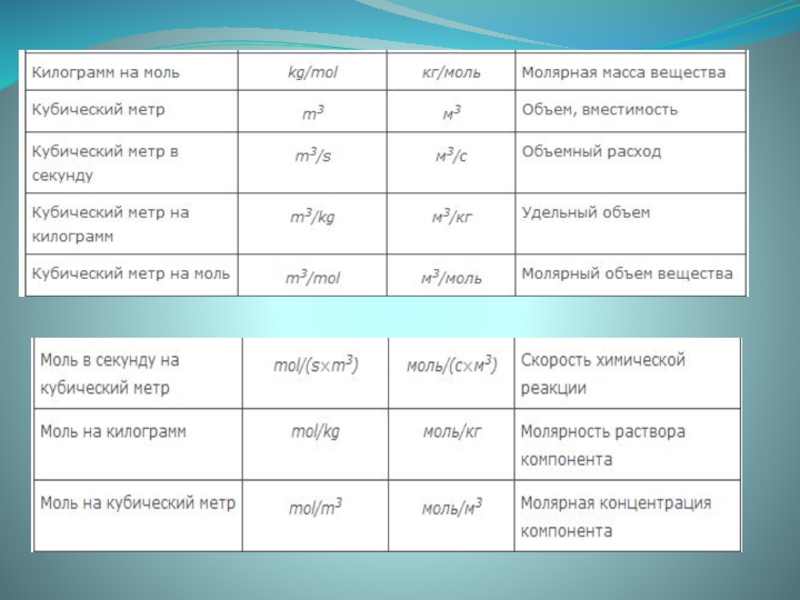
- 6. При использовании уравнений необходимо все значения подставлять
- 7. Слайд 7
- 8. На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата аммония?
- 9. Школьная химия отличается от школьной физики меньшим
- 10. Слайд 10
- 11. Оценка задания 3 балла1) Составлено
- 12. 3 балла1) Составлено уравнение реакции:Na2SO3 + 2HCl
- 13. С.Р.1.К 104 г раствора с массовой долей
- 14. 3 балла1) Составлено уравнение реакции:3BaCl2 + 2H3PO4
- 15. 3 балла1) Составлено уравнение реакции:3Mg(NO3)2 + 2H3PO4
- 16. Задание 22Кодификатор. Химические свойства простых веществ. Химические
- 17. Вспомним Качественные реакции Качественные реакции сопровождаются признаками:
- 18. ВспомнимКачественные реакции .Реакции ионного обмена.Признаки химических реакций
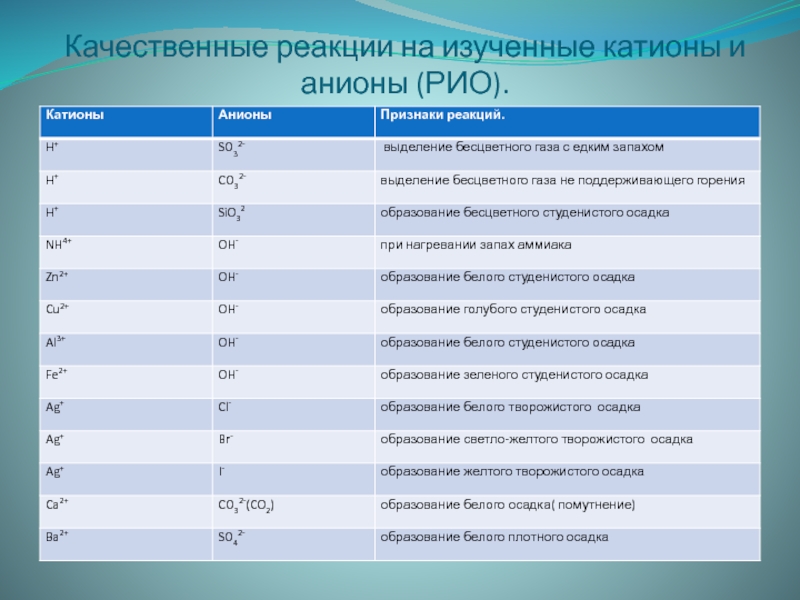
- 19. Качественные реакции на изученные катионы и анионы (РИО).
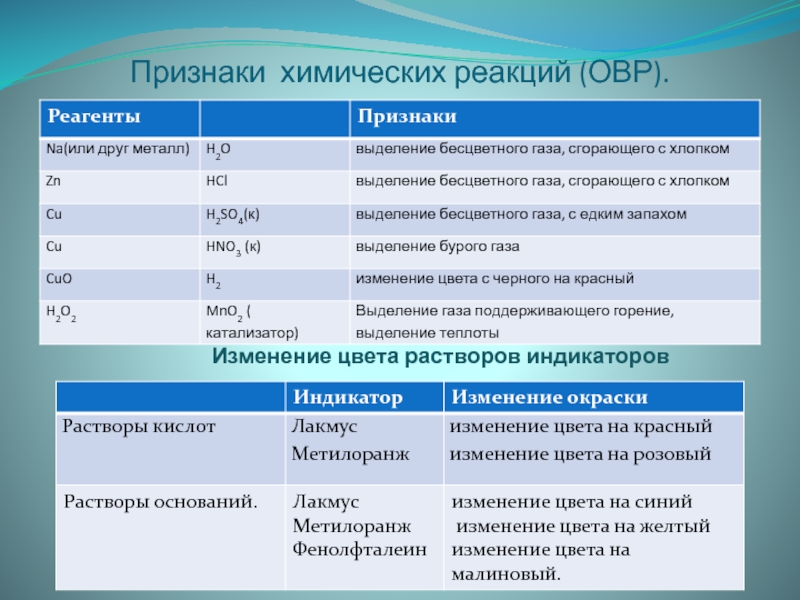
- 20. Признаки химических реакций (ОВР). Изменение цвета растворов индикаторов
- 21. Самая важная часть – провести эти реакции
- 22. ЗАДАЧИ ДЛЯ ДОМАШНЕГО ЗАДАНИЯ.1.Какой объём (н.у.) углекислого
- 23. Слайд 23
- 24. Задание 22Пример 1. Для проведения эксперимента предложены
- 25. Задание 22.Пример 2. Для проведения эксперимента предложены
- 26. Задание 22.Пример 3. Для проведения эксперимента предложены
- 27. Задание 22.Пример 4. Для проведения эксперимента предложены
- 28. Задание 22.1.Для проведения эксперимента предложены следующие реактивы:
- 29. Задание 22.2.Даны вещества: Fe, H 3 PO
- 30. Задание 22. Для проведения эксперимента предложены следующие реактивы:
- 31. Задание 22 Для проведения эксперимента предложены следующие реактивы:
- 32. ЗАДАЧИ ДЛЯ ДОМАШНЕГО ЗАДАНИЯ.docx1.Какой объём (н.у.)
- 33. Спасибо за работу!!!Желаем удачи!!!
« МАЛО ИМЕТЬ ХОРОШИЙ УМ, ГЛАВНОЕ – ХОРОШО ЕГО ПРИМЕНЯТЬ»Р. Декарт
Слайд 1ЗАНЯТИЕ ЭЛЕКТИВНОГО КУРСА
«Я сдам ОГЭ; решение задач по химии»
Агеева Елена Николаевна–
учитель химии
Слайд 3Задачи
определить методы решения химических задач;
научиться решать химические задачи ;
показать задачи
разного уровня сложности;
Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему
одного из реагентов или продуктов
реакции
Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему
одного из реагентов или продуктов
реакции
Слайд 4 .
Решение задач на вычисление массовой доли.
Молекулярная масса —
масса молекулы, выраженная в атомных единицах массы.
Массовая доля (ω) химического элемента — отношение относительной атомной массы данного элемента с учетом всех его атомов в молекуле к относительной молекулярной массе вещества
Массовая доля (ω) химического элемента — отношение относительной атомной массы данного элемента с учетом всех его атомов в молекуле к относительной молекулярной массе вещества
Вычисление массовой доли.
Слайд 5Существует 3 формулы, связанные с расчетом массовой доли
1)Массовая : ω= mч/
m ( см)
Где mч - масса частная или чистая ( индивидуального вещества в смеси или элемента в веществе);
m ( см) - масса общая или смеси.
2)Объемная : φ = Vч /V(см)
Где Vч – объем частный, V(см) - объем общий.
3) Мольная : X = υч /υоб
Где υч - частное количество вещества,
υоб - общее.
Все три вида можно выражать в процентах ( %).
Для перевода в проценты значение доли от единицы надо умножить на 100.
Если обратная операция, то разделить на 100.
Где mч - масса частная или чистая ( индивидуального вещества в смеси или элемента в веществе);
m ( см) - масса общая или смеси.
2)Объемная : φ = Vч /V(см)
Где Vч – объем частный, V(см) - объем общий.
3) Мольная : X = υч /υоб
Где υч - частное количество вещества,
υоб - общее.
Все три вида можно выражать в процентах ( %).
Для перевода в проценты значение доли от единицы надо умножить на 100.
Если обратная операция, то разделить на 100.
Слайд 6 При использовании уравнений необходимо все значения подставлять в величинах, используемых в
рамках одной системы единиц ( система СИ ).
Слайд 8На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата
аммония?
Слайд 9 Школьная химия отличается от школьной физики меньшим количеством формул. Несколько из
них связаны с расчетами количества вещества n , измеряемого в молях :
Где m – масса (г); М – молярная масса (г/Моль);
V – объем (м³); Vм – молярный объем (м³,/Моль) ;
N - количество частиц ( молекул, атомов, электронов и т. д.) ; Nа – число Авогадро (6,02·1023).
Где См – молярная концентрация ( л/Моль)
Где m – масса (г); М – молярная масса (г/Моль);
V – объем (м³); Vм – молярный объем (м³,/Моль) ;
N - количество частиц ( молекул, атомов, электронов и т. д.) ; Nа – число Авогадро (6,02·1023).
Где См – молярная концентрация ( л/Моль)
Слайд 10 Задача Вычисление количества вещества, массы или объема вещества по количеству
вещества, массе или объему одного из реагентов или продуктов реакции
Через раствор нитрата меди (II) массой 37,6 г и массовой долей 5% пропустили избыток сероводорода. Вычислите массу осадка, образовавшегося в результате реакции.
К раствору сульфита натрия массой 252 г и массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объем (н.у.) выделившегося газа.
Слайд 11 Оценка задания 3 балла
1) Составлено уравнение реакции:
Cu(NO3)2 + H2S
= CuS + 2HNO3
2) Рассчитана масса и количество вещества нитрата меди(II), содержащегося в растворе:
m (Cu(NO3)2) = m(p-pа) ∙ ω/100 = 37,6 ∙ 0,05 = 1,88 г
n (Cu(NO3)2) = m (Cu(NO3)2)/ M (Cu(NO3)2) = 1,88 : 188 = 0,01 моль
3) Определена масса вещества, вступившего в реакцию:
по уравнению реакции n (CuS) = (Cu(NO3)2) = 0,01 моль
m(CuS) = n (CuS) ∙ M(CuS) = 0,01 ∙ 96 = 0,96 г
2) Рассчитана масса и количество вещества нитрата меди(II), содержащегося в растворе:
m (Cu(NO3)2) = m(p-pа) ∙ ω/100 = 37,6 ∙ 0,05 = 1,88 г
n (Cu(NO3)2) = m (Cu(NO3)2)/ M (Cu(NO3)2) = 1,88 : 188 = 0,01 моль
3) Определена масса вещества, вступившего в реакцию:
по уравнению реакции n (CuS) = (Cu(NO3)2) = 0,01 моль
m(CuS) = n (CuS) ∙ M(CuS) = 0,01 ∙ 96 = 0,96 г
Слайд 123 балла
1) Составлено уравнение реакции:
Na2SO3 + 2HCl = 2NaCl + SO2
+ H2O
2) Рассчитана масса и количество вещества сульфита натрия, содержащегося в растворе:
m (Na2SO3) = m(p-pа) ∙ ω/100 = 252 ∙ 0,05 = 12,6 г
n (Na2SO3) = m (Na2SO3)/ M (Na2SO3) = 12,6 : 126 = 0,1 моль
3) Определен объем газообразного вещества, вступившего в реакцию:
по уравнению реакции n (SO2) = (Na2SO3) = 0,1 моль
V (SO2) = n (SO2) ∙ Vm = 0,1 ∙ 22,4 = 2,24 л
2) Рассчитана масса и количество вещества сульфита натрия, содержащегося в растворе:
m (Na2SO3) = m(p-pа) ∙ ω/100 = 252 ∙ 0,05 = 12,6 г
n (Na2SO3) = m (Na2SO3)/ M (Na2SO3) = 12,6 : 126 = 0,1 моль
3) Определен объем газообразного вещества, вступившего в реакцию:
по уравнению реакции n (SO2) = (Na2SO3) = 0,1 моль
V (SO2) = n (SO2) ∙ Vm = 0,1 ∙ 22,4 = 2,24 л
Слайд 13С.Р.
1.К 104 г раствора с массовой долей хлорида бария 9% добавили
избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
2. К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
2. К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
Слайд 143 балла
1) Составлено уравнение реакции:
3BaCl2 + 2H3PO4 = Ba3(PO4)2 + 6HCl
2)
Рассчитана масса и количество вещества хлорида бария, содержащегося в растворе:
m (BaCl2) = m(p-pа) ∙ ω/100 = 104 ∙ 0,09 = 9,36 г
n (BaCl2) = m (BaCl2)/ M (BaCl2) = 9,36 : 208 = 0,045 моль
3) Определена масса образовавшегося осадка:
по уравнению реакции n (Ba3(PO4)2) = 1/3n (BaCl2) = 0,015 моль
m (Ba3(PO4)2) = n (Ba3(PO4)2) ∙ M(Ba3(PO4)2) = 0,015 ∙ 602 = 9,03г
m (BaCl2) = m(p-pа) ∙ ω/100 = 104 ∙ 0,09 = 9,36 г
n (BaCl2) = m (BaCl2)/ M (BaCl2) = 9,36 : 208 = 0,045 моль
3) Определена масса образовавшегося осадка:
по уравнению реакции n (Ba3(PO4)2) = 1/3n (BaCl2) = 0,015 моль
m (Ba3(PO4)2) = n (Ba3(PO4)2) ∙ M(Ba3(PO4)2) = 0,015 ∙ 602 = 9,03г
Слайд 153 балла
1) Составлено уравнение реакции:
3Mg(NO3)2 + 2H3PO4 = Mg3(PO4)2 + 6HNO3
2)
Рассчитана масса и количество вещества нитрата магния, содержащегося в растворе:
m (Mg(NO3)2) = m(p-pа) ∙ ω/100 = 296 ∙ 0,06 = 17,76 г
n (Mg(NO3)2) = m (Mg(NO3)2)/ M (Mg(NO3)2) = 17,76 : 148 = 0,12 моль
3) Определена масса образовавшегося осадка:
по уравнению реакции n (Mg3(PO4)2) = 1/3n (Mg(NO3)2) = 0,04 моль
m (Mg3(PO4)2) = n (Mg3(PO4)2) ∙ M(Mg3(PO4)2) = 0,04 ∙ 262 = 10,48г
m (Mg(NO3)2) = m(p-pа) ∙ ω/100 = 296 ∙ 0,06 = 17,76 г
n (Mg(NO3)2) = m (Mg(NO3)2)/ M (Mg(NO3)2) = 17,76 : 148 = 0,12 моль
3) Определена масса образовавшегося осадка:
по уравнению реакции n (Mg3(PO4)2) = 1/3n (Mg(NO3)2) = 0,04 моль
m (Mg3(PO4)2) = n (Mg3(PO4)2) ∙ M(Mg3(PO4)2) = 0,04 ∙ 262 = 10,48г
Слайд 16Задание 22
Кодификатор. Химические свойства простых веществ. Химические свойства сложных веществ. Взаимосвязь
различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления.
Пример задания. Даны вещества: FeCl3, H2SO4(конц.), Fe, Cu, NaOH, CuSO4.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций.
Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Пример задания. Даны вещества: FeCl3, H2SO4(конц.), Fe, Cu, NaOH, CuSO4.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций.
Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Слайд 17Вспомним
Качественные реакции
Качественные реакции сопровождаются признаками: изменение цвета, выделение газа,
образование осадка, изменение запаха, выделение или поглощение теплоты.
Слайд 18Вспомним
Качественные реакции .
Реакции ионного обмена.
Признаки химических реакций
условия протекания
РИО до конца.
Качественные реакции сопровождаются признаками: изменение цвета, выделение газа, образование осадка, изменение запаха, выделение или поглощение теплоты.
Качественные реакции сопровождаются признаками: изменение цвета, выделение газа, образование осадка, изменение запаха, выделение или поглощение теплоты.
Слайд 21Самая важная часть – провести эти реакции и описать отдельно их
признаки, а отдельно – условия осуществления.
формулировки ответа, не искажающие его смысла.
Баллы Составлены два уравнения реакции:
1) Fe + CuSO 4 = FeSO 4 + Cu
2) FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4
Описаны признаки протекания реакций:
3) для первой реакции: выделение красного осадка металл. меди;
4) для второй реакции: выпадение серо-зелёного осадка. Составлено сокращённое ионное уравнение второй реакции: -5
Ответ правильный и полный, содержит все названные элементы – 5 Правильно записаны четыре элемента ответа 4
Правильно записаны три элемента ответа 3
Правильно записаны два элемента ответа 2
Правильно записан один элемент ответа 1
Все элементы ответа записаны неверно 0
формулировки ответа, не искажающие его смысла.
Баллы Составлены два уравнения реакции:
1) Fe + CuSO 4 = FeSO 4 + Cu
2) FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4
Описаны признаки протекания реакций:
3) для первой реакции: выделение красного осадка металл. меди;
4) для второй реакции: выпадение серо-зелёного осадка. Составлено сокращённое ионное уравнение второй реакции: -5
Ответ правильный и полный, содержит все названные элементы – 5 Правильно записаны четыре элемента ответа 4
Правильно записаны три элемента ответа 3
Правильно записаны два элемента ответа 2
Правильно записан один элемент ответа 1
Все элементы ответа записаны неверно 0
Слайд 22ЗАДАЧИ ДЛЯ ДОМАШНЕГО ЗАДАНИЯ.
1.Какой объём (н.у.) углекислого газа выделится при взаимодействии
избытка раствора карбоната калия с 584 г раствора соляной кислоты с массовой долей растворённого вещества 10%. (17,92 л)
2. При пропускании 2,24 л аммиака (н.у.) через раствор серной кислоты с массовой долей 8% образовался сульфат аммония. Определите массу исходного раствора серной кислоты. (61,25 г)
3. При пропускании углекислого газа через раствор гидроксида бария с массовой долей растворённого вещества 16% образовался осадок массой 59,1%. Вычислите массу исходного раствора гидроксида бария. (320,6 г)
4. После пропускания 5,6 л сернистого газа через раствор гидроксида натрия получили раствор массой 521 г. Вычислите массовую долю соли в образовавшемся растворе. (6,04%)
5. Вычислите массовую долю серной кислоты, содержащейся в 78,4 г раствора, необходимого для взаимодействия с цинком, если в результате реакции выделилось 2,24 л газа (н.у.). (12,5%)
Слайд 24Задание 22
Пример 1. Для проведения эксперимента предложены следующие реактивы: медь, растворы
серной кислоты, нитрата серебра, гидроксида калия и сульфата цинка.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций гидроксид меди(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
1) Cu ----Cu( NO 3 ) ---Cu(OH) 2
2) Cu+2AgNO 3 = Cu (NO 3 ) 2 +2Ag
3) Cu (NO 3 ) 2 +2KOH = Cu (OH) 2 +2KNO 3
4) Cu2+ +2OH- = Cu (OH) 2
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций гидроксид меди(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
1) Cu ----Cu( NO 3 ) ---Cu(OH) 2
2) Cu+2AgNO 3 = Cu (NO 3 ) 2 +2Ag
3) Cu (NO 3 ) 2 +2KOH = Cu (OH) 2 +2KNO 3
4) Cu2+ +2OH- = Cu (OH) 2
Слайд 25Задание 22.
Пример 2. Для проведения эксперимента предложены следующие реактивы: растворы сульфата
магния, хлорида натрия, карбоната натрия, нитрата серебра, соляной кислоты.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида магния. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
1) MgSO 4 --- MgCO 3 ----MgCl 2
2) MgSO 4 +Na 2 CO 3 = Na 2 SO 4 + MgCO 3
3) MgCO 3 +2HCl = MgCl 2 +CO 2 + H 2 O
4) MgCO 3 +2 H + = Mg 2+ + CO 2 + H 2 O
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида магния. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
1) MgSO 4 --- MgCO 3 ----MgCl 2
2) MgSO 4 +Na 2 CO 3 = Na 2 SO 4 + MgCO 3
3) MgCO 3 +2HCl = MgCl 2 +CO 2 + H 2 O
4) MgCO 3 +2 H + = Mg 2+ + CO 2 + H 2 O
Слайд 26Задание 22.
Пример 3. Для проведения эксперимента предложены следующие реактивы: железо, оксид
меди(II), растворы аммиака, соляной кислоты и хлорида железа(III).
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций оксид железа(III). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций оксид железа(III). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
Слайд 27Задание 22.
Пример 4. Для проведения эксперимента предложены следующие реактивы: растворы сульфата
магния, нитрата серебра, серной кислоты, хлорида бария и нитрата натрия.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор азотной кислоты. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор азотной кислоты. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
Слайд 28Задание 22.
1.Для проведения эксперимента предложены следующие реактивы: твёрдый хлорид аммония, твёрдый
гидроксид кальция, растворы азотной кислоты, гидроксида натрия, нитрата бария, раствор лакмуса, универсальная индикаторная бумага. Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор нитрата аммония. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций.
Слайд 29Задание 22.
2.Даны вещества: Fe, H 3 PO 4, H 2 SO
4 (р-р), NaOH, FeCl 3, H 2 O
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Слайд 30Задание 22.
Для проведения эксперимента предложены следующие реактивы: растворы серной кислоты, гидроксида
кальция, нитрата кальция, нитрата бария, металлическое железо.
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор нитрата железа(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор нитрата железа(II). Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение
Слайд 31Задание 22
Для проведения эксперимента предложены следующие реактивы: растворы аммиака, серной кислоты,
соляной кислоты, хлорида бария и сульфата натрия. . Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида аммония. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
Слайд 32
ЗАДАЧИ ДЛЯ ДОМАШНЕГО ЗАДАНИЯ.docx
1.Какой объём (н.у.) углекислого газа выделится при
взаимодействии избытка раствора карбоната калия с 584 г раствора соляной кислоты с массовой долей растворённого вещества 10%. (17,92 л)
2. При пропускании 2,24 л аммиака (н.у.) через раствор серной кислоты с массовой долей 8% образовался сульфат аммония. Определите массу исходного раствора серной кислоты. (61,25 г)
3. При пропускании углекислого газа через раствор гидроксида бария с массовой долей растворённого вещества 16% образовался осадок массой 59,1%. Вычислите массу исходного раствора гидроксида бария. (320,6 г)
4. После пропускания 5,6 л сернистого газа через раствор гидроксида натрия получили раствор массой 521 г. Вычислите массовую долю соли в образовавшемся растворе. (6,04%)
5. Вычислите массовую долю серной кислоты, содержащейся в 78,4 г раствора, необходимого для взаимодействия с цинком, если в результате реакции выделилось 2,24 л газа (н.у.). (12,5%)