- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Железо. Свойства. Соединения железа.
Содержание
- 1. Презентация к уроку Железо. Свойства. Соединения железа.
- 2. Положение в Периодической системе
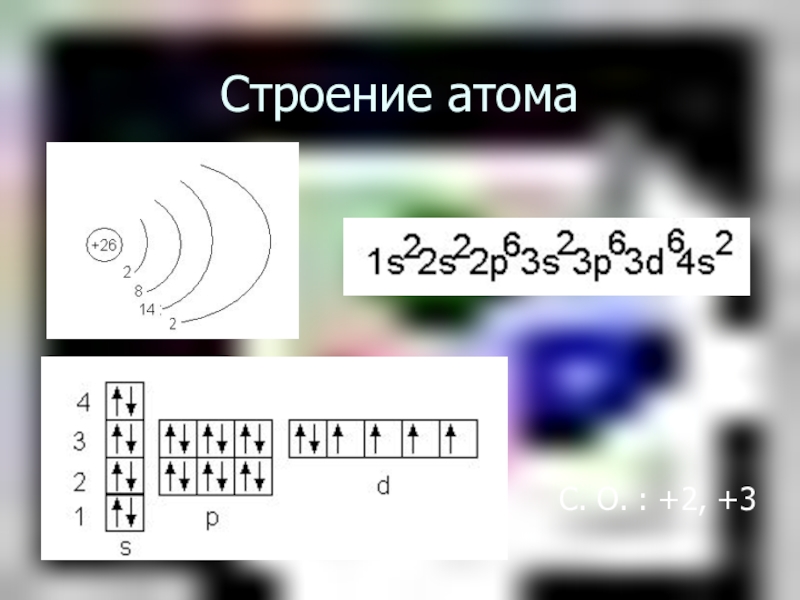
- 3. Строение атомаС. О. : +2, +3
- 4. Простое вещество
- 5. Физические свойстваТвердоеСеро-серебристоеБлестящееХорошо проводит тепло и электрический токДостаточно ковкое и пластичноеОбладает магнитными свойствами
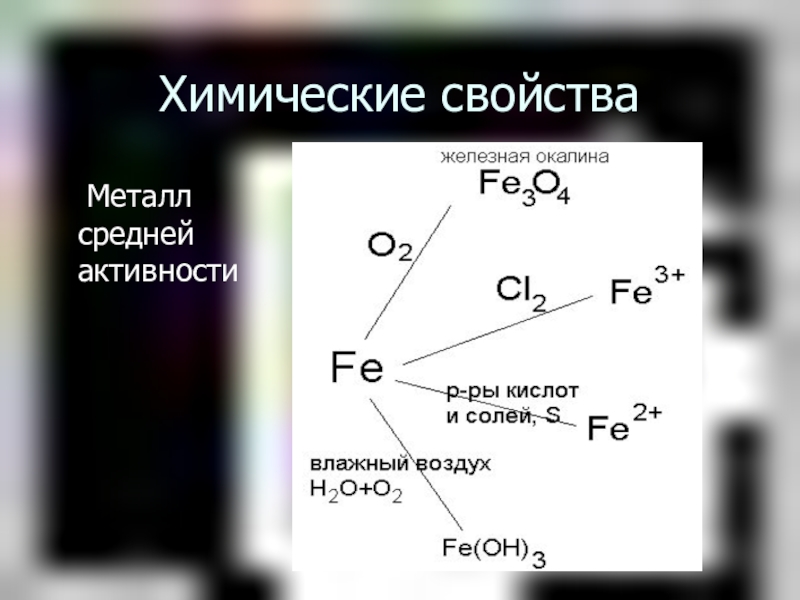
- 6. Химические свойства Металл средней активности
- 7. Химические свойства3Fe + 2O2 = Fe3O42Fe +
- 8. 3. Взаимодействие с простыми веществами:3.1 Горит в
- 9. 7. ОКИСЛЕНИЕ ЖЕЛЕЗАПри хранении водных растворов солей
- 10. 6. С КИСЛОТАМИ: С соляной и разбавленной (приблизительно
- 11. 4.Железо вытесняет из растворов солей металлы, находящиеся
- 12. Железо — активный металл. На воздухе образуется
- 13. Оксиды железа
- 14. Гидроксиды железа
Положение в Периодической системе
Слайд 5Физические свойства
Твердое
Серо-серебристое
Блестящее
Хорошо проводит тепло и электрический ток
Достаточно ковкое и пластичное
Обладает магнитными
свойствами
Слайд 7Химические свойства
3Fe + 2O2 = Fe3O4
2Fe + 3Cl2 = 2FeCl3
Fe +
2HCl = FeCl2 + H2
Fe + S = FeS
Fe + CuSO4 = FeSO4 + Cu
Разобрать уравнение с окислительно-восстановительной точки зрения
Fe + O2 + H2O = Fe(OH)3
Fe + S = FeS
Fe + CuSO4 = FeSO4 + Cu
Разобрать уравнение с окислительно-восстановительной точки зрения
Fe + O2 + H2O = Fe(OH)3
Слайд 8
3. Взаимодействие с простыми веществами:
3.1 Горит в кислороде
3 Fe
+ 2 O2 =Fe3 O4
3.2 Реагирует с хлором
2Fe + 3 Cl2 = 2FeCl3
3.3 Взаимодействует с серой
Fe + S = FeS
3.2 Реагирует с хлором
2Fe + 3 Cl2 = 2FeCl3
3.3 Взаимодействует с серой
Fe + S = FeS
Слайд 97. ОКИСЛЕНИЕ ЖЕЛЕЗА
При хранении водных растворов солей железа(II) наблюдается окисление железа(II)
до железа(III):
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
8.Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
4FeCl2 + O2 + 2H2O = 4Fe(OH)Cl2
8.Соединения железа (III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 = 3FeCl2
Слайд 106. С КИСЛОТАМИ:
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо
реагирует с образованием солей железа(II):
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции. Растворяется железо в разбавленной азотной кислоте.
8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку оксида, что металл становится совершенно пассивным и уже не вступает в другие реакции. Растворяется железо в разбавленной азотной кислоте.
8Fe+30HNO3=8Fe(NO3)3+3NH4NO3+9H2O
Слайд 11
4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений
правее железа:
Fe + CuSO4 = FeSO4 + Cu
5. При высокой температуре (700-900°С) железо реагирует с парами воды:
3Fe+4Н2O=Fe3O4+4Н2
5. При высокой температуре (700-900°С) железо реагирует с парами воды:
3Fe+4Н2O=Fe3O4+4Н2
Слайд 12
Железо — активный металл.
На воздухе образуется защитная оксидная пленка, препятствующая ржавению
металла.
3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III).
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
2. Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III).
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3