- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Соли азотной кислоты
Содержание
- 1. Презентация к уроку Соли азотной кислоты
- 2. План урока: Номенклатура нитратов.Физические свойства.Химические свойства.Применение.
- 3. Цели урока:Изучить состав и свойства солей азотной кислотыВыяснить их нахождение в природеПроанализировать применение нитратов
- 4. Какая проблема главная?1.Познакомиться со свойствами нитратов.2. Выяснить
- 5. Применяется как удобрение, для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей. Нитрат натрия
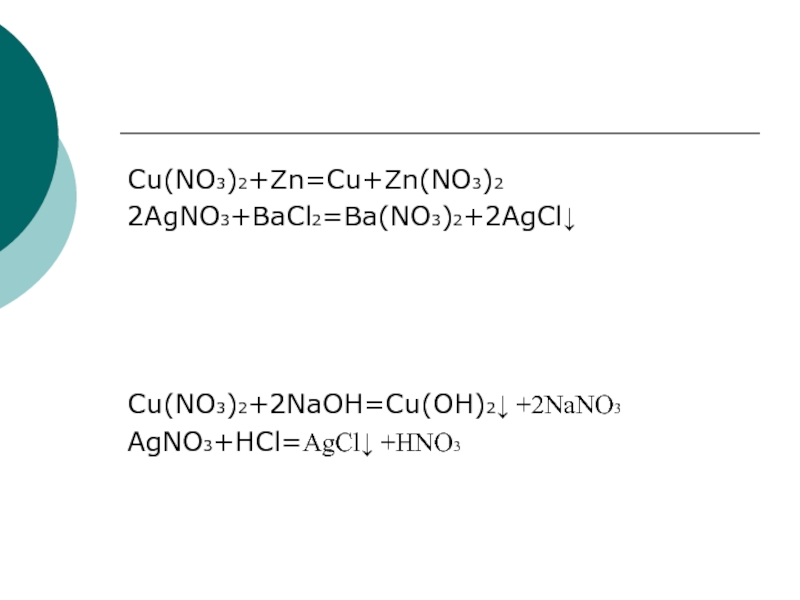
- 6. Cu(NO3)2+Zn=Cu+Zn(NO3)22AgNO3+BaCl2=Ba(NO3)2+2AgCl↓Cu(NO3)2+2NaOH=Cu(OH)2↓ +2NaNO3AgNO3+HCl=AgCl↓ +HNO3
- 7. При нагревании нитраты разлагаются тем полнее, чем
- 8. Ca(NO3)2=Ca(NO2)2+O22Zn(NO3)2=2ZnO+4NO2+O22KNO3=2KNO2+O2Hg(NO3)2=Hg+2NO2+O2
- 9. Кристаллическое вещество белого цвета. Температура плавления 169,6
- 10. Слайд 10
- 11. Нитрат калия Применяется как удобрение, в пиротехнике как окислитель.
- 12. Какая проблема главная?1.Познакомиться со свойствами нитратов.2. Выяснить
- 13. Выводы:Соли азотной кислоты – нитраты.Нитраты щелочных металлов,
- 14. Ключи к тестам:I вариант: 1-а,
- 15. Слайд 15
План урока: Номенклатура нитратов.Физические свойства.Химические свойства.Применение.
Слайд 3Цели урока:
Изучить состав и свойства солей азотной кислоты
Выяснить их нахождение в
природе
Проанализировать применение нитратов
Проанализировать применение нитратов
Слайд 4Какая проблема главная?
1.Познакомиться со свойствами нитратов.
2. Выяснить значение нитратов.
3. Научиться использовать
их, не причиняя вред своему здоровью.
Слайд 5
Применяется как удобрение, для получения взрывчатых веществ, ракетного топлива и пиротехнических
смесей.
Нитрат натрия
Слайд 6
Cu(NO3)2+Zn=Cu+Zn(NO3)2
2AgNO3+BaCl2=Ba(NO3)2+2AgCl↓
Cu(NO3)2+2NaOH=Cu(OH)2↓ +2NaNO3
AgNO3+HCl=AgCl↓ +HNO3
Слайд 7При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду
напряжений стоит металл, образующий соль.
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb Cu Ag Hg Au
нитрит + О2
оксид металла + NO2 + O2
Ме + NO2 + O2
2NaNO3 = 2NaNO2 + O2
2Pb(NO3)2= 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
Слайд 9
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше
этой температуры начинается постепенное разложение вещества, а при температуре 210°С происходит полное разложение.
Нитрат аммония
Слайд 12Какая проблема главная?
1.Познакомиться со свойствами нитратов.
2. Выяснить значение нитратов.
3. Научиться использовать
их, не причиняя вред своему здоровью.
Слайд 13Выводы:
Соли азотной кислоты – нитраты.
Нитраты щелочных металлов, кальция и аммония –
селитры.
Особое свойство нитратов – разложение при нагревании.
При использовании растительной продукции необходимо знать правила безопасности.
Особое свойство нитратов – разложение при нагревании.
При использовании растительной продукции необходимо знать правила безопасности.
Слайд 14Ключи к тестам:
I вариант: 1-а, 2-а, 3-б,
4-б, 5 –б
II вариант: 1-б, 2-в, 3-а, 4-а, 5-а
«5»- 15 баллов и выше
«4»- 10-14 баллов
«3»- меньше 10 баллов
II вариант: 1-б, 2-в, 3-а, 4-а, 5-а
«5»- 15 баллов и выше
«4»- 10-14 баллов
«3»- меньше 10 баллов