2КСI + 3O2;
Б) N2 + 3H2 = 2 NH3;
В) AgNO3 + NaCI = AgCI + NaNO3;
Г) 2SO2 + O2 = 2SO3;
Д) KOH + HCI = KCI + H2O
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Смещение химического равновесия. Принцип Ле Шателье
Содержание
- 1. Презентация к уроку Смещение химического равновесия. Принцип Ле Шателье
- 2. Задание 1 Какие из приведенных химических
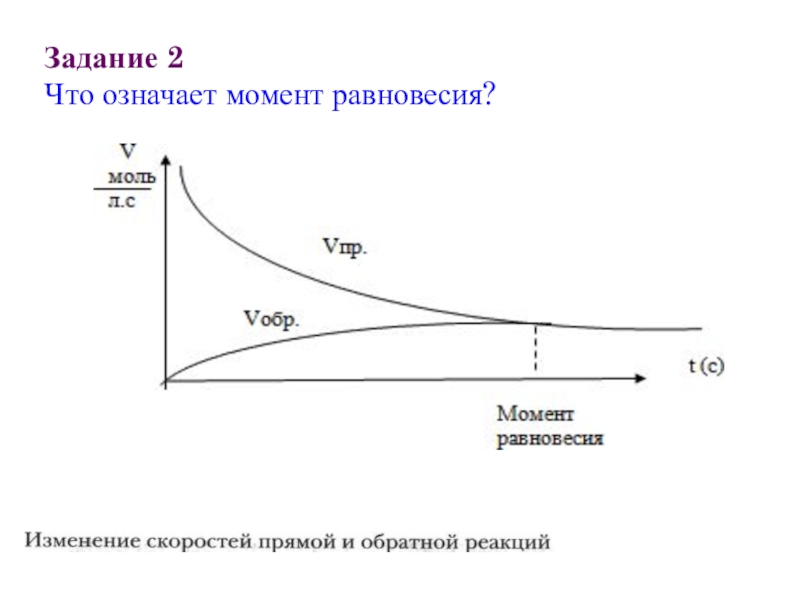
- 3. Задание 2 Что означает момент равновесия?
- 4. Задание 2 Охарактеризуйте химическую реакцию промышленного получения аммиакакатN2 + 3H2 ↔ 2NH3 + QРеакция: соединенияобратимаяэкзотермическаякаталитическаяОВРгомогенная
- 5. Во всех индустриально развитых странах азотная промышленность
- 6. Смещение химического равновесия. Принцип Ле Шателье
- 7. Цель: обобщить знания о состоянии химического равновесия
- 8. Если изучить факторы, влияющие на сдвиг химического равновесия, можно научиться управлять реакцией.
- 9. Принцип Ле ШательеЕсли на систему, находящуюся в
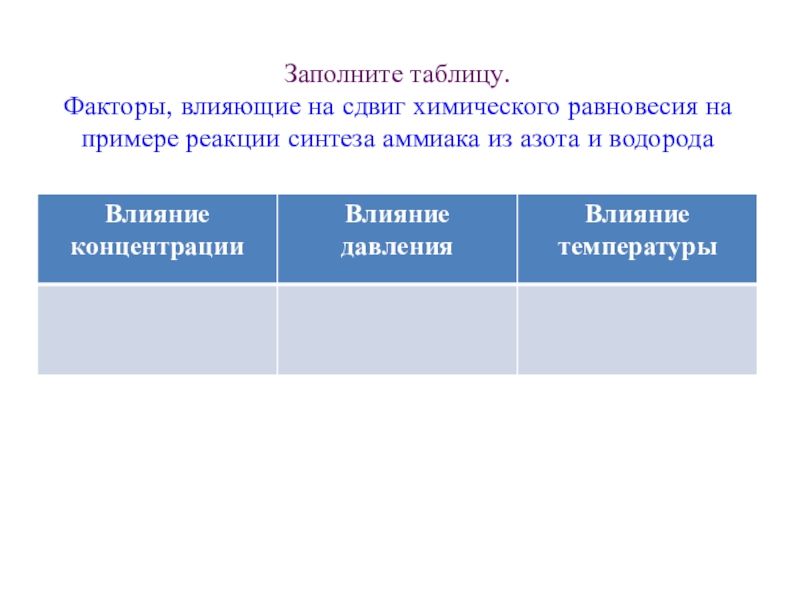
- 10. Заполните таблицу. Факторы, влияющие на сдвиг
- 11. Факторы, влияющие на сдвиг химического равновесия
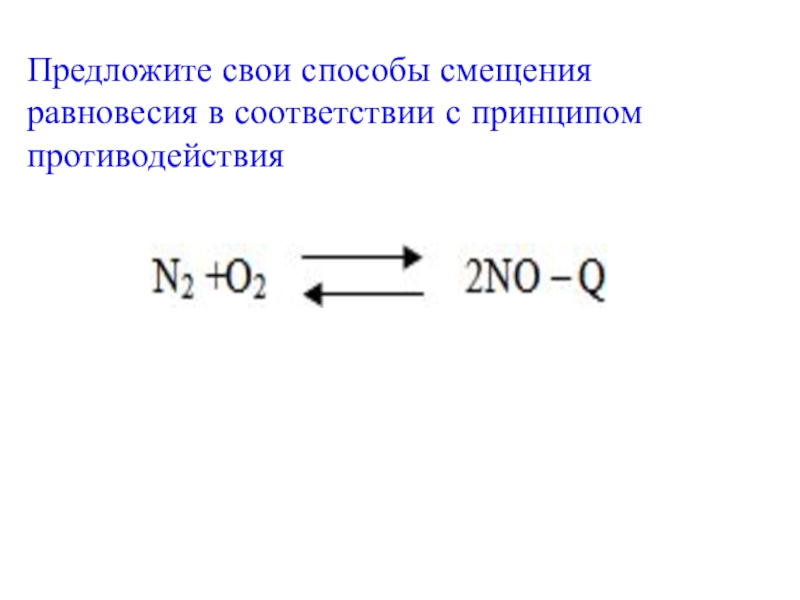
- 12. Предложите свои способы смещения равновесия в соответствии с принципом противодействия
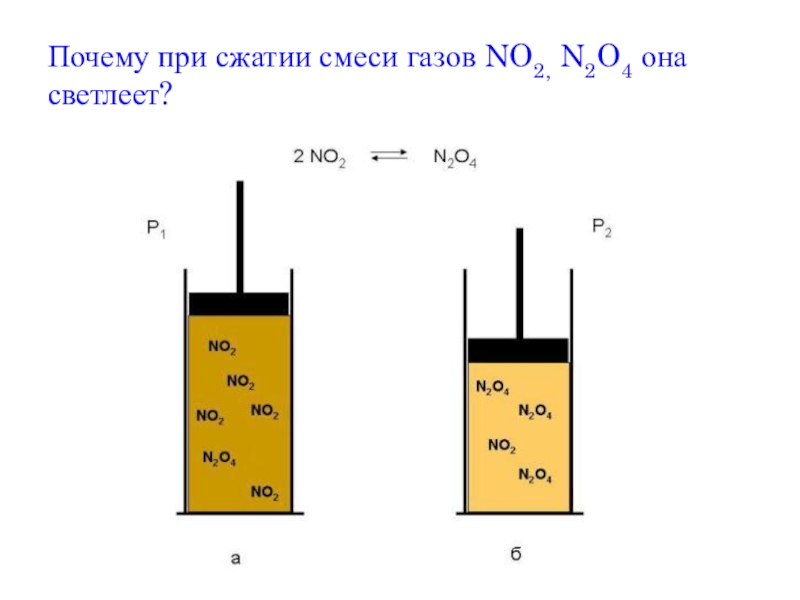
- 13. Почему при сжатии смеси газов NO2, N2O4 она светлеет?
- 14. Почему для сложной гетерогенной химической реакции можно
- 15. Какие утверждения верны? 1.Повышение температуры смещает
- 16. Слайд 16
- 17. Во всех индустриально развитых странах азотная промышленность
- 18. Домашнее заданиеИзучить §14, стр.150-151. Упражнения 1-3, стр. 152
Задание 1 Какие из приведенных химических реакций являются обратимыми?А) 2КCIO3 = 2КСI + 3O2;Б) N2 + 3H2 = 2 NH3;В) AgNO3 + NaCI = AgCI + NaNO3;Г) 2SO2 + O2 =
Слайд 4Задание 2
Охарактеризуйте химическую реакцию промышленного получения аммиака
кат
N2 + 3H2 ↔ 2NH3
+ Q
Реакция:
соединения
обратимая
экзотермическая
каталитическая
ОВР
гомогенная
Реакция:
соединения
обратимая
экзотермическая
каталитическая
ОВР
гомогенная
Слайд 5Во всех индустриально развитых странах азотная промышленность является одной из основных
ведущих отраслей. Историю развития производства аммиака можно рассматривать как борьбу за повышение полезного использования электрической, тепловой и механической энергии. Из-за обратимости реакции КПД производства не превышает 50%.
Можно ли сделать так, чтобы КПД на современном производстве аммиака и других важнейших веществ значительно увеличился?
Предложите способы увеличения выхода продукта прямой реакции:
Можно ли сделать так, чтобы КПД на современном производстве аммиака и других важнейших веществ значительно увеличился?
Предложите способы увеличения выхода продукта прямой реакции:
N2 + 3H2 ↔ 2NH3 + Q
Слайд 8Если изучить факторы, влияющие на сдвиг химического равновесия, можно научиться управлять
реакцией.
Слайд 9Принцип Ле Шателье
Если на систему, находящуюся в равновесии оказывается воздействие
(изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Слайд 10Заполните таблицу. Факторы, влияющие на сдвиг химического равновесия на примере реакции
синтеза аммиака из азота и водорода
Слайд 11 Факторы, влияющие на сдвиг химического равновесия на примере реакции синтеза аммиака
из азота и водорода
Слайд 14Почему для сложной гетерогенной химической реакции можно предсказать, что изменение давления
не приведет к смещению равновесия?
Fe3O4 (тв) + СО (г) ↔ 3 FeO (тв) + СО2 (г) + Q
Слайд 15Какие утверждения верны? 1.Повышение температуры смещает равновесие в сторону эндотермической реакции. 2. Повышение
температуры увеличивает как скорость прямой, так и обратной реакции.
3. Катализатор влияет на сдвиг химического равновесия.
4. В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или расширении системы.
Слайд 17Во всех индустриально развитых странах азотная промышленность является одной из основных
ведущих отраслей. Историю развития производства аммиака можно рассматривать как борьбу за повышение полезного использования электрической, тепловой и механической энергии. Из-за обратимости реакции КПД производства не превышает 50%.
Можно ли сделать так, чтобы КПД на современном производстве аммиака и других важнейших веществ значительно увеличился?
Предложите способы увеличения выхода продукта прямой реакции:
Можно ли сделать так, чтобы КПД на современном производстве аммиака и других важнейших веществ значительно увеличился?
Предложите способы увеличения выхода продукта прямой реакции:
N2 + 3H2 ↔ 2NH3 + Q