- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Щелочные металлы. Общая характеристика
Содержание
- 1. Презентация к уроку Щелочные металлы. Общая характеристика
- 2. Тема урока: Щелочные металлы. Общая характеристика.
- 3. Проблемные вопросы:Почему щелочные металлы- типичные представители металлов?Почему
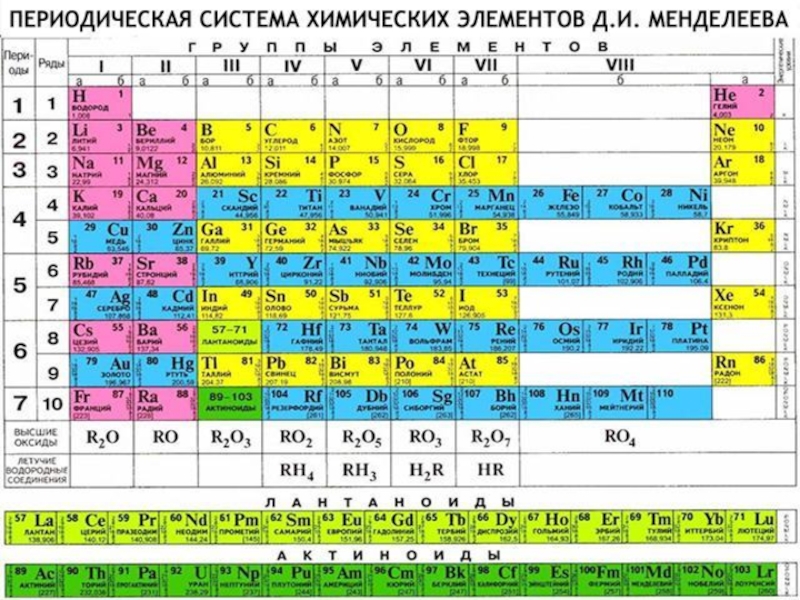
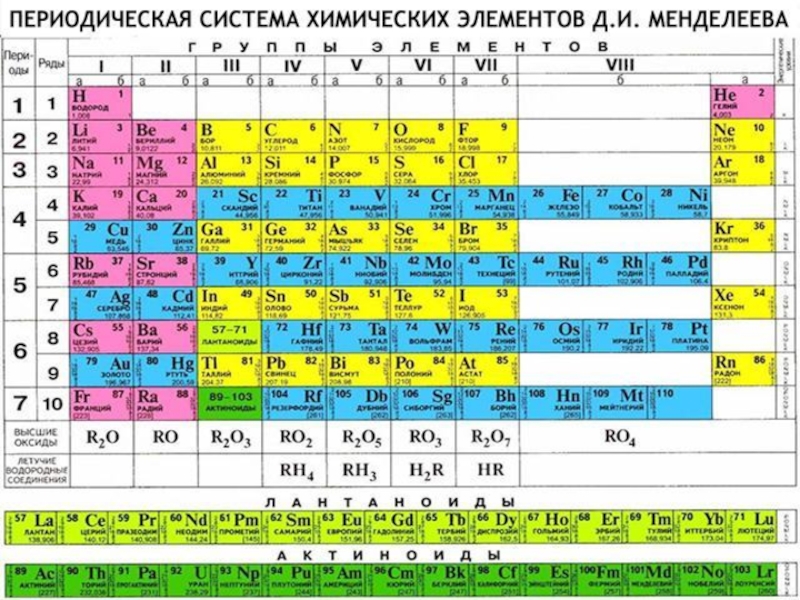
- 4. План урока:Положение щелочных металлов в ПСХЭ Д.И.
- 5. Слайд 5
- 6. История открытия щелочных металлов
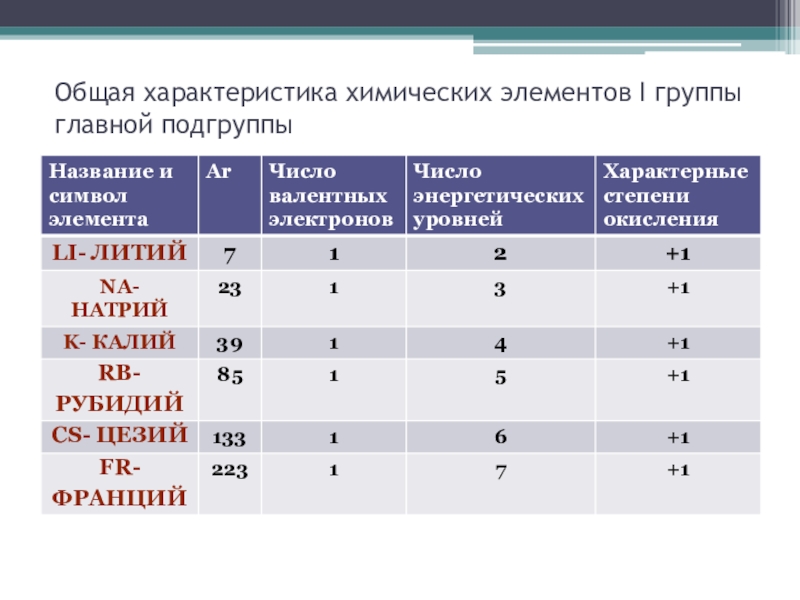
- 7. Общая характеристика химических элементов I группы главной подгруппы
- 8. Общая характеристика химических элементов I группы главной подгруппы
- 9. Выводы:
- 10. Щелочные металлы- простые вещества Физические свойстваСеребристо –
- 11. Щелочные металлыЦезий
- 12. щелочные металлы натрийрубидий
- 13. щелочные металлыкалийлитий
- 14. Химические свойства щелочных металлов+ Н2О →
- 15. Слайд 15
- 16. Упражнение Сравните атомы элементов, поставив знаки >,
- 17. Упражнение Сравните атомы элементов, поставив знаки >,
Слайд 2Тема урока: Щелочные металлы. Общая характеристика.
«Знание только тогда знание,
Слайд 3Проблемные вопросы:
Почему щелочные металлы- типичные представители металлов?
Почему эти металлы называют щелочными?
Почему
Слайд 4План урока:
Положение щелочных металлов в ПСХЭ Д.И. Менделеева
История открытия щелочных металлов
Строение
Физические свойства щелочных металлов
Химические свойства щелочных металлов
Применение соединений щелочных металлов
Подведение итогов
Слайд 10Щелочные металлы- простые вещества
Физические свойства
Серебристо – белые, мягкие, обладают блеском, легкие,
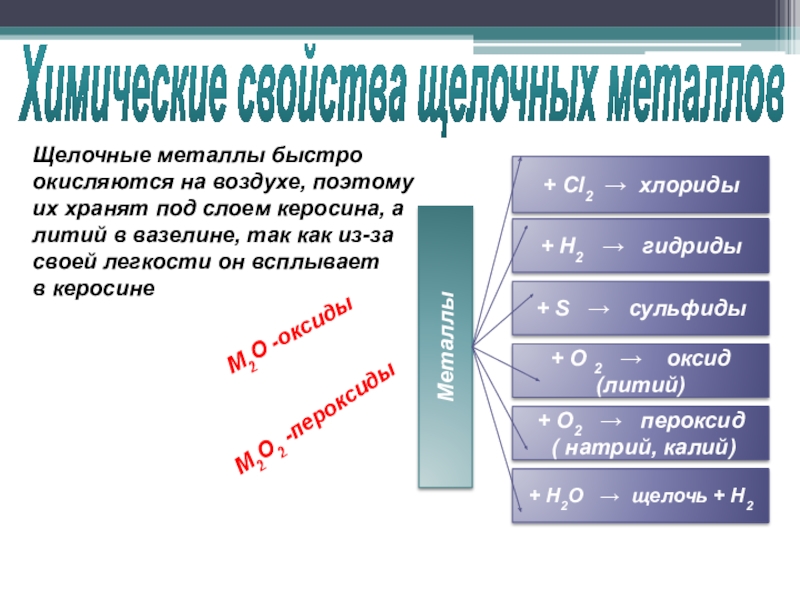
Слайд 14Химические свойства щелочных металлов
+ Н2О → щелочь + Н2
+ Н2
+ S → сульфиды
+ Cl2 → хлориды
+ O 2 → оксид (литий)
+ О2 → пероксид
( натрий, калий)
Металлы
Щелочные металлы быстро
окисляются на воздухе, поэтому
их хранят под слоем керосина, а
литий в вазелине, так как из-за
своей легкости он всплывает
в керосине
М2О -оксиды
М2О2 -пероксиды
Слайд 16Упражнение
Сравните атомы элементов, поставив знаки >, < или = вместо *
I
А) заряд ядра
Li * Rb ; Na * Al
Б) число электронных слоев
Li * Rb ; Na * Al
В) число электронов на внешнем уровне
Li * Rb ; Na * Al
Г) радиус атома
Li * Rb ; Na * Al
Д) восстановительные свойства
Li * Rb ; Na * Al
II вариант
А) заряд ядра
K * Ca ; Na * Rb
Б) число электронных слоев
K * Ca ; Na * Rb
В) число электронов на внешнем уровне
K * Ca ; Na * Rb
Г) радиус атома
K * Ca ; Na * Rb
Д) восстановительные свойства
K * Ca ; Na * Rb
Слайд 17Упражнение
Сравните атомы элементов, поставив знаки >, < или = вместо *
I
А) заряд ядра
Li
Li
Li =Rb ; Na < Al
Г) радиус атома
Li < Rb ; Na > Al
Д) восстановительные свойства
Li < Rb ; Na > Al
II вариант
А) заряд ядра
K < Ca ; Na < Rb
Б) число электронных слоев
K = Ca ; Na < Rb
В) число электронов на внешнем уровне
K < Ca ; Na = Rb
Г) радиус атома
K > Ca ; Na < Rb
Д) восстановительные свойства
K > Ca ; Na < Rb