- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Расчёты по химическим уравнениям
Содержание
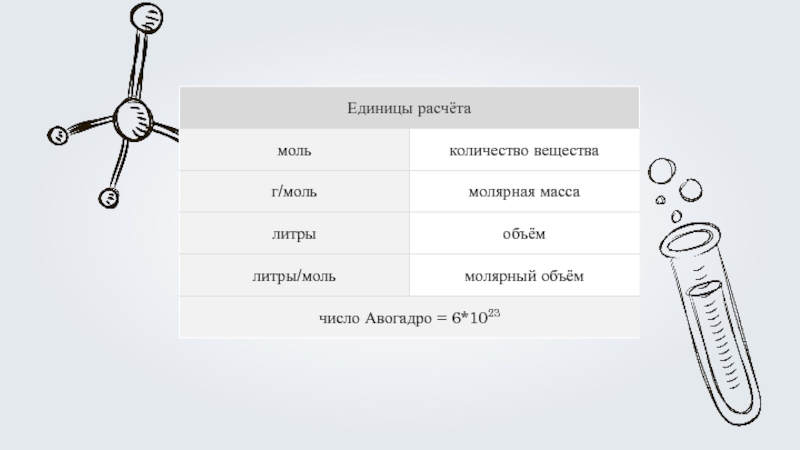
Слайд 4Алгоритм решения расчетных задач по уравнению реакции:
Составление уравнения реакции.
2. Привидение
3. Обозначение найденных данных и то, что необходимо найти над формулами соответствующих веществ через х икс и у игрек.
4. Нахождение количества исходных веществ.
5. Ответ.
Слайд 5Задача 1
Дано:
2Na + 2H2O = 2NaOH + H2↑
m (Na) = 2,3
m (NaOH) — ?
Решение:
2Na + 2H2O = 2NaOH + H2↑
2,3 г
x
M (Na) = 2,3 г/моль
m (Na) = M (Na) ⋅ n (Na)
m (Na) = 2 моль ⋅ 23 г/моль = 46 г.
M (NaОН) = 23 + 16 +1 = 40 г/моль
m (NaОH) = 2 моль ⋅ 40 г/моль = 80 г.
46 г — 80 г
2,3 г — x
Ответ: m (NaOH) =4 г.
Слайд 6Задача 2
Дано:
m (СaO) = 223 т
m (СaCO 3) — ?
Решение:
223 т
x
M
M (CaO) = 40 + 16 = 56 т/моль
m = M ⋅ n
m (CaCО3) = 1 кмоль ⋅ 100 т/кмоль = 100 т
100 т — 56 т
x т — 224 т
Ответ: m (СaCO 3) = 400 т.
m (CaО) = 1 кмоль ⋅ 56 т/кмоль = 56 т
Слайд 7Задача 3
Дано:
m (ZnS) = 300 г
V (O 2) — ?
Решение:
300 г
n
M (ZnS) = 65 + 32 = 97 г/моль
Ответ: V(O2) = 100,8 л ; n (ZnO) = 3 моль.
2ZnS + 3O2 = 2ZnO + 2SO2
n (ZnO) — ?
2ZnS + 3O2 = 2ZnO + 2SO2
V m = 22,4 л
V — ?