- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по теме:Спирты
Содержание
- 1. Презентация к уроку по теме:Спирты
- 2. Содержание
- 3. СПИРТЫСпиртами называются органические вещест-ва, молекулы которых содержат
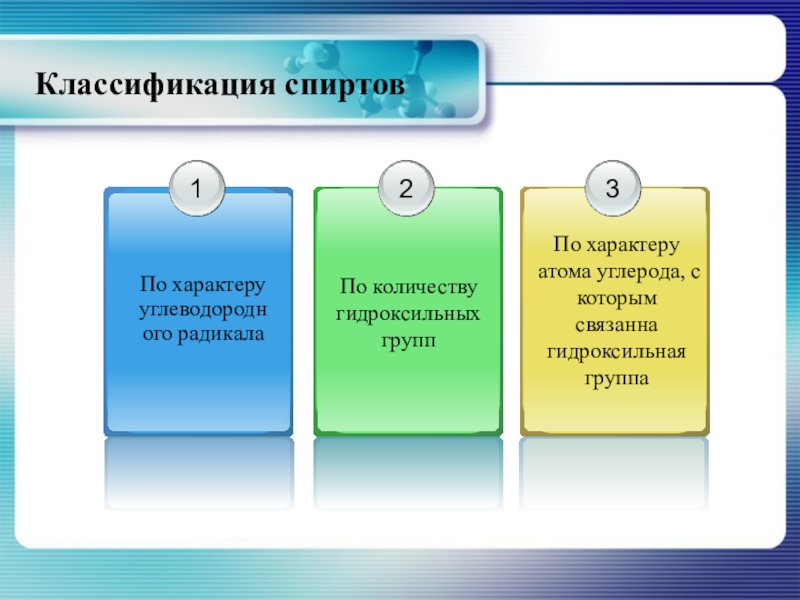
- 4. Классификация спиртов
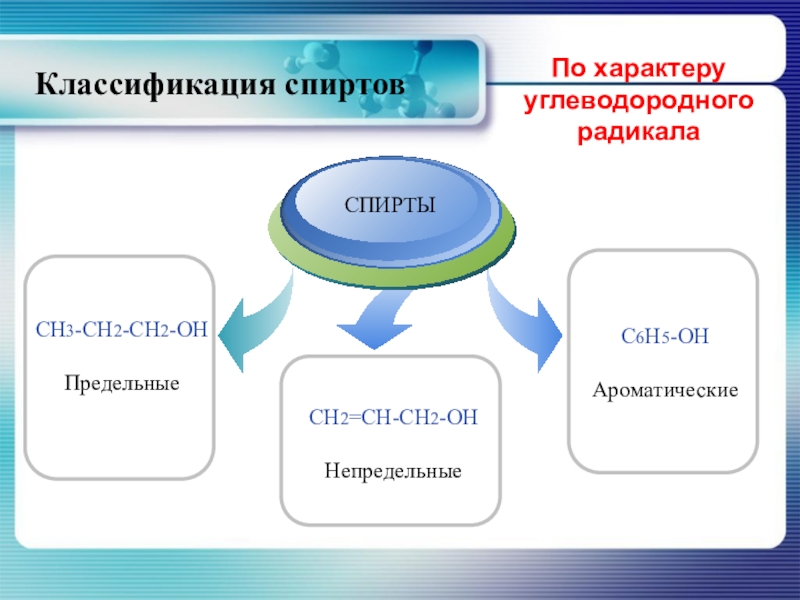
- 5. По характеру углеводородного радикалаКлассификация спиртов
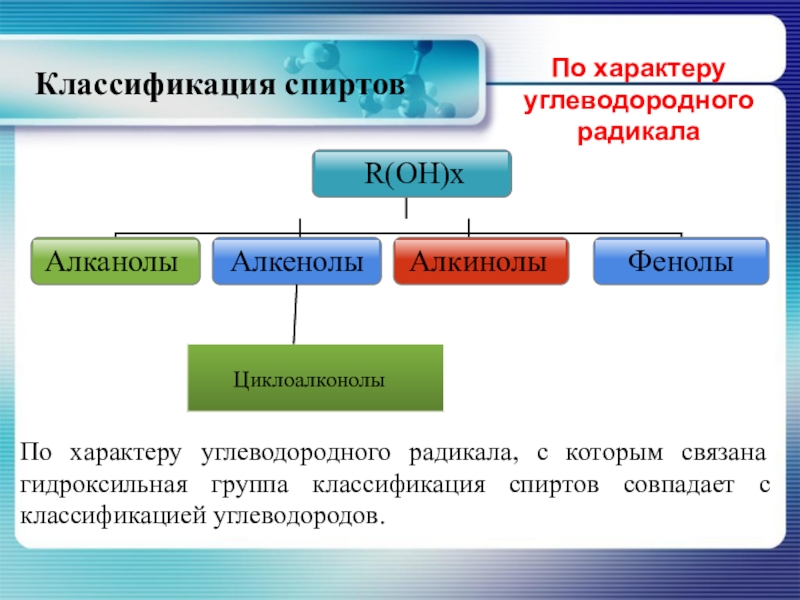
- 6. По характеру углеводородного радикала, с которым связана
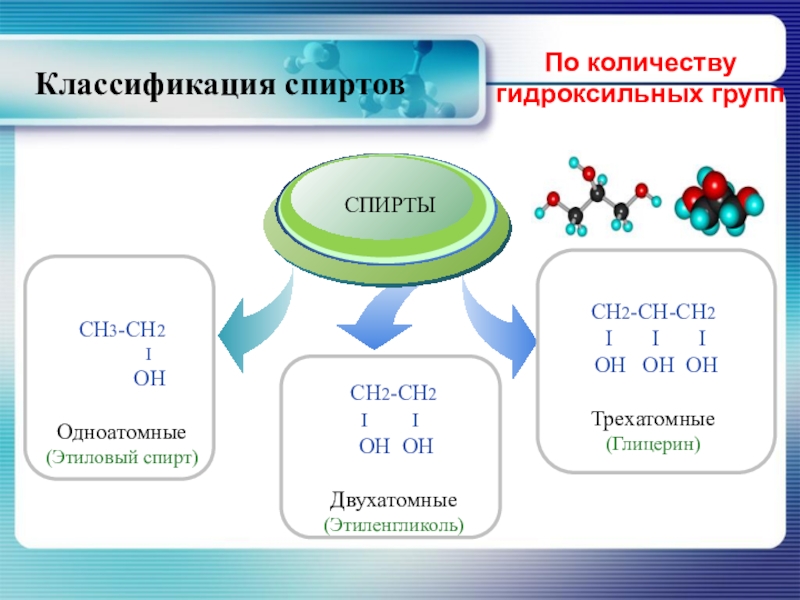
- 7. По количеству гидроксильных группКлассификация спиртов
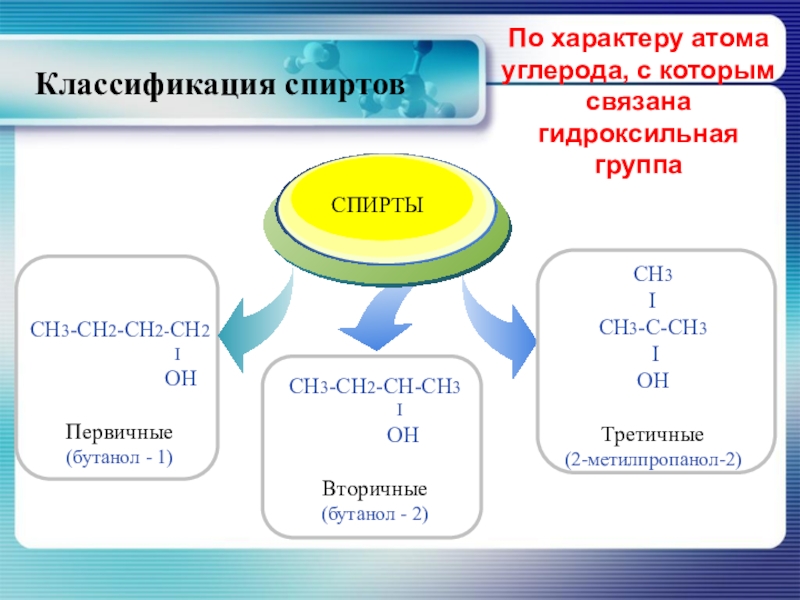
- 8. По характеру атома углерода, с которым связана гидроксильная группаКлассификация спиртов
- 9. Гомологический ряд предельных одноатомных спиртовАлканолы образуют гомологический
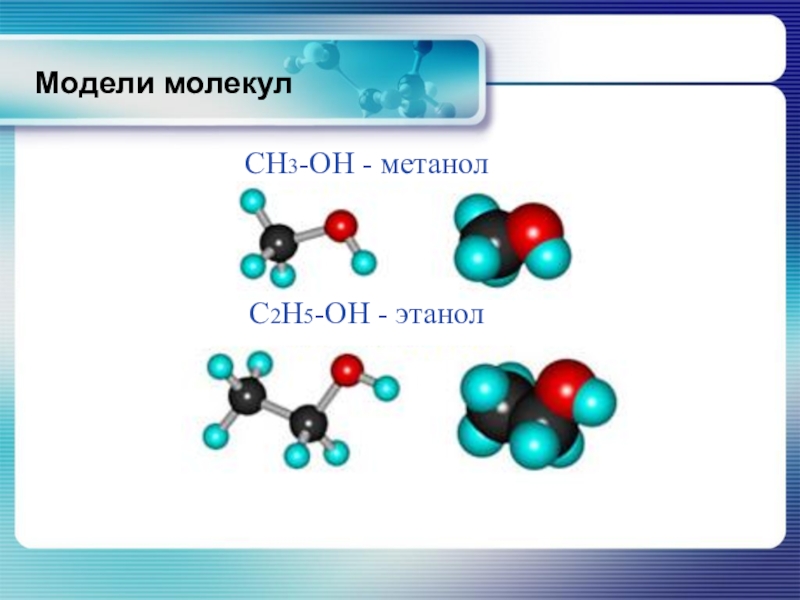
- 10. CH3-OH - метанолC2H5-OH - этанолМодели молекул
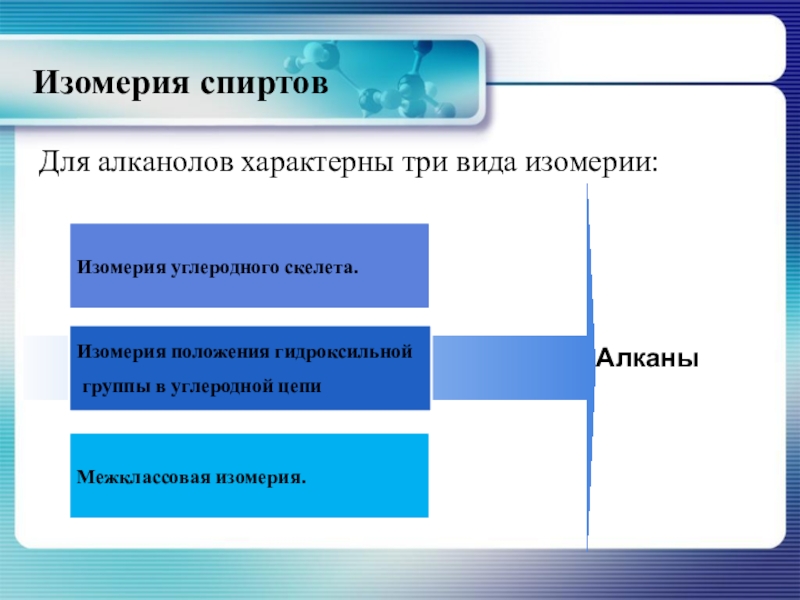
- 11. Изомерия спиртовДля алканолов характерны три вида изомерии:Межклассовая изомерия.
- 12. CH3-CH2-CH2-CH2-OH бутанол-1 (н-бутиловый спирт)Первым из спиртов, для
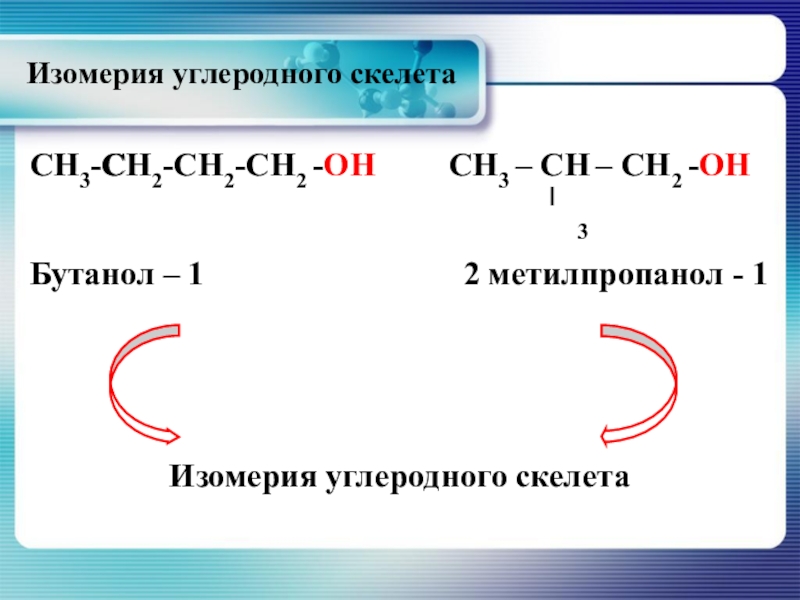
- 13. СН3-СН2-СН2-СН2 -ОНСН3 – СН – СН2 -ОНБутанол
- 14. СН3-СН2-СН2-СН2- ОНСН3 - СН -СН2-СН 3ОНБутанол
- 15. СН3СН2 – О - СН2СН3Бутанол-1
- 16. Физические свойства спиртовАлканолы являются бесцветными жидкостями или
- 17. Температура кипения
- 18. Строение молекулы этанола
- 19. Высокая температура кипения спиртов, а так же
- 20. Химические свойства спиртовРеакционная способность спиртов обусловлена наличием
- 21. Типы реакций
- 22. CH3 – CH2 - OHNaH2 ↑Взаимодействие спиртов
- 23. Реакция замещения –ОН группы Наибольшее
- 24. R – OH + H – X
- 25. Реакция дегидратации Для алканолов характерно
- 26. Внутримолекулярная
- 27. Внутримолекулярная дегидратация алканолов может
- 28. Межмолекулярная дегидратация происходит при
- 29. Дегидратация вторичных спиртов При дегидратации
- 30. R – C
- 31. Окисление первичных спиртов протекает при действии сильных
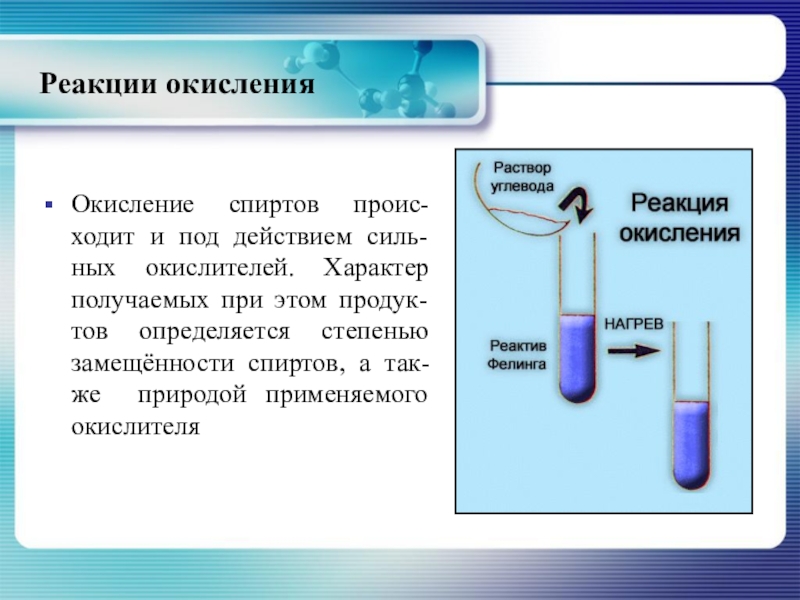
- 32. Реакции окисленияОкисление спиртов проис-ходит и под действием
- 33. Реакции окисления
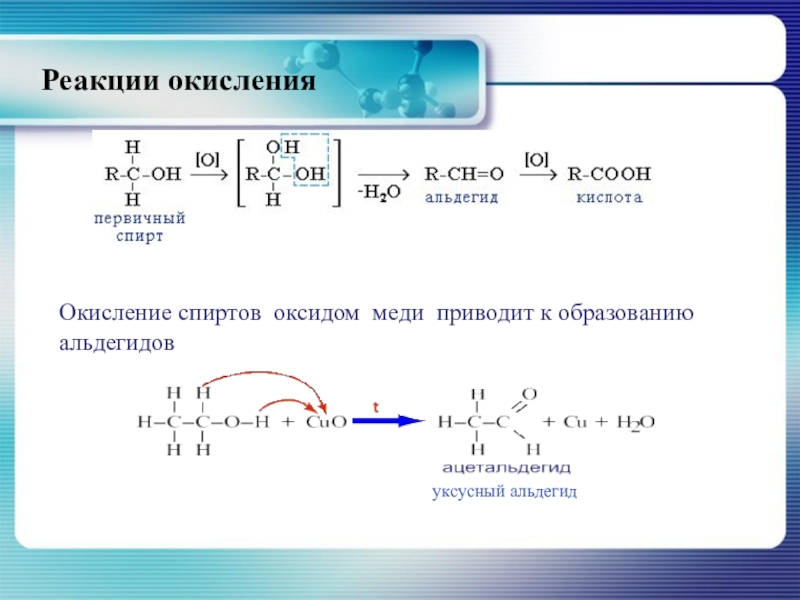
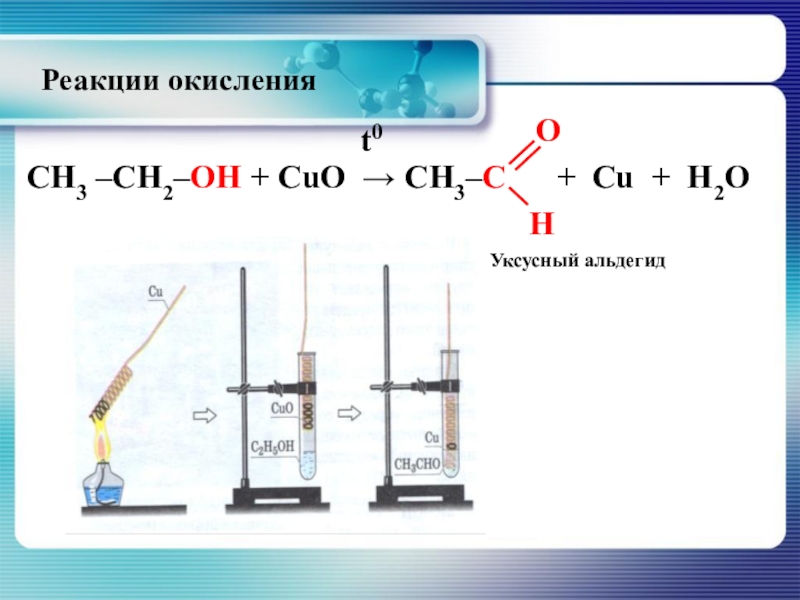
- 34. Окисление спиртов оксидом меди приводит к образованию альдегидовуксусный альдегидРеакции окисления
- 35. Реакции окисленияУксусный альдегид
- 36. www.themegallery.comМногоатомные спирты являются более сильными кислотами, чем
- 37. Третичные спирты могут окисляться только в жёстких
- 38. Дегидрирование спиртовПри пропускании паров спирта при 200
- 39. Получение спиртовМетанол получают гидрированием оксида углерода (II)
- 40. 1. Гидролиз галогеналканов. C2H5 – СL +
- 41. Применение спиртов
- 42. Применение метанолаПрекрасный растворитель; Сырье для производства формальдегида
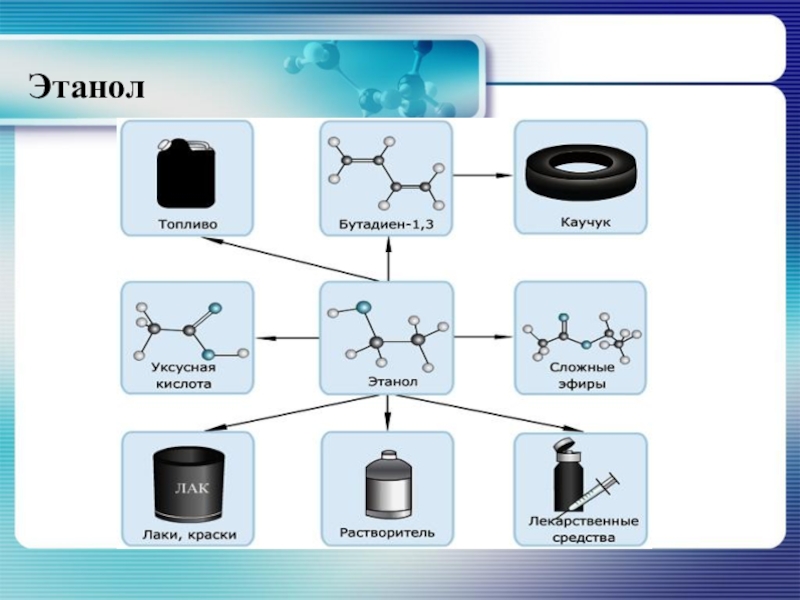
- 43. Применение этанолаПрименение этанола обширно. Но, в связи
- 44. Этанол
- 45. Этиленгликоль Антифризы заливаются в системы охлаждения, в
- 46. Глицерин Значительное количество глицерина идет на изготовление
- 47. Историческая справкаСлово «спирт» происходит от древнего латинского
- 48. ЯДОВИТЫЙ НАПИТОКНеумеренное потребление алкогольных напитков приводит к
- 49. КЛИН КЛИНОММетиловый спирт очень опасен для человека.
- 50. Это интересно! Британские астрономы объявили
- 51. Это интересно!Бразилия славится не только футболом. Это
- 52. Это интересно!Глицерин открыл выдающийся шведский химик Карл
- 53. Знаете ли вы что…… выражение “манна небесная”
- 54. ВопросыКак в народе называют этиловый спирт? Дать
- 55. Винный спирт
- 56. Одноатомные спирты – гидроксильные производные предельных алифатических углеводородов.
- 57. СnH2n+1OH
- 58. Товий Егорович Ловиц
- 59. первичные спирты вторичные спирты третичные спирты
- 60. первичные спирты вторичные спирты третичные спирты
- 61. Гидратация алкенов Гидролиз галогеналканов Брожение глюкозы
- 62. Окисление алкенов Щелочной гидролиз полигалогенопроизводных алканов
- 63. Этиловым спиртом
- 64. В водорослях и лишайниках
- 65. ЗапомниВодородная связь – это связь между атомом
- 66. Словарь терминовАльдегиды - образуются при окислении первичных
- 67. Спасибо за внимание !
Слайд 3СПИРТЫ
Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных
R - OH
Слайд 6По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов
Классификация спиртов
По характеру углеводородного радикала
Слайд 9Гомологический ряд предельных одноатомных спиртов
Алканолы образуют гомологический ряд c общей формулой
Названия алканолов по систематической номенклатуре строятся из названий соответствующих алканов путём добавления суффикса «ол»
Слайд 12CH3-CH2-CH2-CH2-OH
бутанол-1
(н-бутиловый спирт)
Первым из спиртов, для которого характерны три вида изомерии, является
Изомерия углеродного скелета
Слайд 13СН3-СН2-СН2-СН2 -ОН
СН3 – СН – СН2 -ОН
Бутанол – 1
Изомерия углеродного скелета
СН
3
Изомерия углеродного скелета
Слайд 14СН3-СН2-СН2-СН2- ОН
СН3 - СН -СН2-СН
3
ОН
Бутанол -1
Изомерия положения функциональной группы
Изомерия положения гидроксильной группы в углеродной цепи
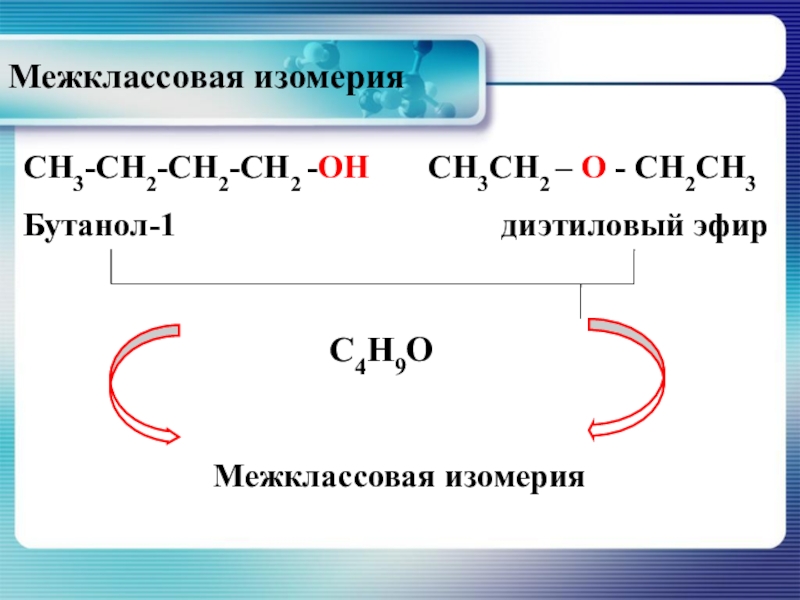
Слайд 15СН3СН2 – О - СН2СН3
Бутанол-1
СН3-СН2-СН2-СН2 -ОН
С4Н9О
Межклассовая изомерия
Межклассовая изомерия
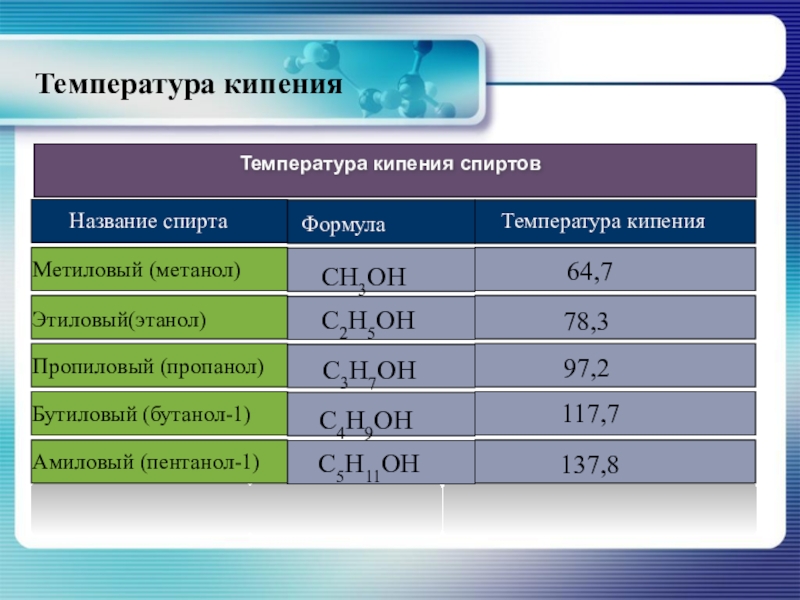
Слайд 16Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным
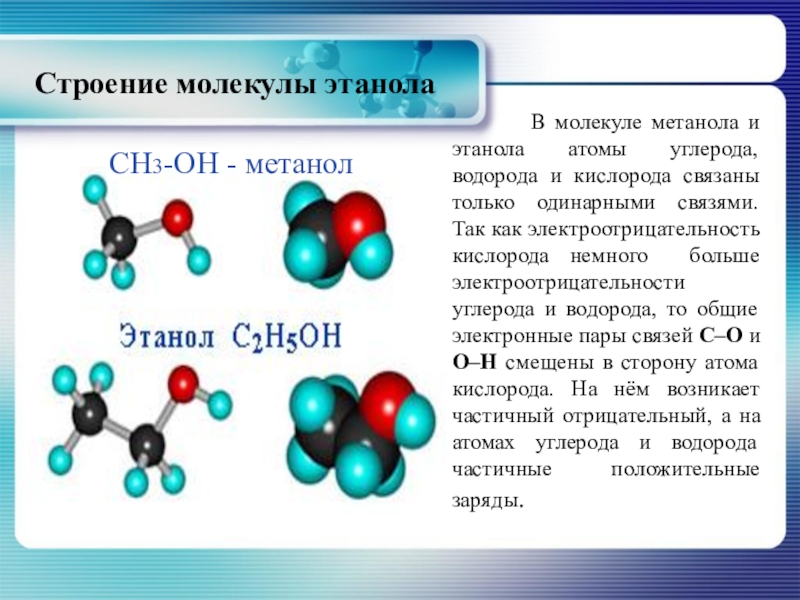
Слайд 18Строение молекулы этанола
В молекуле метанола и
CH3-OH - метанол
Слайд 19Высокая температура кипения спиртов, а так же хорошая растворимость в воде
Физические свойства спиртов
Слайд 20Химические свойства спиртов
Реакционная способность спиртов обусловлена наличием в их молекулах полярных
Спирты проявляют слабые кислотно – основные свойства
Слайд 22CH3 – CH2 - O
H
Na
H2 ↑
Взаимодействие спиртов с металлическим натрием
Этилат натрия
+
2CH3
Реакция замещения водорода -ОН группы
Как слабые кислоты алканолы могут реагировать со щелочными металлами. Образующиеся при этом металлические производные спиртов называются алкоголятами.
Слайд 23Реакция замещения –ОН группы
Наибольшее практическое значение из реакций
Слайд 24R – OH + H – X ↔ R – X
Реакционная способность алканолов
R3С – OH > R2CH – OH > RCH2 – OH
Реакционная способность HX
HI > HBr > HCl >> HF
Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота
Реакции алканолов
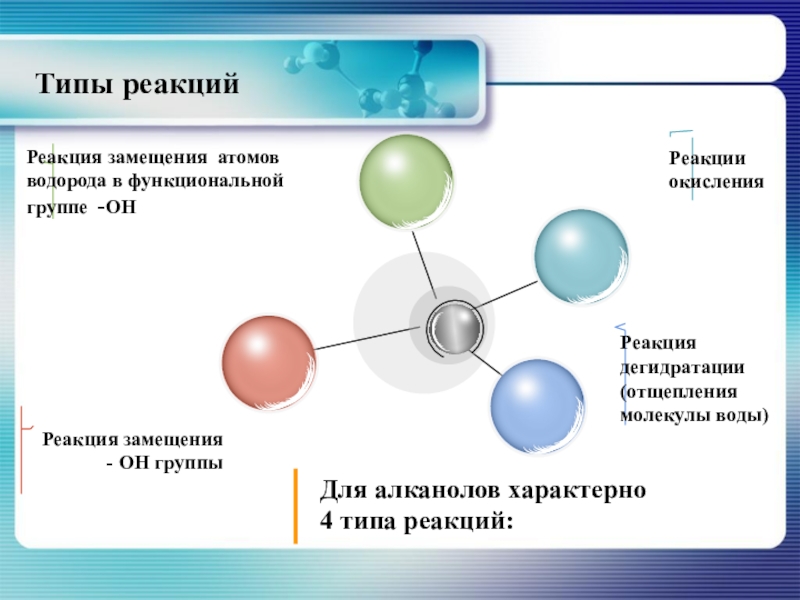
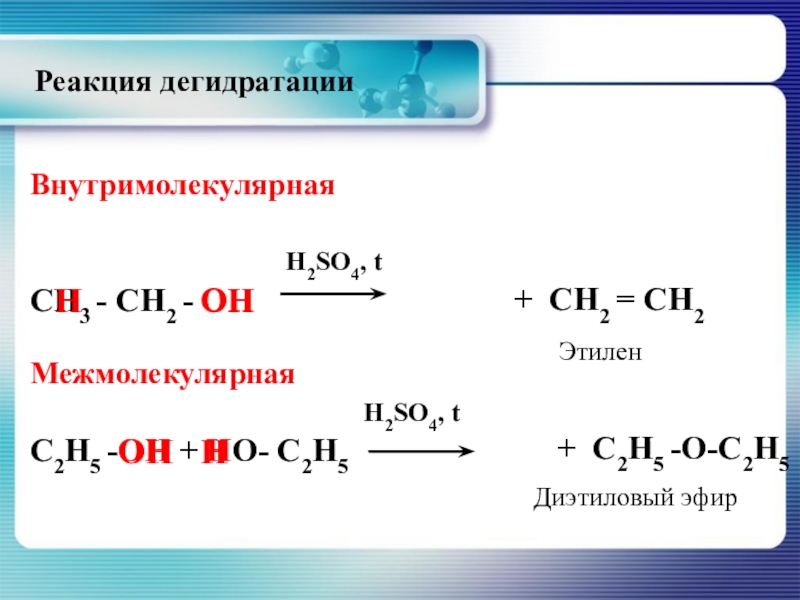
Слайд 25Реакция дегидратации
Для алканолов характерно два типа реакции
- внутримолекулярная
и
- межмолекулярная
При внутримолекулярной дегидратации образуются алкены, при межмолекулярной - простые эфиры.
Слайд 26Внутримолекулярная
СН3 - СН2 - ОН
ОН
Межмолекулярная
H2SO4, t
С2Н5 -ОН + НО- С2Н5
ОН
Н
Н
+ СН2 = СН2
+ С2Н5 -О-С2Н5
Этилен
Диэтиловый эфир
Реакция дегидратации
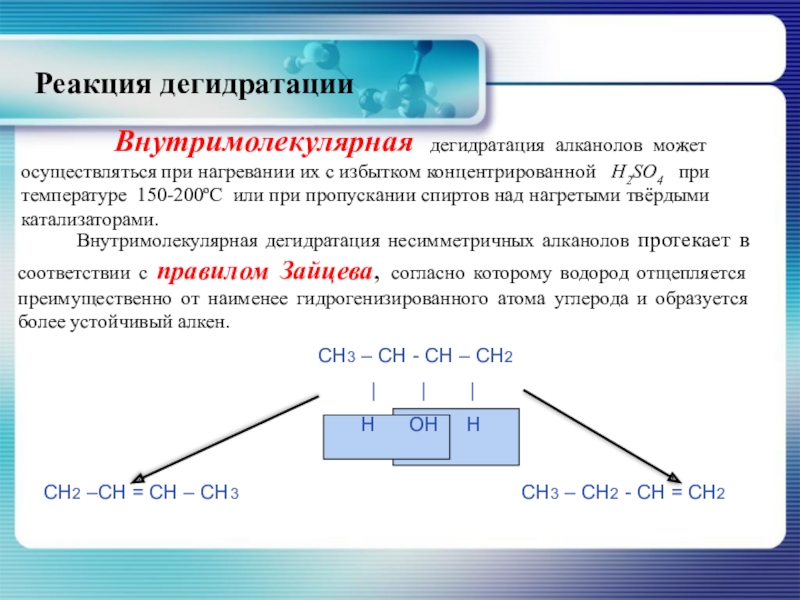
Слайд 27 Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их
Реакция дегидратации
Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии с правилом Зайцева, согласно которому водород отщепляется преимущественно от наименее гидрогенизированного атома углерода и образуется более устойчивый алкен.
СН3 – СН - СН – СН2
| | |
Н ОН Н
СН2 –СН = СН – СН3 СН3 – СН2 - СН = СН2
Слайд 28 Межмолекулярная дегидратация происходит при более слабом нагревании этилового
Реакция дегидратации
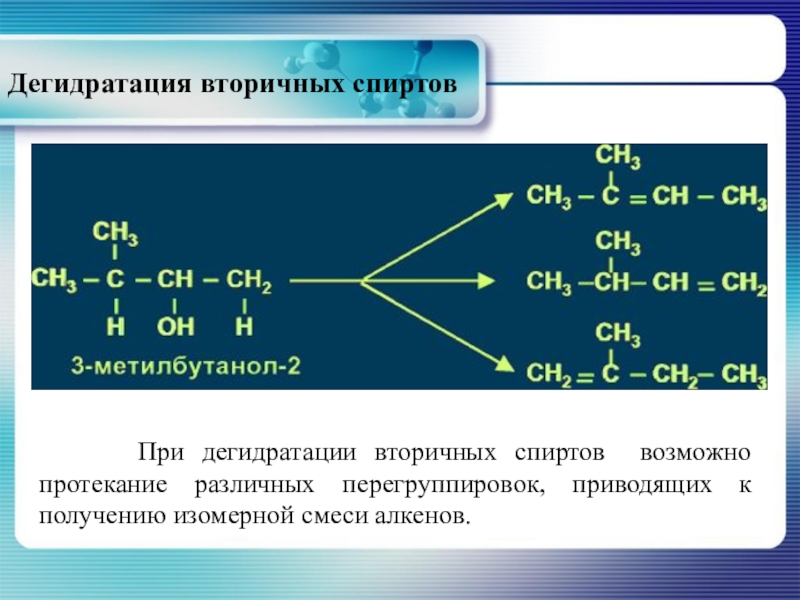
Слайд 29Дегидратация вторичных спиртов
При дегидратации вторичных спиртов возможно протекание
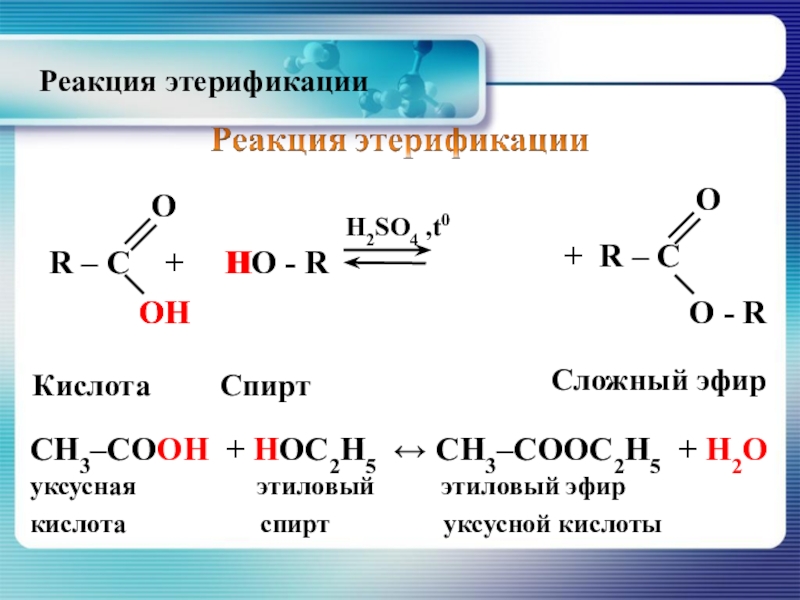
Слайд 30 R – C + HO
H2SO4 ,t0
O
ОH
OH
H
Кислота
Спирт
Сложный эфир
CH3–CОOH + HОC2H5 ↔ CH3–СООC2H5 + H2О
уксусная этиловый этиловый эфир
кислота спирт уксусной кислоты
+ R – C
О - R
O
Реакция этерификации
Слайд 31Окисление первичных спиртов протекает при действии сильных окислителей, например перманганата калия.
Окисление вторичных спиртов приводит к образованию соответствующих кетонов.
Реакции окисления
Слайд 32Реакции окисления
Окисление спиртов проис-ходит и под действием силь-ных окислителей. Характер получаемых
Слайд 34Окисление спиртов оксидом меди приводит к образованию альдегидов
уксусный альдегид
Реакции окисления
Слайд 36www.themegallery.com
Многоатомные спирты являются более сильными кислотами, чем
одноатомные спирты. Они образуют
металлами, но и под действием их гидроксидов, а так же взаимодействуют с
раствором гидроксида меди (II) в присутствии щёлочи, образуя комплексное
соединение, окрашивающее раствор в ярко-синий цвет (качественная реакция)
СН2 – ОН NaOH
2 I + Cu (OH)2
CH2 – OH - 2 H2O
Реакция замещения водорода -ОН группы
Слайд 37Третичные спирты могут окисляться только в жёстких условиях, при действии сильных
Реакции окисления
Слайд 38Дегидрирование спиртов
При пропускании паров спирта при 200 - 300 С над
O
R – CH2 – OH Cu, t R – C + H2 R – CH – R Сu, t R – C – R + H2
H O
альдегид кетон
Слайд 39Получение спиртов
Метанол получают гидрированием оксида углерода (II) СО. В настоящее время
Промышленный способ
C + H2O t CO + H2
Этанол образуется при брожении глюкозы – разложении глюкозы под воздействием ферментов.
C6H12O6 ферменты 2C2H5OH + 2CO2
Слайд 401. Гидролиз галогеналканов.
C2H5 – СL + NaOH H2O
этанол
2. Гидратация алкенов.
CH2 = CH – CH3 + H2O CH3 – CH – CH3
пропен OH пропанол – 2
3. Окисление алкенов (водный раствор перманганата калия).
3 CH2 = CH2 + 2 KMnO4 + 4 H2O 3 CH2 – CH2 + 2 MnO2 + 2KOH
этилен OH OH этандиол – 1,2
4. Гидрирование альдегидов и кетонов.
www.themegallery.com
Получение спиртов
Лабораторный способ
Слайд 42Применение метанола
Прекрасный растворитель;
Сырье для производства формальдегида и лекарственных веществ;
Добавка
Мировое производство метанола превышает 20 млн. тонн в год, и спрос на него постоянно растет, что связано с наметившейся тенденцией по использованию метанола в новых областях, например для получения высокооктановых бензинов, альтернативного, экологически более чистого топлива для электростанций, как сырья для синтеза белка и т.д.
Предполагают, что через пять лет болиды “Формулы-1” будут ездить на спирте
Слайд 43Применение этанола
Применение этанола обширно. Но, в связи с применением его в
Алкогольный напиток может на некоторое время улучшить самочувствие человека (справиться со стрессом, волнением, привести в радостное состояние), так как он подавляет активность центральной и периферической нервной системы.
Но при этом снижается острота зрения, замедляются реакции, речь, уменьшается способность здраво рассуждать, угнетается деятельность головного мозга и нарушается координация движений.
Промежуточный продукт окисления этанола в организме – уксусный альдегид – крайне ядовит и вызывает тяжелые отравления. Систематическое употребление алкогольных напитков приводит к снижению продуктивности работы головного мозга, гибели клеток печени.
Слайд 45Этиленгликоль
Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей (различные
В гораздо больших количествах этиленгликоль используется в производстве полимеров, которые являются основой некоторых видов пластмасс и волокон.
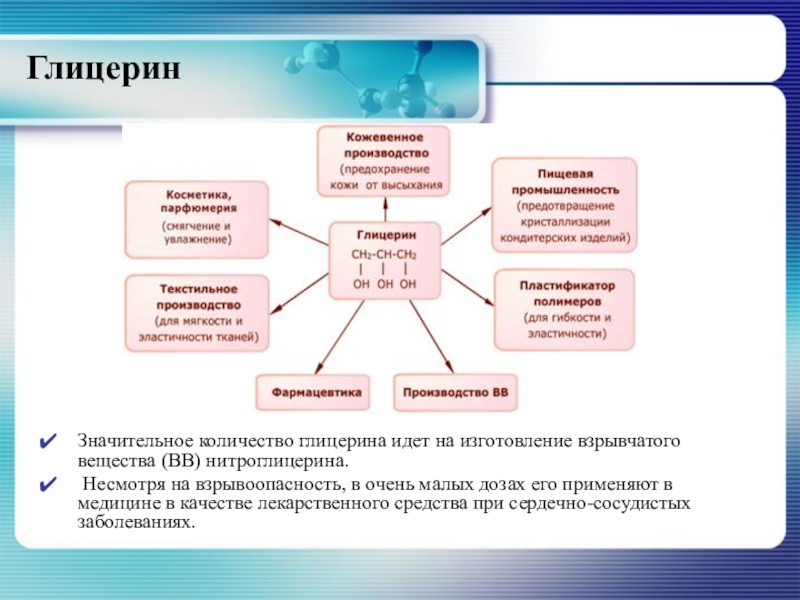
Слайд 46Глицерин
Значительное количество глицерина идет на изготовление взрывчатого вещества (ВВ) нитроглицерина.
Слайд 47Историческая справка
Слово «спирт» происходит от древнего латинского названия этого вещества –
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 году российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремием Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Слайд 48ЯДОВИТЫЙ НАПИТОК
Неумеренное потребление алкогольных
напитков приводит к алкоголизму –
физической и
человека от винного спирта.
По своему химическому механизму алкоголизм
представляет собой частный случай наркотической зависимости, т.е. нарушения тех
или иных звеньев обмена веществ. В малых дозах винный спирт постоянно
присутствует в организме, но в этом нет ничего страшного, потому что
ферментативные системы поддерживают равновесие между этанолом и продуктом
его окисления – сильным ядом ацетальдегидом СН3СНО, который обезвреживается
печенью. А вот если алкоголя выпито много, в организме образуется избыток
ацетальдегида, и печень трудится без устали до тех пор, пока в конце концов не
восстанавливается равновесие.
Но такая нагрузка на печень очень часто приводит к серьёзным заболеваниям.
Слайд 49КЛИН КЛИНОМ
Метиловый спирт очень опасен для человека. Всего лишь 10-20 мл
Различать этиловый и метиловый спирты можно с помощью иодоформной пробы.
Иодоформ СНI3 выделяется в виде светло-жёлтого осадка при действии на этиловый спирт
иода в присутствии щёлочи. Если к 1 мл спирта добавить несколько капель иодной
настойки, а затем водный раствор щёлочи, то выпадение жёлтого осадка свидетельствуют о
том, что это этиловый спирт:
CH3CH2OH+I2=CH3CHO+2HI; CH3CHO+3I2=CI3CHO+3HI; CI3CHO+NaOH=CHI3 + HCOONa.
Высшие спирты и многие кетоны также дают эту реакцию, тогда как метиловый спирт иодоформ не образует. Очевидно, что примесь метанола в этиловом спирте с помощью этой пробы обнаружить невозможно.
Слайд 50Это интересно!
Британские астрономы объявили о том, что
обнаружили
облако, состоящее из паров метилового спирта.
Открытие удивительно не столько тем, то в космосе найден
спирт как таковой. Еще в 2001 году американские
астрономы сообщили об обнаружении неподалеку от центра Млечного Пути винилового спирта,
который практически не присутствует на Земле в свободном состоянии. В 2004 году было
впервые зафиксировано облако из метилового спирта вокруг формирующейся звезды.
Новое же открытие британских ученых удивило своими масштабами.
Облако имеет форму изогнутого моста протяженностью 463 миллиарда километров. Оно
накрывает область формирования новых звезд в нашей галактике и вращается вокруг центральной
звезды по орбите, подобной орбитам планет.
Открытие каждого нового вещества в космосе грозит переворотом в научной жизни планеты.
Дело в том, что сейчас в космосе уже обнаружено присутствие 130 органических веществ.
И каждое из них является лишним доказательством того, что жизнь могла зародиться в условиях
открытого космоса.
В космосе обнаружили метиловый спирт
Слайд 51Это интересно!
Бразилия славится не только футболом. Это первая страна, понявшая, что
Любопытно отметить, что метанол и этанол – биохимические антагонисты. Они оба окисляются по одному механизму, поэтому этанол препятствует биотрансформации метанола и применяется как лечебное средство при отравлении им. Пожалуй, это единственный пример полезного применения этилового спирта в токсикологии
Глицерин под воздействием особых грибков образуется в некоторых сортах винограда. Полученные из этого винограда вина отличаются чрезвычайно сладким и мягким вкусом.
Непредельным одноатомным спиртом является витамин А, важнейшая биологическая функция которого – участие в зрительном процессе.
Слайд 52Это интересно!
Глицерин открыл выдающийся шведский химик Карл Шееле в 1779 г.
Метиловый спирт (метанол) более широко известен как древесный спирт, т.к. раньше его получали исключительно при сухой перегонке древесины.
Амиловые (пентанолы) спирты содержатся в низкосортных алкогольных напитках, и именно их присутствие объясняет отчасти те неприятные последствия от злоупотребления алкоголем, которые называют “похмельем”. Именно эту ядовитую часть алкогольных напитков называют сивушными маслами.
В косметических целях часто используют изопропанол (пропанол-2) По опьяняющему и токсическому действию на организм он превосходит этиловый спирт, поэтому применение его в пищевых целях совершенно недопустимо.
Слайд 53Знаете ли вы что…
… выражение “манна небесная” связано с распространенным в
…в водорослях и лишайниках содержится четырехатомный спирт эритрит
Слайд 54Вопросы
Как в народе называют этиловый спирт?
Дать определение одноатомных спиртов
Назвать общую
Кем был впервые получен безводный (абсолютный) спирт?
На какие виды делятся одноатомные спирты?
Способы получения одноатомных спиртов
Способы получения многоатомных спиртов
Каким веществом выводят из организма человека метиловый спирт?
Где содержится четырехатомный спирт эритрит?
Назвать определение гликолей
Слайд 65Запомни
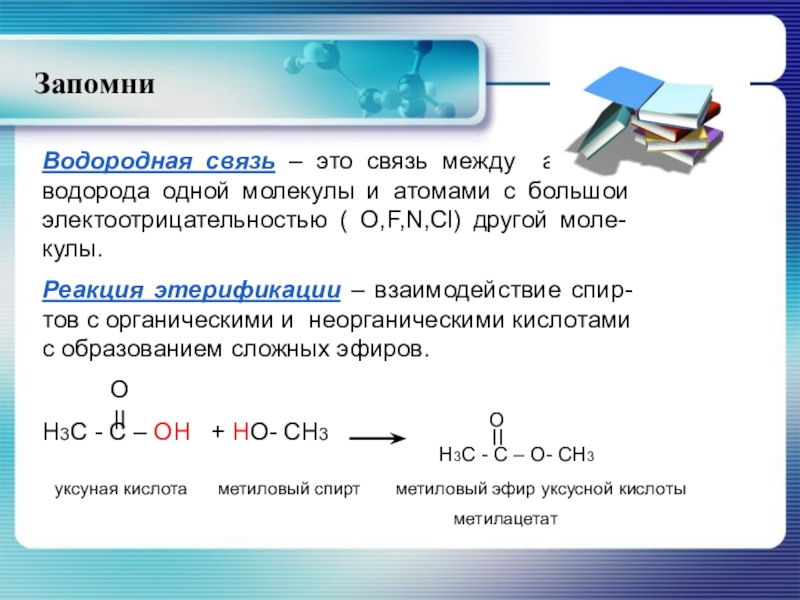
Водородная связь – это связь между атомом водорода одной молекулы и
Реакция этерификации – взаимодействие спир-тов с органическими и неорганическими кислотами с образованием сложных эфиров.
O
H3C - C – OH + HO- CH3
O
H3C - C – O- CH3
уксуная кислота метиловый спирт метиловый эфир уксусной кислоты
метилацетат
Слайд 66Словарь терминов
Альдегиды - образуются при окислении первичных спиртов.
Галогенирование – реакция замещения
Галогены – химические элементы: фтор F, хлор Cl, бром Br, иод J.
Гидратация – реакция присоединения воды к какому-либо веществу.
Гидролиз – реакция ионного обмена между различными веществами и водой.
Гликоли - двухатомные спирты, содержащие гидроксильные группы у соседних атомов углерода.
Глицерин – простейший трёхатомный спирт С3Н5(ОН)3
Дегидратация – реакция, в результате которой от молекулы органического вещества отщепляется молекула воды.
Кетоны – образуются при окислении вторичных спиртов.
Межмолекулярная дегидратация – это реакция нуклеофильного замещения, которая приводит к получению простых эфиров.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи.