- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по теме:Серная кислота
Содержание
- 1. Презентация к уроку по теме:Серная кислота
- 2. Я растворю любой металл. Меня алхимик
- 3. Давайте вспомним:1. Дайте определение понятию «Кислоты».2. Какие
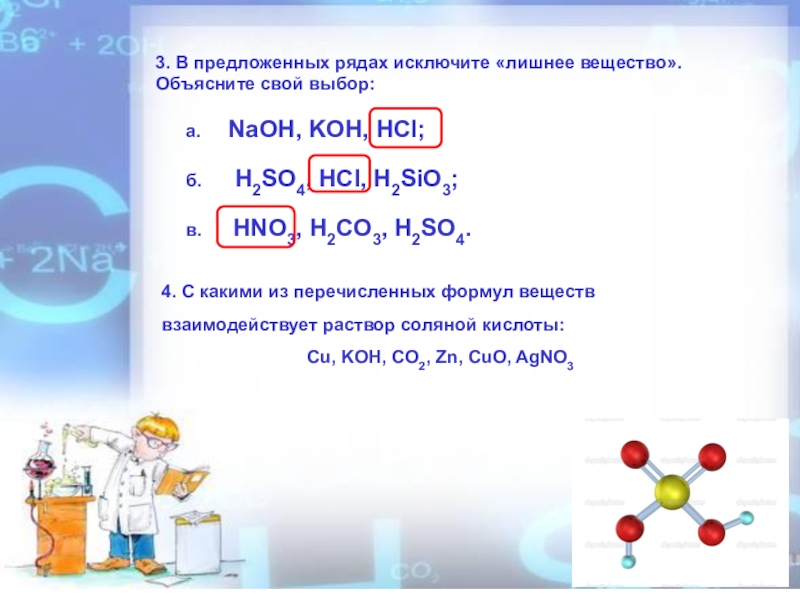
- 4. 3. В предложенных рядах исключите «лишнее вещество».
- 5. История открытия1. Первое упоминание – алхимик Гебер(при
- 6. Серная кислота в природеКислотное озеро на глубине
- 7. Физические свойстваH2SO4 - бесцветная маслянистая тяжелая жидкость,
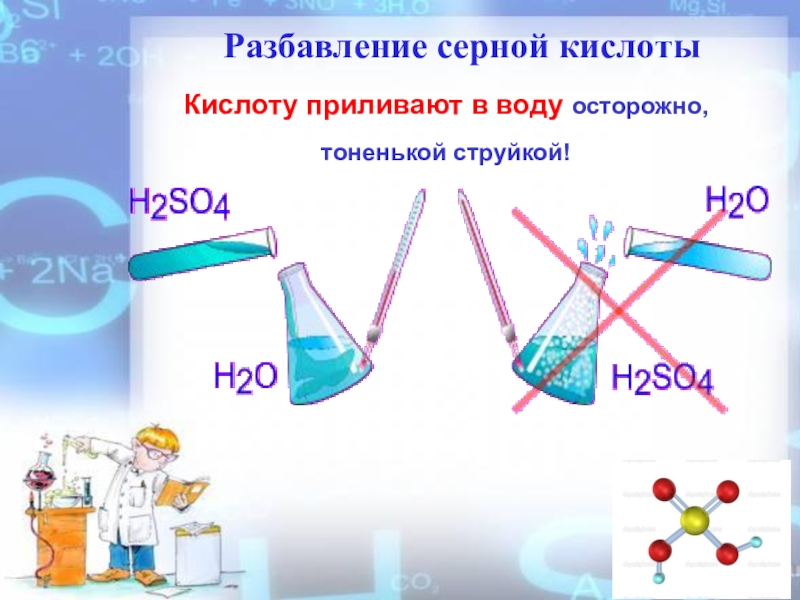
- 8. Разбавление серной кислотыКислоту приливают в воду осторожно, тоненькой струйкой!
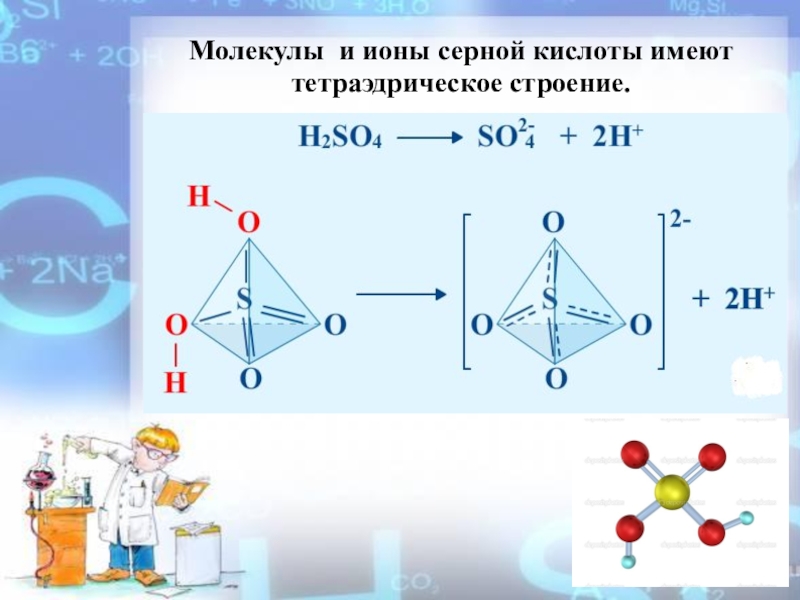
- 9. Молекулы и ионы серной кислоты имеют тетраэдрическое строение.
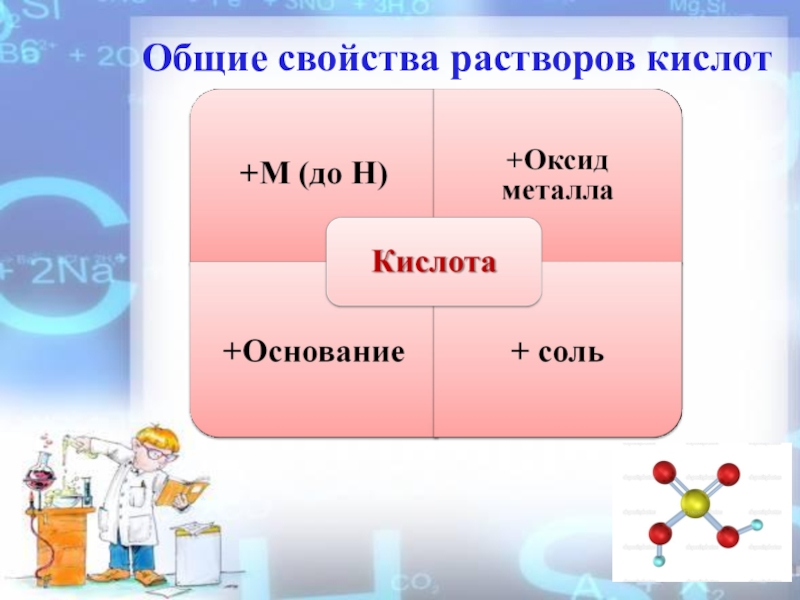
- 10. Общие свойства растворов кислот
- 11. I. Химические свойства разбавленной серной кислоты1.Диссоциация:
- 12. 2. Взаимодействие с металлами ( до Н
- 13. 3. Взаимодействие с оcновными и амфотерными оксидамиCuO
- 14. 4. Взаимодействие с основаниями и амфотерными гидроксидами2NaOH
- 15. 5.Взаимодействие с солями H2SO4+BaCI2 = BaSO4 ↓
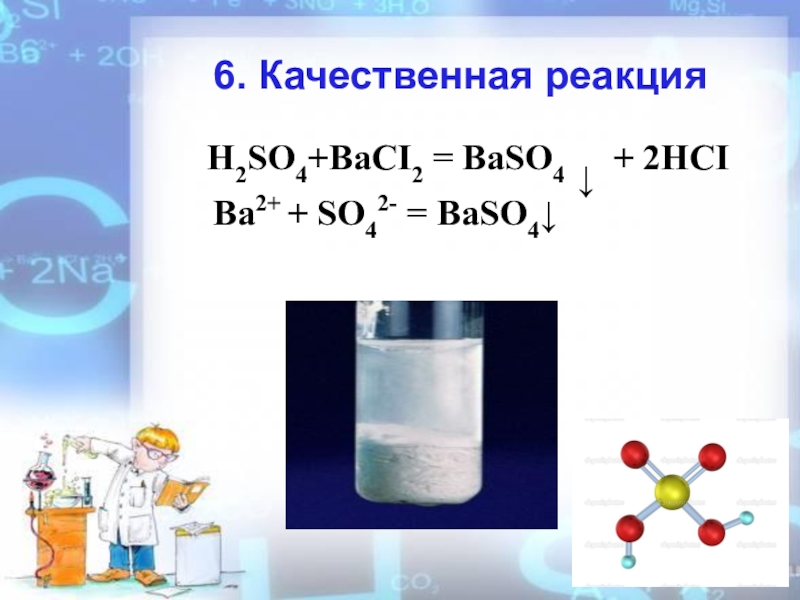
- 16. 6. Качественная реакцияH2SO4+BaCI2 = BaSO4 ↓ + 2HCIBa2+ + SO42- = BaSO4↓
- 17. Серная кислота вытесняет более летучие кислотыNaCI + H2SO4 → NaHSO4 + HCI
- 18. Свойства концентрированной серной кислотыОрганические вещества обугливаются !!!C12H22O11 (сахароза) + 2 Н2SO4 = 11С + 2SO2 +CO2 + 13H2O
- 19. концентрированная серная кислота окисляет неметаллынеМе +
- 20. концентрированная серная кислота окисляет металлыконцентрированная H2SO4
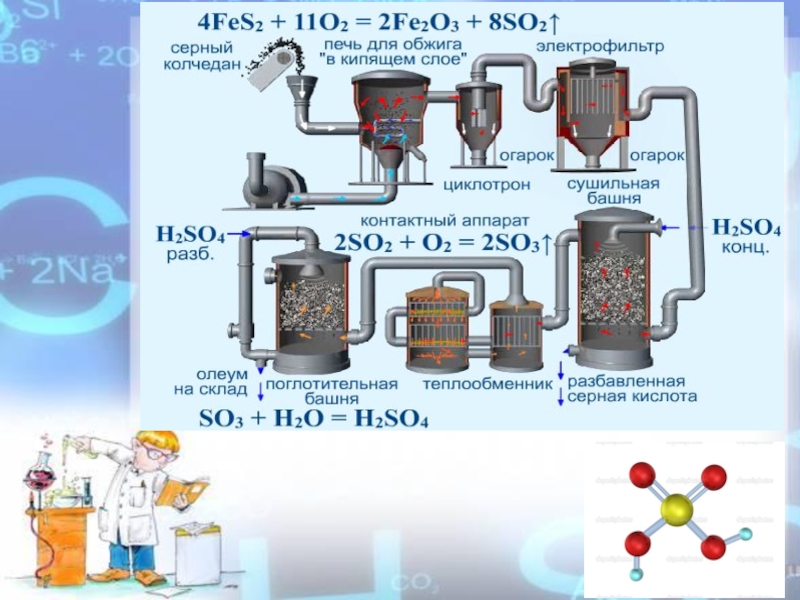
- 21. FeS2SH2SSO2 → SO3 → H2SO4 ПиритСерный колчедан Получение серной кислоты
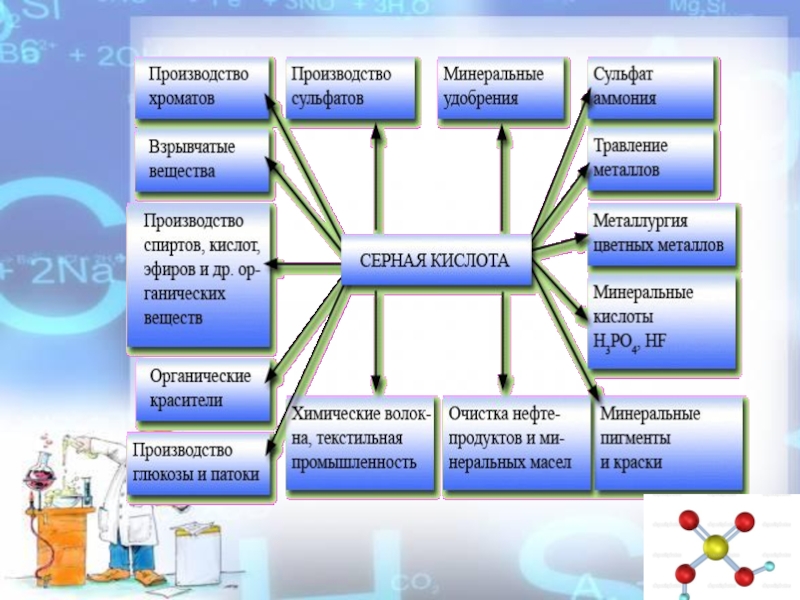
- 22. Слайд 22
- 23. Слайд 23
- 24. Спасибо за внимание!
Слайд 2Я растворю любой металл. Меня алхимик получал В реторте глиняной простой.
Слайд 3Давайте вспомним:
1. Дайте определение понятию «Кислоты».
2. Какие из приведенных формул веществ
H2SiO3, NaOH, HCl, H2O, CO2, BaCl2, H2SO4
3. Установите соответствие:
Формула кислот Название кислот
1. HNO3 1. Фосфорная
2. H2SO4 2. Азотная
3. H3PO4 3. Сернистая
4. H2SO3 4. Серная
Слайд 43. В предложенных рядах исключите «лишнее вещество». Объясните свой выбор:
б. H2SO4, HCl, H2SiO3;
в. HNO3, H2CO3, H2SO4.
4. С какими из перечисленных формул веществ взаимодействует раствор соляной кислоты:
Cu, KOH, CO2, Zn, CuO, AgNO3
Слайд 5История открытия
1. Первое упоминание – алхимик Гебер
(при нагревании квасцов перегоняется
«спирт», обладающий
ющей силой);
2. Средние века – получение серной кислоты основано на разложении сульфатов;
3. Андреас Либавий (16 век) – технический способ получения серной кислоты;
4. 1746г (Англия) – первый камерный завод по получению серной кислоты;
5. 1805г (Москва) – получение серной кислоты на заводе князя Голицына.
Слайд 6Серная кислота в природе
Кислотное озеро на глубине вулкана Малый Семячик
Кипящее озеро
Облака планеты Венера
Европа – спутник Юппитера
Слайд 7Физические свойства
H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при
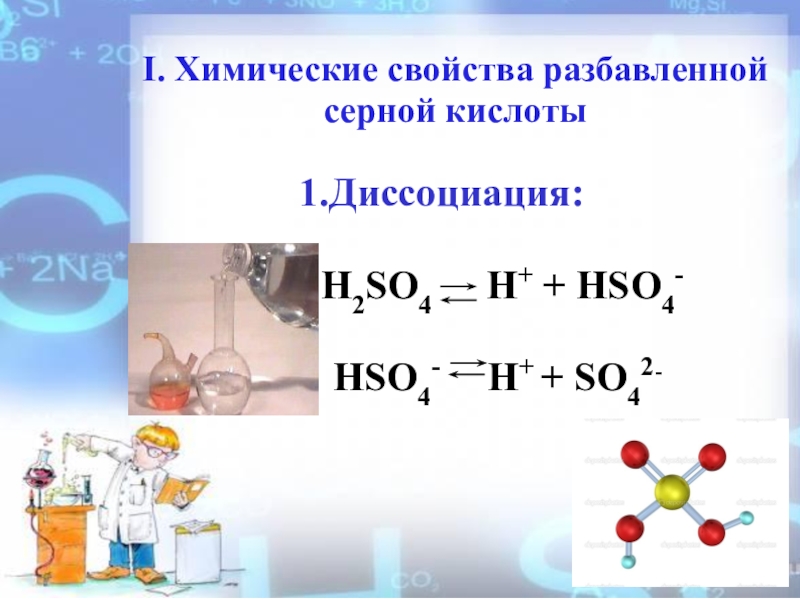
Слайд 11I. Химические свойства разбавленной серной кислоты
1.Диссоциация:
HSO4- H+ + SO42-
Слайд 122. Взаимодействие с металлами ( до Н )
Zn + H2SO4 →
Mg + H2SO4 → MgSO4 + H2↑
Cu + H2SO4 →
Слайд 133. Взаимодействие с оcновными и амфотерными оксидами
CuO + H2SO4 → CuSO4
CuO + 2H+ → Cu2+ + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
Слайд 144. Взаимодействие с основаниями и амфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4
H+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
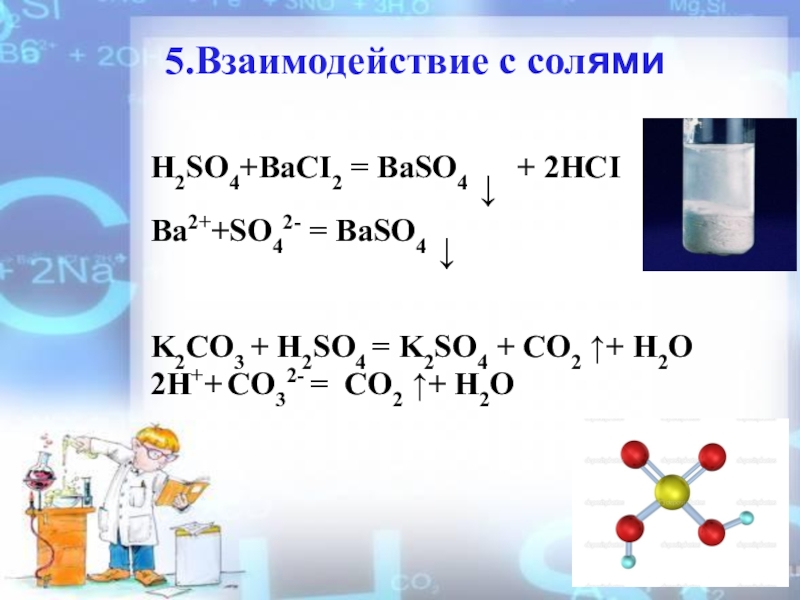
Слайд 155.Взаимодействие с солями
H2SO4+BaCI2 = BaSO4 ↓ + 2HCI
Ba2++SO42-
K2CO3 + H2SO4 = K2SO4 + CO2 ↑+ H2O
2H++ CO32- = CO2 ↑+ H2O
Слайд 18Свойства концентрированной серной кислоты
Органические вещества обугливаются !!!
C12H22O11 (сахароза) + 2 Н2SO4 = 11С
Слайд 19 концентрированная серная кислота окисляет неметаллы
неМе + H2SO4(конц.) =
H2O +
C + 2H2SO4 = 2H2O + CO2 + 2SO2
S + 2H2SO4 = 3SO2 + 2H2O
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Слайд 20 концентрированная серная кислота окисляет металлы
концентрированная H2SO4 – сильный окислитель; при
(без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag + 2H2SO4 → Ag2SO4 + SO2+ 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S + 4H2O