Задачи:
Изучить свойства фосфора и его соединений, значение фосфора для живых организмов.
Закрепить понятия: аллотропия, кислые и средние соли, гидролиз.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по теме Фосфор и его соединения 9 класс
Содержание
- 1. Презентация к уроку по теме Фосфор и его соединения 9 класс
- 2. Строение атома фосфораАтомы фосфора по сравнению с
- 3. Фосфор – простое веществоФизические свойстваФосфоробразуетнесколькоаллотропныхмодификаций.
- 4. Фосфор – простое веществоПолучение2Ca3(PO4)2 + 10C +
- 5. Соединения фосфораОксиды фосфора: P2O3, P2O5 – кислотные
- 6. Ортофосфорная кислота. Получение.Взаимодействие P2O5 с водой при
- 7. Ортофосфорная кислота.Химические свойстваОБЩИЕ1.ДиссоциацияH3PO4 2.Взаимодействие с металламиCa
- 8. Ортофосфорная кислота.Химические свойстваСПЕЦЕФИЧНЫЕ1. При нагревании превращается в
- 9. Соли ортофосфорной кислотыH3PO4 – трёхосновная кислота, следовательно
- 10. ПовторениеНазвать вещества:Mg3P2 – PH3 – Na3PO4 –
- 11. ПовторениеНазвать вещества:Mg3P2 – фосфид кальцияPH3 – фосфинNa3PO4
Строение атома фосфораАтомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, больше выраженные восстановительные свойства. Редко встречаются соединения фосфора со с. о. – 3 (Ca3P4, Na3P), чаще с. о. +
Слайд 1На дом: § 32 №2,3,4; дополнить конспект.
Сенченкова Н. Н.
Глава III.
Неметаллы
Тема:
Фосфор
и его соединения
Слайд 2Строение атома фосфора
Атомы фосфора по сравнению с атомами азота имеют больший
радиус, меньшее значение электроотрицательности, а значит, больше выраженные восстановительные свойства. Редко встречаются соединения фосфора со с. о. – 3 (Ca3P4, Na3P), чаще с. о. + 5.
В соединении PH3 связь ковалентная неполярная т.к. электроотрицательность фосфора и водорода почти одинакова.
В соединении PH3 связь ковалентная неполярная т.к. электроотрицательность фосфора и водорода почти одинакова.
Изобразите электронное строение атома фосфора
+15P 2e– 8e– 5e–
1s2 2s2 2p6 3s2 3p3
Слайд 4Фосфор – простое вещество
Получение
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3+ P4
+ 10CO
Химические свойства
1.Взаимодействие с металлами
3Ca + 2P = Ca3P2(фосфид кальция)
2. Взаимодействие с кислородом
4P +5O2 = 2P2O5(оксид фосфора (V))
3. Получение фосфина (взаимодействие с водородом - косвенно)
Ca3P2 + 6HCI = 3CaCI2 + 2 PH3 (фосфин)
Фосфин – ядовитый газ с неприятным запахом, легко воспламеняется на воздухе
Химические свойства
1.Взаимодействие с металлами
3Ca + 2P = Ca3P2(фосфид кальция)
2. Взаимодействие с кислородом
4P +5O2 = 2P2O5(оксид фосфора (V))
3. Получение фосфина (взаимодействие с водородом - косвенно)
Ca3P2 + 6HCI = 3CaCI2 + 2 PH3 (фосфин)
Фосфин – ядовитый газ с неприятным запахом, легко воспламеняется на воздухе
Слайд 5Соединения фосфора
Оксиды фосфора: P2O3, P2O5 – кислотные оксиды
Физические свойства P2O5: …
Химические
свойства:
1. Взаимодействие с водой
P2O5 + H2O =
2.Взаимодействие с щелочами
P2O5 + KOH =
3. Взаимодействие с основными оксидами
P2O5 + MgO =
1. Взаимодействие с водой
P2O5 + H2O =
2.Взаимодействие с щелочами
P2O5 + KOH =
3. Взаимодействие с основными оксидами
P2O5 + MgO =
белый, гигроскопичный порошок
Слайд 6Ортофосфорная кислота.
Получение.
Взаимодействие P2O5 с водой при нагревании:
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие природной соли (ортофосфата кальция) с серной кислотой при нагревании:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Физические свойства: . . .
2. Взаимодействие природной соли (ортофосфата кальция) с серной кислотой при нагревании:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Физические свойства: . . .
твёрдое, бесцветное, кристаллическое вещество , хорошо растворимое в воде.
Слайд 7Ортофосфорная кислота.
Химические свойства
ОБЩИЕ
1.Диссоциация
H3PO4
2.Взаимодействие с металлами
Ca + H3PO4 =
3.Взаимодействие
с основными оксидами
CaO + H3PO4 =
4. Взаимодействие с основаниями и аммиаком
Ca(OH)2 + H3PO4 =
5. Взаимодействие с солями слабых кислот
CaCO3 + H3PO4 =
CaO + H3PO4 =
4. Взаимодействие с основаниями и аммиаком
Ca(OH)2 + H3PO4 =
5. Взаимодействие с солями слабых кислот
CaCO3 + H3PO4 =
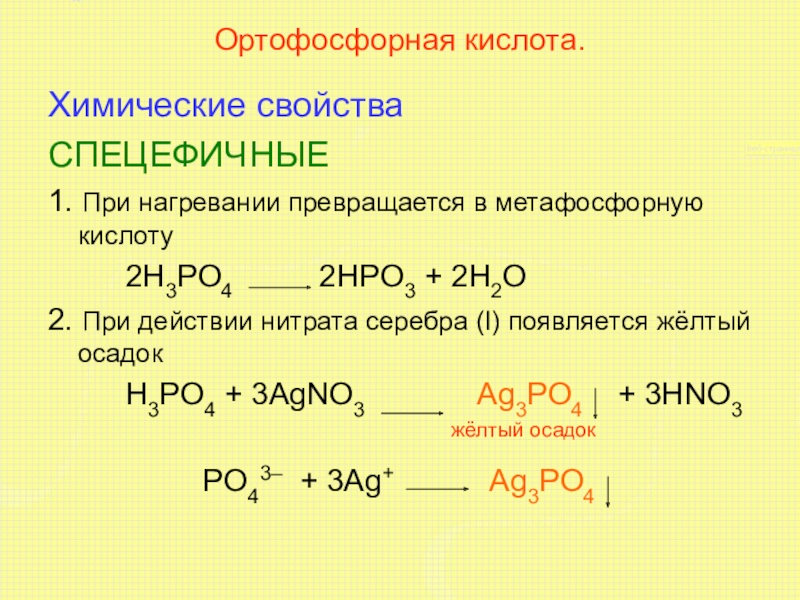
Слайд 8Ортофосфорная кислота.
Химические свойства
СПЕЦЕФИЧНЫЕ
1. При нагревании превращается в метафосфорную кислоту
2H3PO4 2HPO3 + 2H2O
2. При действии нитрата серебра (I) появляется жёлтый осадок
H3PO4 + 3AgNO3 Ag3PO4 + 3HNO3
жёлтый осадок
PO43– + 3Ag+ Ag3PO4
2. При действии нитрата серебра (I) появляется жёлтый осадок
H3PO4 + 3AgNO3 Ag3PO4 + 3HNO3
жёлтый осадок
PO43– + 3Ag+ Ag3PO4
Слайд 9Соли ортофосфорной кислоты
H3PO4 – трёхосновная кислота, следовательно образует три ряда солей:
Средние
соли – фосфаты:
Ca3(PO4)2 – фосфат кальция
Кислые соли – дигидрофосфаты:
Ca(H2PO4)2 – дигидрофосфат кальция
Кислые соли – гидрофосфаты:
CaHPO4 – гидрофосфат кальция
Ca3(PO4)2 – фосфат кальция
Кислые соли – дигидрофосфаты:
Ca(H2PO4)2 – дигидрофосфат кальция
Кислые соли – гидрофосфаты:
CaHPO4 – гидрофосфат кальция
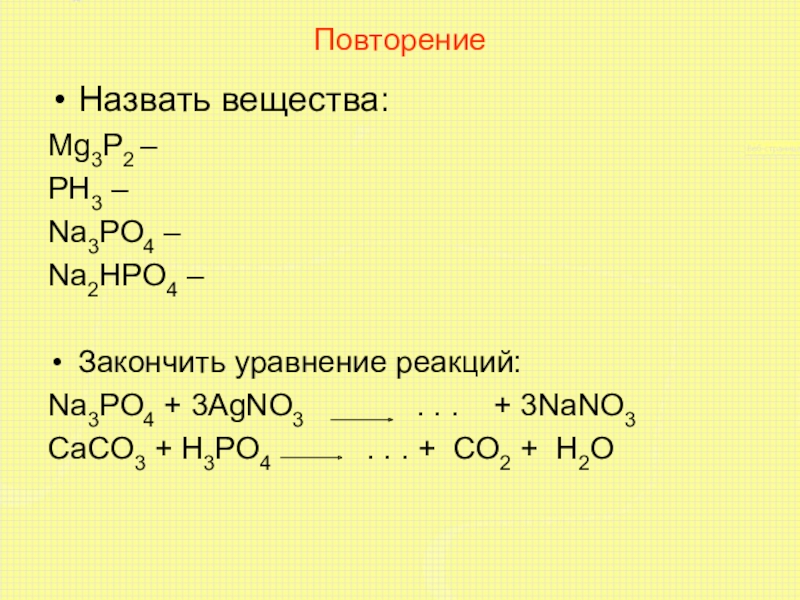
Слайд 10Повторение
Назвать вещества:
Mg3P2 –
PH3 –
Na3PO4 –
Na2HPO4 –
Закончить уравнение реакций:
Na3PO4
+ 3AgNO3 . . . + 3NaNO3
CaCO3 + H3PO4 . . . + CO2 + H2O
CaCO3 + H3PO4 . . . + CO2 + H2O
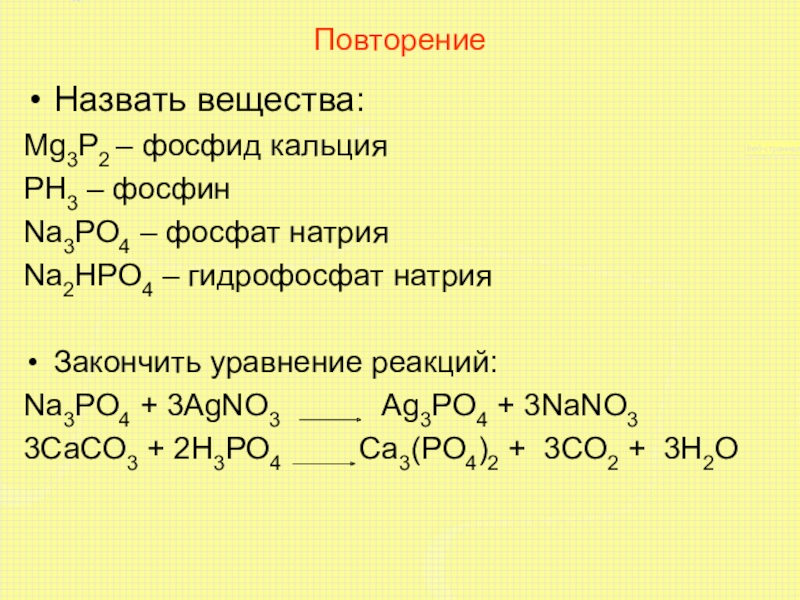
Слайд 11Повторение
Назвать вещества:
Mg3P2 – фосфид кальция
PH3 – фосфин
Na3PO4 – фосфат натрия
Na2HPO4 –
гидрофосфат натрия
Закончить уравнение реакций:
Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3
3CaCO3 + 2H3PO4 Ca3(PO4)2 + 3CO2 + 3H2O
Закончить уравнение реакций:
Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3
3CaCO3 + 2H3PO4 Ca3(PO4)2 + 3CO2 + 3H2O