- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по химии Щелочные металлы, 9 класс
Содержание
- 1. Презентация к уроку по химии Щелочные металлы, 9 класс
- 2. Цель: сформировать представление о щелочных металлахЗадачи: Расширить
- 3. Место щелочных металлов в ПСХЭ Д.И. Менделеева,
- 4. Физические свойства и нахождение в природелитийнатрийкалийрубидийцезийВсе щелочные
- 5. Химические свойстваИз-за высокой химической активности щелочных металлов
- 6. Получение щелочных металлов1. Для получения щелочных металлов
- 7. Закрепление материалаВыбери правильный ответ:Вопросы1.1 От лития к
- 8. Закрепление материала2. Расположи элементы в порядке увеличения
- 9. Закрепление материала6. Отгадайте загадку:Хранят обычно в керосине,
- 10. Закрепление материала7. Отгадайте загадку:Он энергично вытесняет Из
Слайд 1
Тема урока:
Щелочные металлы
Выполнила: Зайцева Наталья Александровна
учитель химии и биологии
высшей квалификационной
МБОУ СОШ № 188 г. Новосибирска
Слайд 2
Цель:
сформировать представление о щелочных металлах
Задачи:
Расширить знания учащихся о металлах
Продолжить формирование умений прогнозировать свойства простого на основе положения химического элемента в ПСХЭ;
Познакомить учащихся с практическим применением щелочных металлов;
Способствовать формированию устойчивого интереса к изучаемому предмету, используя исторические хроники, лабораторные эксперименты; задания разного вида (тесты, вопросы, загадки).
Слайд 3
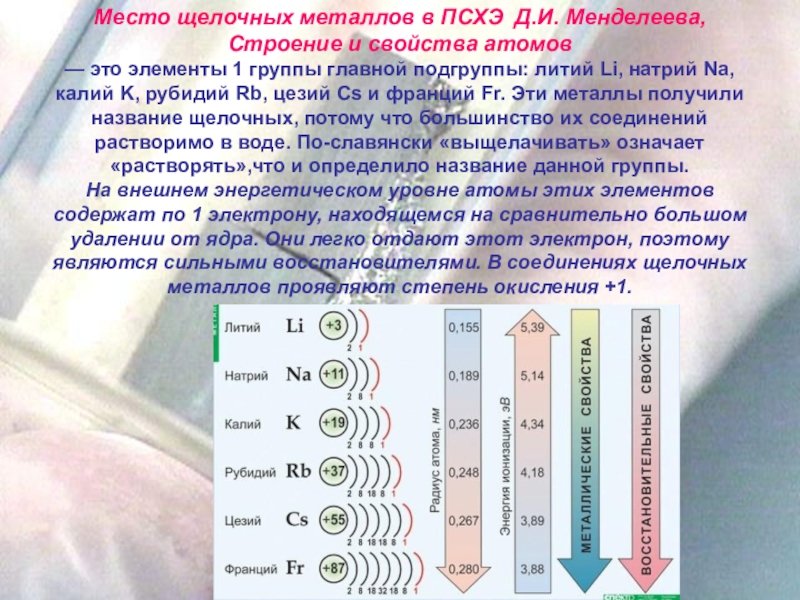
Место щелочных металлов в ПСХЭ Д.И. Менделеева, Строение и свойства атомов
—
На внешнем энергетическом уровне атомы этих элементов содержат по 1 электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. В соединениях щелочных металлов проявляют степень окисления +1.
Слайд 4
Физические свойства и нахождение в природе
литий
натрий
калий
рубидий
цезий
Все щелочные металлы имеют серебристо-белый цвет
В природе щелочные металлы встречаются исключительно в виде соединений. Натрий и калий составляет 2,0 и 1,1% от общего числа атомов земной коры; лития (0,02%), рубидия (0,004%) и цезия (0,00009), а франция – ничтожно мало.
Слайд 5
Химические свойства
Из-за высокой химической активности щелочных металлов по отношению к воде,
1) Ме + неMе (c H2, Hal2, S, N2, P, C, Si. O2 → бинарное соединение
А) 4Li+O2=2Li2O; 2Na+O2 = Na2O2; K, Rb, Cs + O2 = MeO22 или Me2O4
Б) 6Li+ N2 = 2Li3N; 2K+ Cl2 = 2KCl; 2K+H2 = 2KH; 2Na + S = Na2S
2) 2Me+ 2H2O = 2MeOH + H2
2Na + 2H2O =2NaOH + H2 ; 2Rb + 2H2O = 2RbOH + H2
3) Me+ HAc = MeAc + H2
Na + HCl = NaCl + H2 Na + C2H5 COOH = C2H5 COONa + H2
4) 2Me+ 2NH3= 2Me NH2 + H2
5) Me + 5) Me + спирт = алкоголята + 5) Me + спирт = алкоголята + H2
Na + C2H5OH = C2H5ONa + H2
6) 2Na + Na2O2 = 2Na2O; 3K + KO2 = 2K2O; 2NaOH+ 2Na = 2 Na2O + H2
7) При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды
Слайд 6
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз
2LiCl → 2Li + Cl2
катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
2MCl + Ca → 2M + CaCl2
Применение щелочных металлов
Литий применяют для легирования сплавов; для удаления водорода, кислорода, азота, серы, фосфора из различных сплавов; в термоядерных реакциях как источник трития; в медицине.
2. Натрий применяется для получения тетраэтилсвинца, перекиси натрия; как катализатор в производстве СК; при получении красителей, лекарственных веществ; в металлургии для восстановления тугоплавких металлов.
3. Калий применяется в составе сплавов; для изготовления фотоэлектрических элементов; как катализатор; в производстве К2О4; при выплавке титана.
4. Рубидий и цезий применяется в электронике, электротехнике и рентгенографии; в керамической и стекольной промышленности; как катализатор; для получения гидридов; в фармацевтической промышленности.
Слайд 7
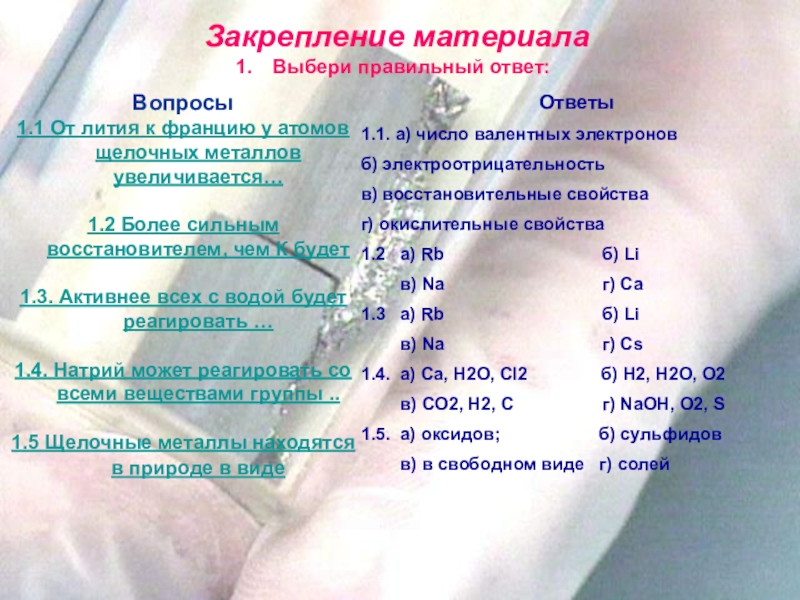
Закрепление материала
Выбери правильный ответ:
Вопросы
1.1 От лития к францию у атомов щелочных
1.2 Более сильным восстановителем, чем К будет
1.3. Активнее всех с водой будет реагировать …
1.4. Натрий может реагировать со всеми веществами группы ..
1.5 Щелочные металлы находятся в природе в виде
Ответы
1.1. а) число валентных электронов
б) электроотрицательность
в) восстановительные свойства
г) окислительные свойства
1.2 а) Rb б) Li
в) Na г) Ca
1.3 а) Rb б) Li
в) Na г) Cs
1.4. а) Ca, H2O, Cl2 б) H2, H2O, O2
в) CO2, H2, C г) NaOH, O2, S
1.5. а) оксидов; б) сульфидов
в) в свободном виде г) солей
Слайд 8
Закрепление материала
2. Расположи элементы в порядке увеличения металлических свойств:
K, Na, Cs,
33. Могут ли щелочные металлы быть окислителями? Ответ поясните.
4. Осуществите цепочку превращений:
Na Na → Na → Na2O2 Na → Na2O2 →Na → Na2O2 → Na2ONa → Na2O2 → Na2O →Na → Na2O2 → Na2O → NaOHNa → Na2O2 → Na2O → NaOH → Na → Na2O2 → Na2O → NaOH → Na2O
5. Назови основные правила техники безопасности при работе с щелочными металлами
Слайд 9
Закрепление материала
6. Отгадайте загадку:
Хранят обычно в керосине, и бегает он по
В природе, помните, отныне,
Свободным нет его нигде,
В солях открыть его возможно
Желтеет пламя от него
И получить из соли можно
Как Дэви получил его.
О каком элементе идет речь?
Слайд 10
Закрепление материала
7. Отгадайте загадку:
Он энергично вытесняет
Из влаги - чистый
Его при этом заменяет
И вяжет прочно кислород.
Тот элемент в растеньях скрыт
По фиолетовому цвету
Он может быть в солях открыт.
О каком элементе идет речь?