- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по химии Обратимость химических реакций. Химическое равновесие
Содержание
- 1. Презентация к уроку по химии Обратимость химических реакций. Химическое равновесие
- 2. Как вы думаете, как будет называться тема сегодняшнего урока?
- 3. «РАВНОВЕСИЕ»
- 4. Проблемные вопросы: 1)Как влияет изменение температуры
- 5. 2)Как влияет изменение концентраций исходных веществ и
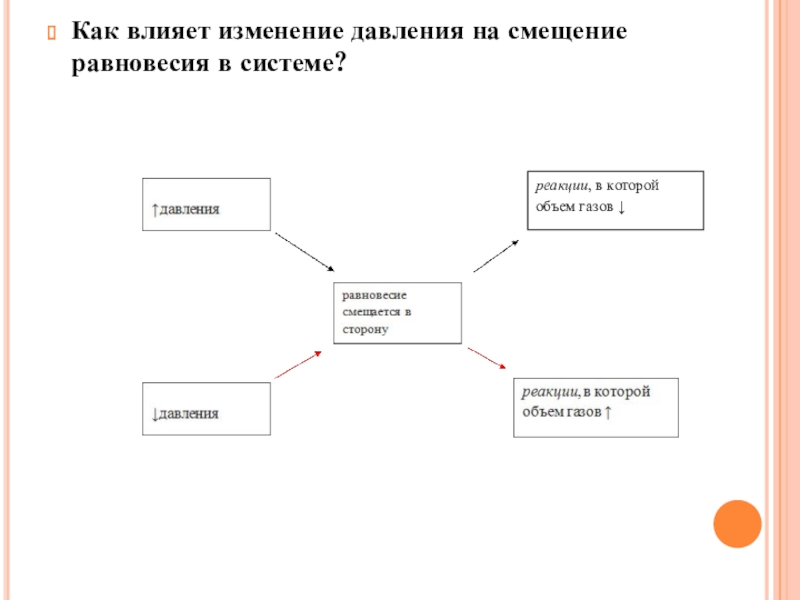
- 6. 3)Как влияет изменение давления на смещение равновесия
- 7. Какие реакции называются необратимыми, а какие обратимыми?
- 8. Где в природе или быту встречаются необратимые и обратимые реакции? приведите примеры
- 9. Какие из приведенных ниже реакций являются обратимыми?
- 10. 2KClO 3 = 2KCl + 3O 2
- 11. Как в уравнениях реакций обозначается обратимость процесса?(В
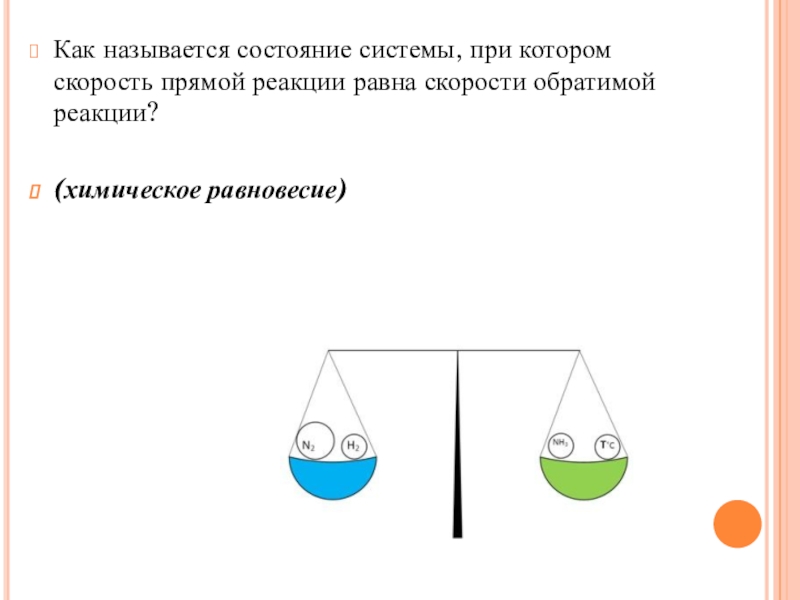
- 12. Как называется состояние системы, при котором скорость прямой реакции равна скорости обратимой реакции? (химическое равновесие)
- 13. Состояние равновесия сохраняется сколько угодно долго при
- 14. Лe Шателье Анри Луи (1850-1936) - французский
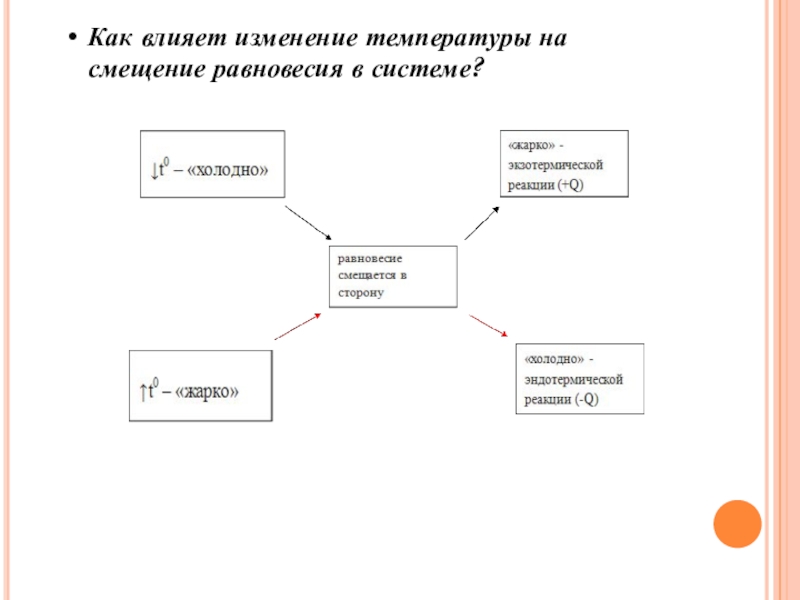
- 15. Как влияет изменение температуры на смещение равновесия в системе?
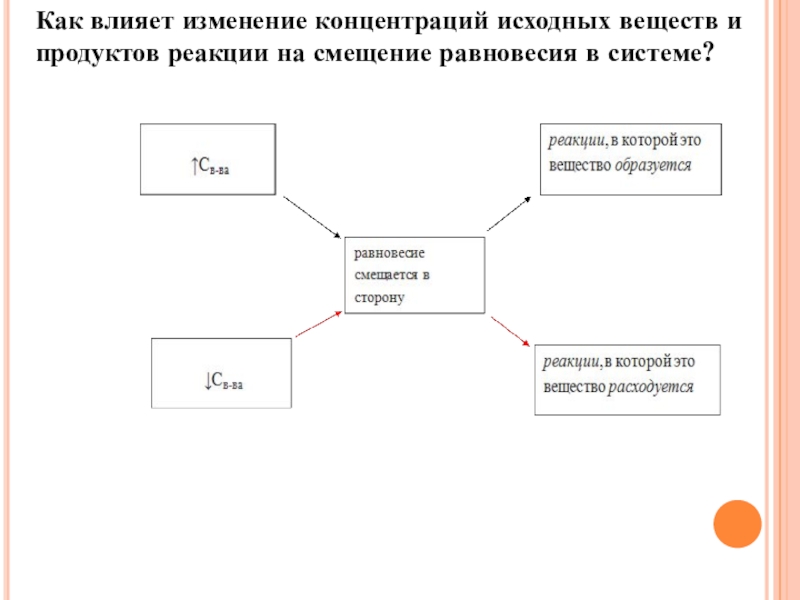
- 16. Как влияет изменение концентраций исходных веществ и продуктов реакции на смещение равновесия в системе?
- 17. Как влияет изменение давления на смещение равновесия в системе?реакции, в которой объем газов ↓
- 18. Закончите фразы:При увеличении температуры химическое равновесие смещается
- 19. При изменении концентрации продуктов реакции химическое
- 20. сегодня я узнал…было интересно…было трудно…я выполнял задания…я
- 21. §14 упражнение 1,22. Описать какие условия необходимо
Как вы думаете, как будет называться тема сегодняшнего урока?
Слайд 4Проблемные вопросы:
1)Как влияет изменение температуры на смещение равновесия в системе?
(При изменении температуры химическое равновесие смещается в сторону процесса, знак совпадает со знаком изменения температуры)
Слайд 52)Как влияет изменение концентраций исходных веществ и продуктов реакции на смещение
равновесия в системе?
(При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции)
(При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции)
Слайд 63)Как влияет изменение давления на смещение равновесия в системе?
(При повышении давления
равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот)
Слайд 7Какие реакции называются необратимыми, а какие обратимыми?
Обратимые -реакции, которые могут
протекать как в прямом, так и в обратном направлении.
Необратимые-реакции, протекающие до конца, то есть до тех пор, пока полностью не израсходуется одно из исходных веществ.
Необратимые-реакции, протекающие до конца, то есть до тех пор, пока полностью не израсходуется одно из исходных веществ.
Слайд 9Какие из приведенных ниже реакций являются обратимыми?
2KClO 3 = 2KCl +
3O 2 ↑
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
N2 + 3H2 = 2NH3
НСl + NаОН = Н2О + NаСl
СО2+ H2O = H2CO3
Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓
N2 + 3H2 = 2NH3
НСl + NаОН = Н2О + NаСl
СО2+ H2O = H2CO3
Слайд 10
2KClO 3 = 2KCl + 3O 2 ↑
необратимая
Ba(ClO2)2 + H2SO4
→ 2HClO2 + BaSO4↓
необратимая
N2 + 3H2 = 2NH3
обратимая
НСl + NаОН = Н2О + NаСl
необратимая
СО2+ H2O = H2CO3
обратимая
необратимая
N2 + 3H2 = 2NH3
обратимая
НСl + NаОН = Н2О + NаСl
необратимая
СО2+ H2O = H2CO3
обратимая
Слайд 11Как в уравнениях реакций обозначается обратимость процесса?
(В уравнениях обратимых реакций вместо
знака равенства ставится знак обратимости )
Слайд 12Как называется состояние системы, при котором скорость прямой реакции равна скорости
обратимой реакции?
(химическое равновесие)
(химическое равновесие)
Слайд 13Состояние равновесия сохраняется сколько угодно долго при неизменных внешних условиях. Каких?
(температура, изменение концентрации, изменение давления для системы в которой есть газ)
Слайд 14Лe Шателье Анри Луи (1850-1936) - французский физикохимик
принцип Ле Шателье:
«Внешнее воздействие
на систему, находящуюся в состоянии равновесия, приводит к смещению равновесия в направлении, при котором ослабевает данное воздействие».
Слайд 16Как влияет изменение концентраций исходных веществ и продуктов реакции на смещение
равновесия в системе?
Слайд 17Как влияет изменение давления на смещение равновесия в системе?
реакции, в которой
объем газов ↓
Слайд 18Закончите фразы:
При увеличении температуры химическое равновесие смещается в сторону…
(эндотермической (поглощение) реакции)
При понижении температуры химическое равновесие смещается в сторону…
(экзотермической (выделение) реакции)
При изменении концентрации исходных веществ химическое равновесие смещается в сторону…
(продуктов реакции)
(экзотермической (выделение) реакции)
При изменении концентрации исходных веществ химическое равновесие смещается в сторону…
(продуктов реакции)
Слайд 19 При изменении концентрации продуктов реакции химическое равновесие смещается…
(В сторону исходных
веществ)
При повышении давления химическое равновесие смещается в сторону…
(меньшего объёма веществ)
При понижении давления химическое равновесие смещается в сторону…
(большего объёма)
При повышении давления химическое равновесие смещается в сторону…
(меньшего объёма веществ)
При понижении давления химическое равновесие смещается в сторону…
(большего объёма)
Слайд 20сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я
почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
Слайд 21
§14 упражнение 1,2
2. Описать какие условия необходимо учитывать при синтезе аммиака,
серной кислоты, этилового спирта (на выбор).
Домашнее задание: