- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по химии на тему Фосфор и его свойства
Содержание
- 1. Презентация к уроку по химии на тему Фосфор и его свойства
- 2. СодержаниеСтроение атома фосфораОткрытие фосфораНахождение в природеАллотропные модификации фосфораХимические свойства фосфораПолучение фосфораПрименениеЛитература
- 3. 1S2 2S2 2P6 3S2 3P3Строение атомаРаспаривание электронов
- 4. Строение атомаЭлемент VA группы, третьего периодаФосфор –
- 5. Открытие фосфораПервым в свободном состоянии фосфор получил
- 6. Белый фосфор обладает молекулярной кристаллической
- 7. Противоядием при отравлении фосфором служит 2% раствор
- 8. Красный фосфор – порошок со слабо выраженной
- 9. Чёрный фосфор - полимерное вещество с металлическим
- 10. Фосфор - составная часть растительных и животных
- 11. В природе фосфор находится в связанном виде.
- 12. В химическом отношении белый фосфор
- 13. Фосфор соединяется со многими простыми веществами –
- 14. 2. С галогенами. С элементами, обладающими большей, чем
- 15. 3. С серой при нагревании. 4P + 6S
- 16. Фосфин «фосфин, или фосфористый водород (PH3) — это
- 17. 5. Красный фосфор окисляется водой при температуре
- 18. Получение фосфора Фосфор может быть получен нагреванием смеси
- 19. Получение фосфорной кислоты фосфорные удобрения и технические
- 20. Соединения фосфора токсичны. Смертельная доза белого фосфора
- 21. ЭЛИКСИР - (от араб. Аль - иксир
- 22. БОЙЛЬ (Boyle) Роберт (1627-91), английский химик и
- 23. ШЕЕЛЕ (Scheele) Карл Вильгельм (1742-86), шведский химик,
- 24. ЛАВУАЗЬЕ (Lavoisier) Антуан Лоран (1743-94), французский химик,
- 25. Список литературы:Фельдман Ф.Г., Рудзитис Г.Е. Химия 9
Слайд 1фосфор
Муниципальное бюджетное учреждение средняя общеобразовательная школа №93 с углубленным изучением
Слайд 2Содержание
Строение атома фосфора
Открытие фосфора
Нахождение в природе
Аллотропные модификации фосфора
Химические свойства фосфора
Получение фосфора
Применение
Литература
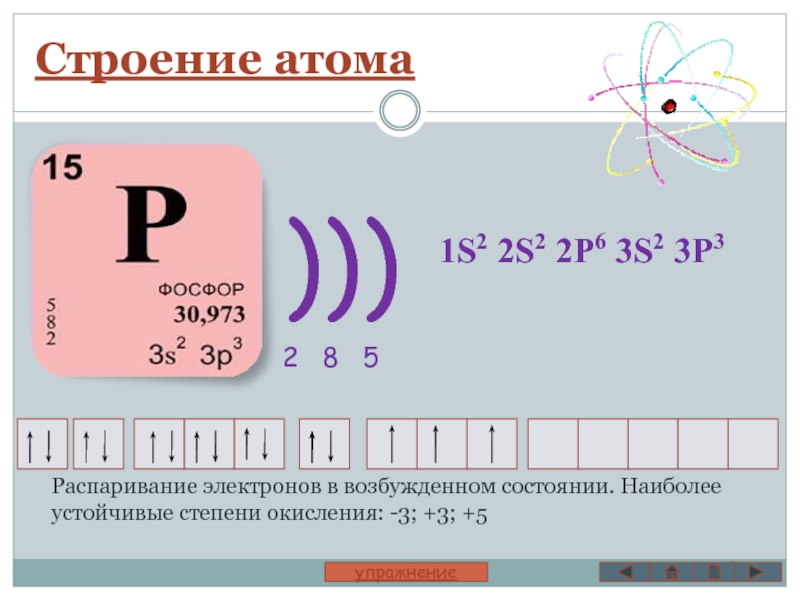
Слайд 31S2 2S2 2P6 3S2 3P3
Строение атома
Распаривание электронов в возбужденном состоянии. Наиболее
упражнение
)))
2 8 5
Слайд 4Строение атома
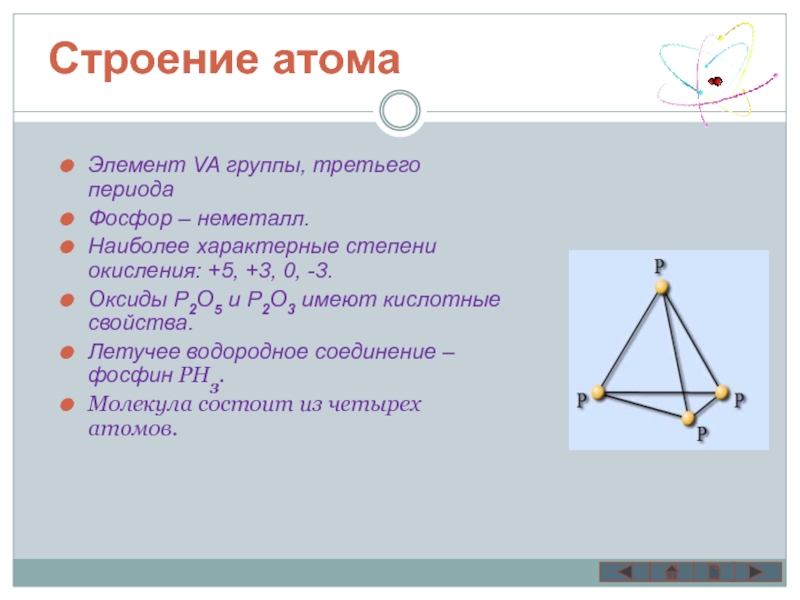
Элемент VA группы, третьего периода
Фосфор – неметалл.
Наиболее характерные степени
Оксиды Р2О5 и Р2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин PH3.
Молекула состоит из четырех атомов.
Слайд 5Открытие фосфора
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик
В 1680 светящийся в темноте фосфор (от греческого «фосфорос» — светоносный) получил англичанин Р. Бойль. В 1680 светящийся в темноте фосфор (от греческого «фосфорос» — светоносный) получил англичанин Р. Бойль. В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле. В 1680 светящийся в темноте фосфор (от греческого «фосфорос» — светоносный) получил англичанин Р. Бойль. В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле. Элементарную природу фосфора установил в конце 18 века А. Л. Лавуазье.
Слайд 6Белый фосфор обладает молекулярной кристаллической решеткой; это вещество
Белый фосфора
Аллотропные модификации фосфора
Слайд 7 Противоядием при отравлении фосфором служит 2% раствор медного купороса, который следует
Аллотропные модификации фосфора
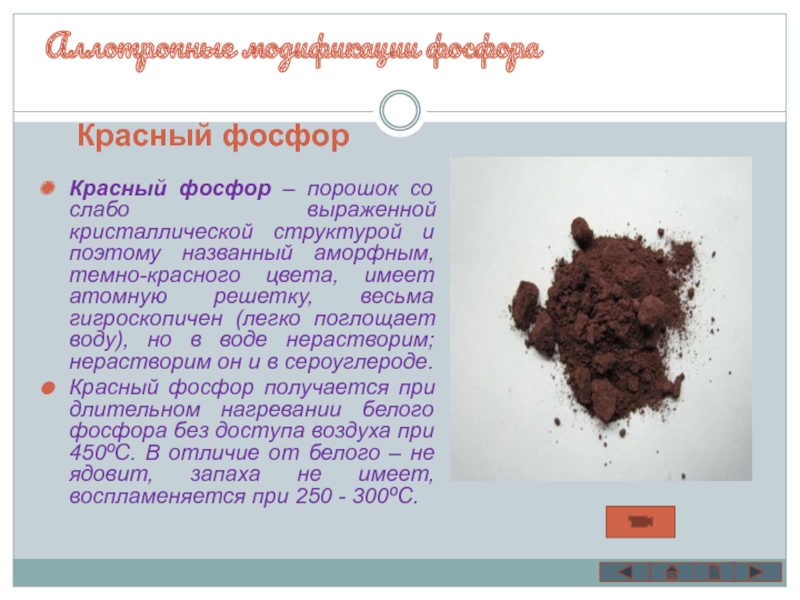
Слайд 8Красный фосфор – порошок со слабо выраженной кристаллической структурой и поэтому
Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450ºС. В отличие от белого – не ядовит, запаха не имеет, воспламеняется при 250 - 300ºС.
Красный фосфор
Аллотропные модификации фосфора
Слайд 9Чёрный фосфор - полимерное вещество с металлическим блеском, похож на графит,
Аллотропные модификации фосфора
Черный фосфор
Слайд 10Фосфор - составная часть растительных и животных белков. У растений фосфор
Нахождение в природе
Слайд 11В природе фосфор находится в связанном виде. Важнейшие минералы:
апатит и
Нахождение в природе
Слайд 12 В химическом отношении белый фосфор сильно отличается от красного.
Белый
Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС.
При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
Химические свойства фосфора
Слайд 13 Фосфор соединяется со многими простыми веществами – кислородом, галогенами, серой и
1. С кислородом.
При горении фосфора образуется белый густой дым. Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. Фосфор сгорает в кислороде
ослепительно ярким пламенем.
4P + 3O2(недостаток) → 2P2O3
4P + 5O2(избыток) → 2P2O5
Химические свойства фосфора
Слайд 142. С галогенами.
С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор
получается хлорид фосфора (III).
4P + 6Cl2(недостаток) → 4PCl3
4P + 10Cl2(избыток) → 4PCl5
Химические свойства фосфора
Слайд 15 3. С серой при нагревании.
4P + 6S → 2P2S3
4. Фосфор окисляет при нагревании почти
все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2
Фосфиды металлов легко гидролизуются водой при этом выделяется газ фосфин.
Ca3P2 + 6H2O → 2PH3 ↑+ 3Ca(OH)2
Химические свойства фосфора
Слайд 16Фосфин
«фосфин, или фосфористый водород (PH3) — это бесцветный газ с неприятным
«мерцающий свет, появляющийся на болотах (знаменитые «блуждающие огни») — результат самопроизвольного воспламенения фосфина».
Слайд 175. Красный фосфор окисляется водой при
температуре около 800ºС в присутствии
катализатора – порошка меди:
2P + 8H2O → 2H3PO4 + 5H2↑
6. Концентрированная серная кислота
окисляет при нагревании фосфор:
t
2P + 5H2SO4(конц) → 5SO2↑ + 2H3PO4 + 2H2O
7. Азотная кислота при нагревании окисляет
фосфор
t
P + 5HNO3(конц) → 5NO2↑ + H3PO4 + H2O
3P + 5HNO3(разб) + 2H2O → 5NO↑ + 3H3PO4
Химические свойства фосфора
Слайд 18Получение фосфора
Фосфор может быть получен
нагреванием смеси фосфорита, угля и
песка
Сa3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO
Слайд 19Получение фосфорной кислоты
фосфорные удобрения и технические соли (фосфаты).
В зажигательных и
в в спичечном производстве.
В производстве сплавов цветных металлов как раскислитель. Введение до 1% Ф. увеличивает жаропрочность.
Ф. входит в состав некоторых бронз, т.к. повышает их жидкотекучесть и стойкость против истирания.
Фосфиды металлов, а также некоторых неметаллов (В, Si, As и т.п.) используются при получении и легировании полупроводниковых материалов.
Частично Ф. применяется для получения хлоридов и сульфидов, которые служат исходными веществами для производства фосфорсодержащих пластификаторов
медикаментов,
фосфорорганических пестицидов,
В производстве добавок в смазочные вещества и в горючее.
Применение фосфора
Слайд 20Соединения фосфора токсичны. Смертельная доза белого фосфора — 50-150 мг. Попадая
Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы.
При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м3. Пыль красного фосфора, попадая в легкие, вызывает пневмонию.
Физиологическое действие фосфора
Слайд 21ЭЛИКСИР -
(от араб. Аль - иксир — философский камень), жизненный
Философский камень
В поисках философского камня Бранд прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом .
Слайд 22БОЙЛЬ (Boyle) Роберт (1627-91), английский химик и физик, один из учредителей
Роберт Бойль
Слайд 23ШЕЕЛЕ (Scheele) Карл Вильгельм (1742-86), шведский химик, по профессии аптекарь. Первым
Карл Вильгельм Шееле
Слайд 24ЛАВУАЗЬЕ (Lavoisier) Антуан Лоран (1743-94), французский химик, один из основоположников современной
Антуан Лоран Лавуазье
Слайд 25Список литературы:
Фельдман Ф.Г., Рудзитис Г.Е. Химия 9 класс.М.: Просвещение. 2007.
Габриелян О.С.
Энциклопедия юного химика.