- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Основные классы неорганических соединений
Содержание
- 1. Презентация к уроку Основные классы неорганических соединений
- 2. Проверка домашнего заданияПеречислите виды кристаллических решеток. (атомная,
- 3. Аллотропияспособность некоторых химических элементов образовывать несколько простых
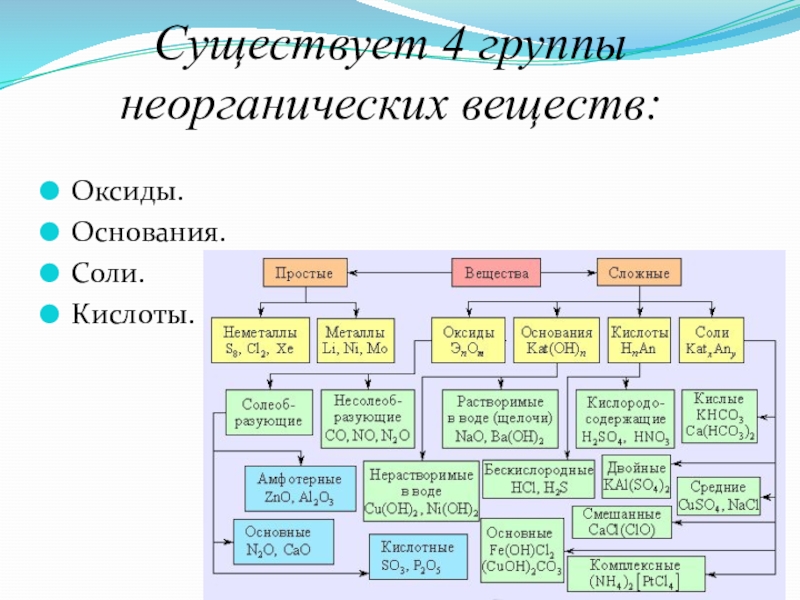
- 4. Существует 4 группы неорганических веществ:Оксиды.Основания. Соли.Кислоты.
- 5. ОксидыОсновныеКислотныеАмфотерные Соответствует основание (NaOH)Соответствует кислота (HNO3 H2SO4)Соответствует
- 6. Получение1. Взаимодействие простых и сложных веществ с
- 7. ОСНОВАНИЯ- сложные вещества, в которых атомы металлов
- 8. Получение1. Реакции активных металлов ( щелочных и
- 9. Кислоты сложные вещества, состоящие из одного или
- 10. Слайд 10
- 11. НF - фтороводородная, или плавиковаяНCl - хлороводородная,
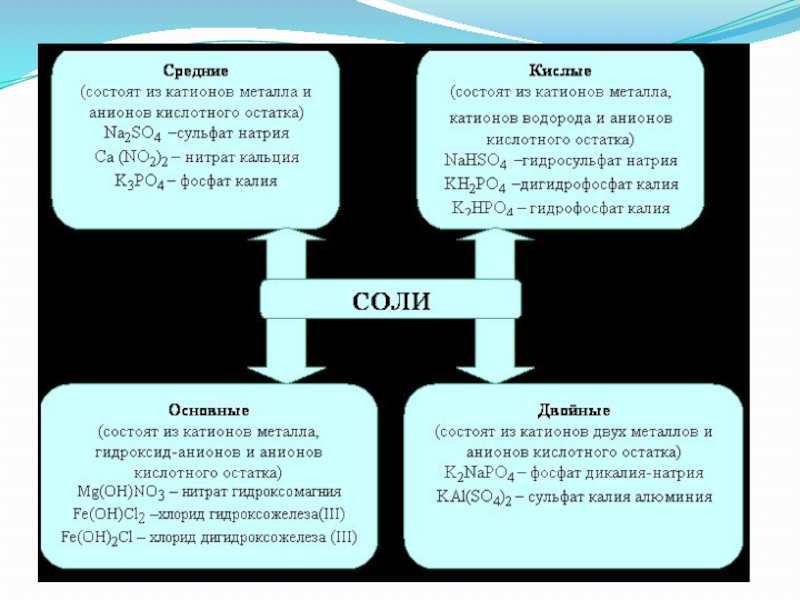
- 12. СолиСолями называются вещества, в которых атомы металла
- 13. Слайд 13
- 14. Слайд 14
- 15. NaCl – хлорид натрия,Na2SO4 – сульфат натрия,СаSO4 – сульфат кальция,СаCl2 – хлорид кальция,(NH4)2SO4 – сульфат аммония.
- 16. Слайд 16
- 17. Слайд 17
Проверка домашнего заданияПеречислите виды кристаллических решеток. (атомная, молекулярная, ионная, металлическая)Как зависят свойства веществ от вида их кристаллической решетки?Атомная – тугоплавкость, не растворимость в воде, твердые.Ионная – тугоплавкость, летучесть, растворимы в воде, твердые.Молекулярная – не твердые, легкоплавкие,
Слайд 2Проверка домашнего задания
Перечислите виды кристаллических решеток.
(атомная, молекулярная, ионная, металлическая)
Как зависят
свойства веществ от вида их кристаллической решетки?
Атомная – тугоплавкость, не растворимость в воде, твердые.
Ионная – тугоплавкость, летучесть, растворимы в воде, твердые.
Молекулярная – не твердые, легкоплавкие, растворимы в воде, не проводят эл. ток.
Металлические – тугоплавкие, проводят эл. Ток, в воде не растворяются, имеют металлический блеск.
Атомная – тугоплавкость, не растворимость в воде, твердые.
Ионная – тугоплавкость, летучесть, растворимы в воде, твердые.
Молекулярная – не твердые, легкоплавкие, растворимы в воде, не проводят эл. ток.
Металлические – тугоплавкие, проводят эл. Ток, в воде не растворяются, имеют металлический блеск.
Слайд 3Аллотропия
способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению
и свойствам.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
С - алмаз, графит, карбин.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
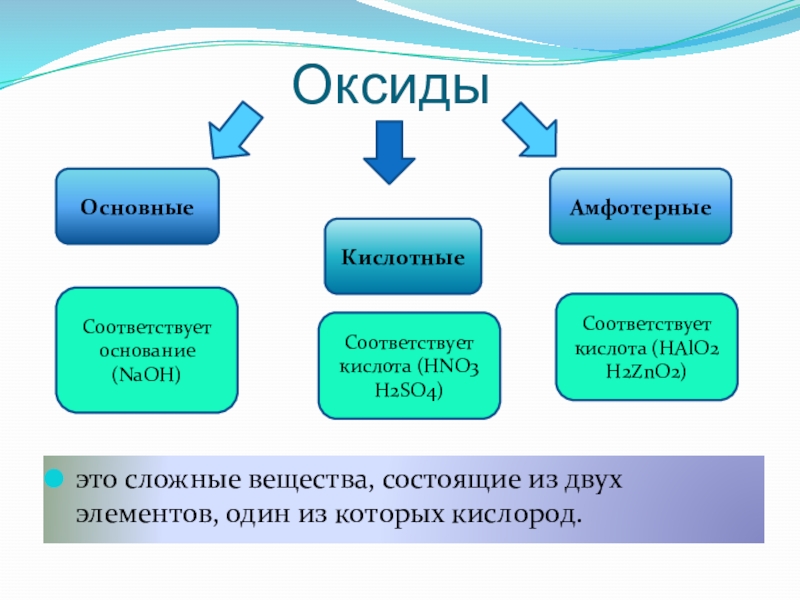
Слайд 5Оксиды
Основные
Кислотные
Амфотерные
Соответствует основание (NaOH)
Соответствует кислота (HNO3 H2SO4)
Соответствует кислота (HAlO2 H2ZnO2)
это сложные
вещества, состоящие из двух элементов, один из которых кислород.
Слайд 6Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ®
2MgO
4P + 5O2 ® 2P2O5
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 –t°® CuO + H2O
4P + 5O2 ® 2P2O5
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 –t°® CuO + H2O
Слайд 7ОСНОВАНИЯ
- сложные вещества, в которых атомы металлов соединены с одной или
несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Слайд 8Получение
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na
+ 2H2O ® 2NaOH + H2
Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
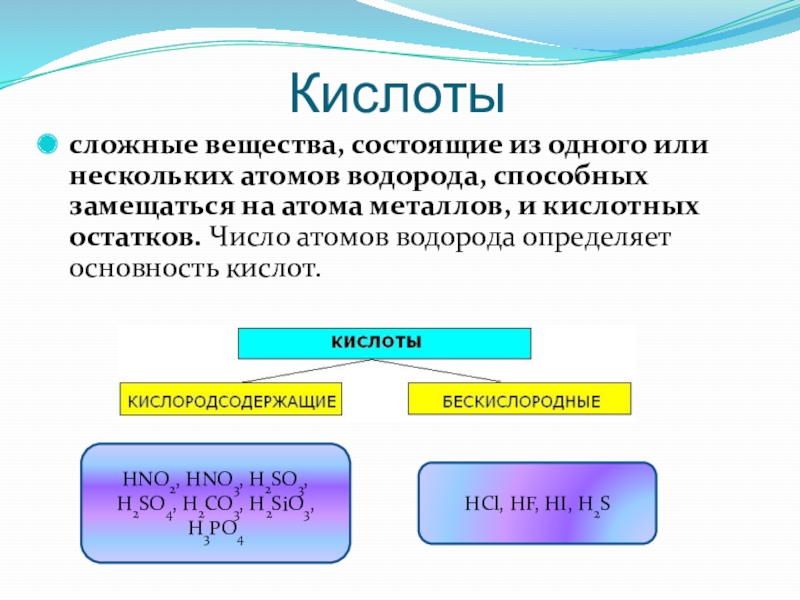
Слайд 9Кислоты
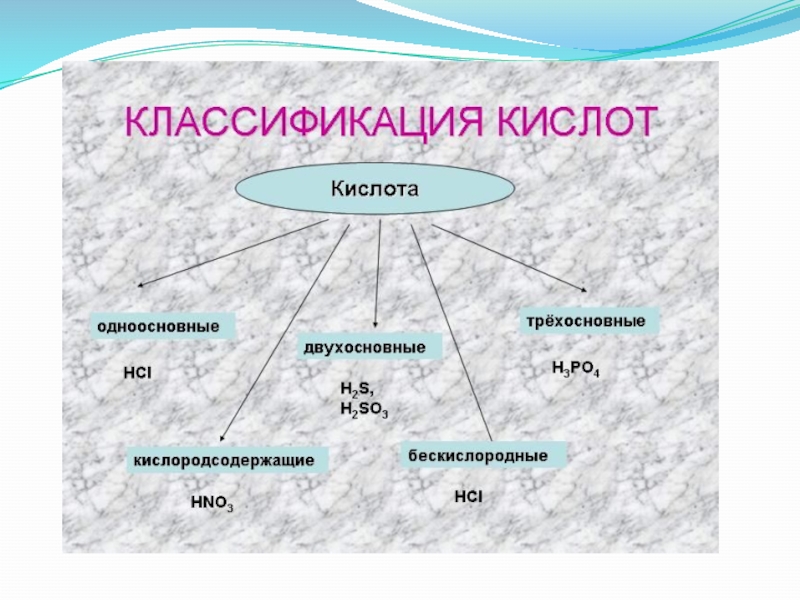
сложные вещества, состоящие из одного или нескольких атомов водорода, способных
замещаться на атома металлов, и кислотных остатков. Число атомов водорода определяет основность кислот.
HNO2, HNO3, H2SO3, H2SO4, H2CO3, H2SiO3, H3PO4
HCl, HF, HI, H2S
Слайд 11НF - фтороводородная, или плавиковая
НCl - хлороводородная, или соляная
НBr -
бромоводородная кислота
НI - йодоводородная
Н2S - сероводородная
НI - йодоводородная
Н2S - сероводородная
HClO4 - хлорная
HClO3 - хлорноватая
HClO2 - хлористая
HClO - хлорноватистая
H3AsO4 - мышьяковая
HNO3 - азотная
HNO2 – азотистая
H2SO4 - серная
H2SO3 - сернистая
Слайд 12Соли
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
Исключением
являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+.
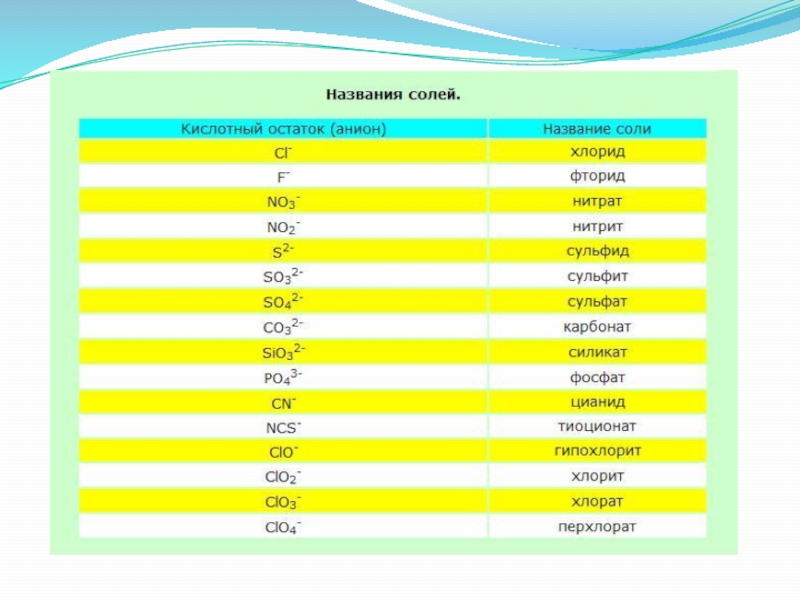
Слайд 15NaCl – хлорид натрия,
Na2SO4 – сульфат натрия,
СаSO4 – сульфат кальция,
СаCl2 –
хлорид кальция,
(NH4)2SO4 – сульфат аммония.
(NH4)2SO4 – сульфат аммония.