- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Ковалентная связь 11 класс
Содержание
- 1. Презентация к уроку Ковалентная связь 11 класс
- 2. В виде свободных (изолированных) атомов существуют только…Гелий
- 3. Результат связывания атомов – образование более сложных
- 4. Типы химической связи:Ковалентная связь является причиной образования
- 5. Ковалентная связь (КС)Главную роль при образовании хим.связи
- 6. Теория ковалентной связиОбразование химической связи – процесс,
- 7. Схема перекрывания электронных облаков при образовании молекулы водорода:
- 8. Образование ковалентной связи в молекуле Cl2Электронная формула:
- 9. Типы ковалентной связи:Одинарная (простая) связь – ковалентная
- 10. -связь - это ковалентная связь, при образовании
- 11. Кратность связи - число общих эл.пар между
- 12. Образование кратных связей на примере молекулы N2электронная
- 13. Важная характеристика КС – полярность связи.Полярность связи
- 14. Донорно-акцепторный механизм образования КСДонорно-акцепторная связь – связь,
- 15. Образование донорно-акцепторной связи на примере иона аммония
- 16. Если элемент образует КС и по обменному,
В виде свободных (изолированных) атомов существуют только…Гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn.Из-за высокой устойчивости их электронных структур (электронный дублет 1s2 у Не и электронный октет ns2np6 на внешнем слое
Слайд 2В виде свободных (изолированных) атомов существуют только…
Гелий He, неон Ne, аргон
Ar, криптон Kr, ксенон Xe и радон Rn.
Из-за высокой устойчивости их электронных структур (электронный дублет 1s2 у Не и электронный октет ns2np6 на внешнем слое в атомах остальных благородных газов)
Все другие вещества состоят из связанных атомов.
Химическая связь – силы, которые обуславливают связь между атомами.
Из-за высокой устойчивости их электронных структур (электронный дублет 1s2 у Не и электронный октет ns2np6 на внешнем слое в атомах остальных благородных газов)
Все другие вещества состоят из связанных атомов.
Химическая связь – силы, которые обуславливают связь между атомами.
Слайд 3Результат связывания атомов – образование более сложных структур:
Молекул;
Молекулярных ионов;
Свободных радикалов;
а также
ионных, атомных и металлических кристаллических решёток.
Слайд 4Типы химической связи:
Ковалентная связь является причиной образования большинства молекул, молекулярных ионов,
свободных радикалов и атомных кристаллических решеток.
Ионная связь обусловливает существование молекул ионных соединений и ионных кристаллических решеток.
Металлическая связь существует в простых веществах-металлах.
Водородная связь существует внутри молекул отдельных веществ, а также возникает между молекулами некоторых веществ.
Ионная связь обусловливает существование молекул ионных соединений и ионных кристаллических решеток.
Металлическая связь существует в простых веществах-металлах.
Водородная связь существует внутри молекул отдельных веществ, а также возникает между молекулами некоторых веществ.
Слайд 5Ковалентная связь (КС)
Главную роль при образовании хим.связи между атомами играют их
валентные электроны (электроны, которые находятся на внешнем электронном слое и наименее прочно связаны с ядром атома).
В 1916г. Гилберт Ньютон Льюис (США):
«химическая связь возникает в результате образования общих электронных пар между взаимодействующими атомами»
В 1916г. Гилберт Ньютон Льюис (США):
«химическая связь возникает в результате образования общих электронных пар между взаимодействующими атомами»
Слайд 6Теория ковалентной связи
Образование химической связи – процесс, сопровождающийся выделением энергии.
При образовании
КС происходит перекрывание облаков электронов, имеющих антипараллельные спины.
Слайд 8Образование ковалентной связи в молекуле Cl2
Электронная формула: 3s23p5
Электронно-графическая формула:
Образование молекулы Cl2:
Схема
перекрывания электронных облаков в молекуле Cl2:
Слайд 9Типы ковалентной связи:
Одинарная (простая) связь – ковалентная связь, при которой между
двумя атомами образуется только одна электронная пара.
σ-связь (сигма-связь) – ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
H2 и Cl2
σ-связь (сигма-связь) – ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
H2 и Cl2
Слайд 10-связь - это ковалентная связь, при образовании которой область перекрывания электронных
облаков находится по обе стороны от линии, соединяющей ядра атомов.
s-облака не образуют -связь.
-связь образуется при участии p- и d-облака.
образуется, когда между атомами возникают две или три общие эл.пары.
s-облака не образуют -связь.
-связь образуется при участии p- и d-облака.
образуется, когда между атомами возникают две или три общие эл.пары.
Слайд 11Кратность связи - число общих эл.пар между связанными электронами.
Двойная связь:
А=В (состоит
из одной σ-связи и одной -связи)
Тройная связь:
А≡В (состоит из одной σ-связи и двух -связей)
Тройная связь:
А≡В (состоит из одной σ-связи и двух -связей)
}
кратные связи
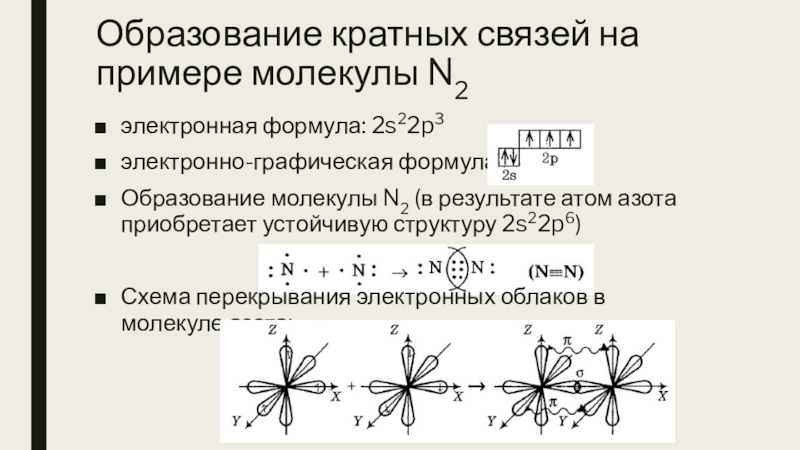
Слайд 12Образование кратных связей на примере молекулы N2
электронная формула: 2s22p3
электронно-графическая формула:
Образование
молекулы N2 (в результате атом азота приобретает устойчивую структуру 2s22p6)
Схема перекрывания электронных облаков в молекуле азота:
Схема перекрывания электронных облаков в молекуле азота:
Слайд 13Важная характеристика КС – полярность связи.
Полярность связи зависит от электроотрицательности(ЭО) элементов.
ЭО
элемента характеризует способность его атома в молекуле притягивать к себе общую электронную пару.
Неполярная КС образована атомами с одинаковой ЭО (общая эл.пара находится на одинаковом расстоянии от ядер обоих атомов). Молекулы с неполярными связями называются неполярными молекулами.
H2, N2, Cl2, O2 и т.д.
Полярная КС – связь с неравномерным распределением эл.плотности между взаимодействующими атомами.
Образуется между атомами с различной ЭО;
Общая эл.пара смещается в сторону атома с большей ЭО.
Неполярная КС образована атомами с одинаковой ЭО (общая эл.пара находится на одинаковом расстоянии от ядер обоих атомов). Молекулы с неполярными связями называются неполярными молекулами.
H2, N2, Cl2, O2 и т.д.
Полярная КС – связь с неравномерным распределением эл.плотности между взаимодействующими атомами.
Образуется между атомами с различной ЭО;
Общая эл.пара смещается в сторону атома с большей ЭО.
Слайд 14Донорно-акцепторный механизм образования КС
Донорно-акцепторная связь – связь, при образовании которой один
атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой между ним и другим атомом (акцептором).
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной эл.парой атома-донора и свободной орбитали атома-акцептора:
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной эл.парой атома-донора и свободной орбитали атома-акцептора:
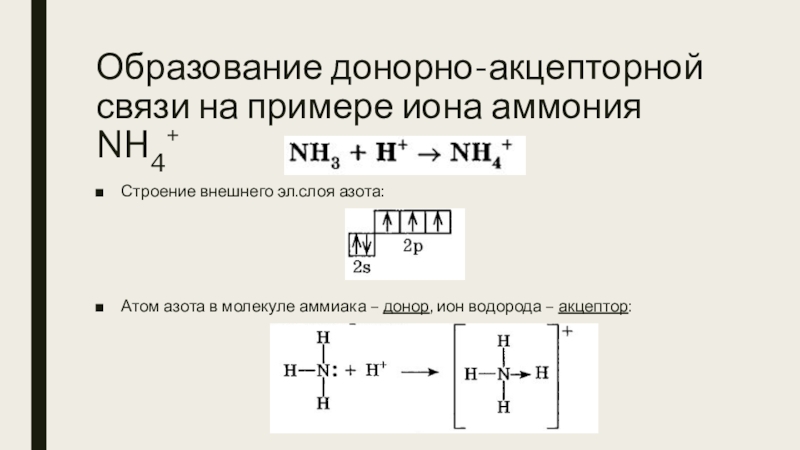
Слайд 15Образование донорно-акцепторной связи на примере иона аммония NH4+
Строение внешнего эл.слоя азота:
Атом
азота в молекуле аммиака – донор, ион водорода – акцептор:
Слайд 16Если элемент образует КС и по обменному, и по донорно-акцепторному механизму,
то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем эл.слое.
К ним относятся:
орбитали с неспаренными электронами,
орбитали с неподеленными электронными парами,
свободные орбитали.
К ним относятся:
орбитали с неспаренными электронами,
орбитали с неподеленными электронными парами,
свободные орбитали.