- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Классификация химических реакций
Содержание
- 1. Презентация к уроку Классификация химических реакций
- 2. I По числу и составу реагирующих веществ.Реакции,
- 3. 2. Изомерия алкенов.
- 4. Реакция, идущая с изменением состава вещества Здесь
- 5. 3. Реакция замещения- это реакция, при которой
- 6. II По изменению степени окисления химических
- 7. 2. Реакции идущие без изменения степени окисления
- 8. III По тепловому эффекту.Экзотермическая реакция протекания с
- 9. IV По агрегатному состоянию реагирующих веществ.Гомогенные реакции-
- 10. V По участию катализатораНекаталитические реакции, идущие без
- 11. VI По направлению По направлению различаю:1. Необратимые
Слайд 1ХИМИЧЕСКИЕ РЕАКЦИИ
I По числу и составу реагирующих веществ.
II По изменению
III По тепловому эффекту.
IV По агрессивному состоянию реагирующих веществ.
V По участию катализатора.
VI По направлению.
Слайд 2I По числу и составу реагирующих веществ.
Реакции, идущие без изменения состава
С(графит) С(алмаз)
S (ромбическая) S (моноклинная)
Р(белый) Р(красный)
К этому типу можно отнести реакциях изомерии , она идет без изменения не качественного, но и количественного состава веществ :
1. Изомерия алканов.
СН3-СН2–СН2–СН2-СН3 ALCH3,t СН2–СН-СН2 –СН3
CH3
Слайд 32. Изомерия алкенов.
СН3-СН2-СН=СН2
H3C-C=CH2
CH3
3. Изомерия алкинов (реакция А.Е. Фаворского).
CH3-CH2-C CH KON, СПИРТ CH3-C C-CH3
4. Изомерия галогеналканов (А.Е. Фаровский).
СН3-СН2-СН2-Br 250 CH3-CH-CH3
Br
5. Изомерия цианата аммония при нагревании.
NH2
NH4 OCN C=O
NH2
Слайд 4Реакция, идущая с изменением состава вещества
Здесь можно выделить четыре типа
1. Реакция соединения- это такие реакции, где из двух и более веществ образуется одно сложное. Это можно увидеть на примере реакции получение серной кислоты из серы:
А) S+O2 =SO2- из двух простых образуется одно сложное
Б) 2SO2+ O2 t, p, кат 2SO3- из одного простого и одного сложного вещества образуется сложное.
В) SO3+H2O=H2SO4- из двух простых веществ образуется одно сложное вещество.
2. Реакция разложения- это реакция, при которых одно или более веществ присоединяется к другим, например получение этилена:
А) Дигратация : C2H5OH H2SO4, t CH2=CH2+H2O
Б) Дегидрирование : CH3-CH3 Cr2O3, t CH2=CH2+H2
В) Крекинг: CH3-CH2-CH3 CH2=CH2+CH4
Слайд 53. Реакция замещения- это реакция, при которой атомы простого вещества замещают
А) Взаимодействие щелочных металлов с водой:
2Na+2H2O=2NaOH+H2
Б) Взаимодействие металлов с кислотами в растворе:
Zn+2HCI=ZnCI2+H2
В) Взаимодействие металлов с солями в растворе:
Fe+CuSO4=FeSO4+Cu
4. Реакция обмена- это когда два сложных вещества меняются своими составными частями:
А) Реакция нейтрализации: NaOH+HNO3=NaNO3+H2O
В ионом виде: OH +H =H2O
Б) Реакция между щелочью и солью:
2NH4 CI + Ca(OH)2=CaCI2+2NH3 +2H2O
В ионом виде: NH4 +OH =NH3 +H2O
В) CUSO4+2KOH=Cu(OH)2 +K2SO4
меню
Слайд 6 II По изменению степени окисления химических элементов, образующих веществ.
По этому
1. Реакции, идущие с изменением степеней окисления электронов, или окислительно-восстановительные реакции. Ярким примером этого могут служить свойства альдегидов
Альдегиды окисления в соответствующие кислоты:
-2 -2
+1 О +1 -2 t +3 O 0
CH3- C +1 +Ag2O CH3-C -2+1 +2Ag
H OH
уксусный альдегид уксусная кислота
меню
Слайд 72. Реакции идущие без изменения степени окисления химических элементов. К ним
Li2O+H2O= 2LiOH
многие реакции разложения:
t
2Fe(OH)3 Fe2O3+ 3H2O
реакция этерификации:
HCOOH+CH3OH HCOOCH3+H2O
меню
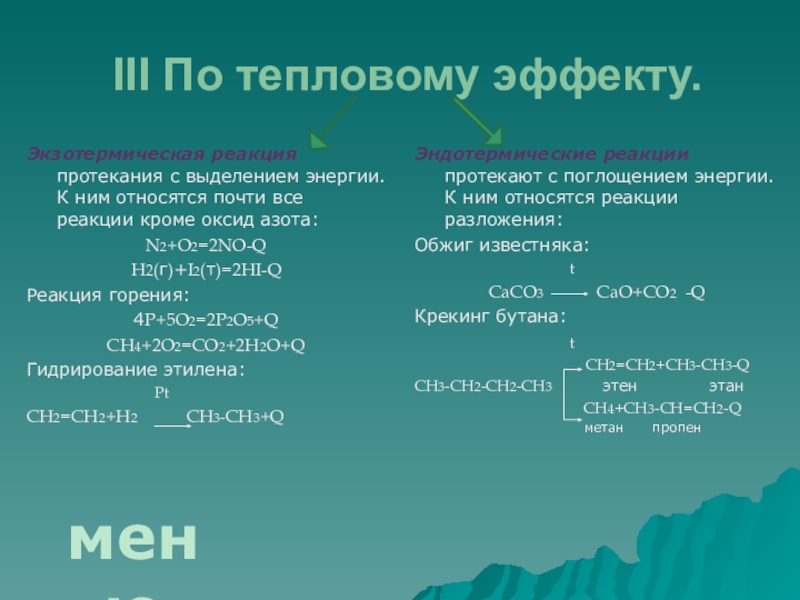
Слайд 8III По тепловому эффекту.
Экзотермическая реакция протекания с выделением энергии. К ним
N2+O2=2NO-Q
H2(г)+I2(т)=2HI-Q
Реакция горения:
4P+5O2=2P2O5+Q
CH4+2O2=CO2+2H2O+Q
Гидрирование этилена:
Pt
CH2=CH2+H2 CH3-CH3+Q
Эндотермические реакции протекают с поглощением энергии. К ним относятся реакции разложения:
Обжиг известняка:
t
CaCO3 CaO+CO2 -Q
Крекинг бутана:
t
CH2=CH2+CH3-CH3-Q
CH3-CH2-CH2-CH3 этен этан
CH4+CH3-CH=CH2-Q
метан пропен
меню
Слайд 9IV По агрегатному состоянию реагирующих веществ.
Гомогенные реакции- реакции, в которых реагирующие
H2(г)+F2(г)=2HF(г)
H2SO4,t
CH3COOH(р-р)+C2H5OH(p-p)
уксусная кислота этиловый спирт
O
CH3-C +H2O(ж)
O-C2H5(p-p)
уксусно-этиловый эфир
Гетерогенные реакции- реакции, в которых реагирующих вещества и продукты реакции находятся в разных агрегатных состояниях:
2AI(т)+3CuCL2(p-p)=
=3Cu(т)+2AICI3(p-p)
CaC2(т)+2H2O(ж)=
=C2H2 +Ca(OH)2(OH)2(p-p)
Слайд 10V По участию катализатора
Некаталитические реакции, идущие без участия катализатора:
2HgO 2Hg+O2
t
C2H4+3O2 2CO2+2H2 O
Каталитические реакции, идущие с участием катализатора:
MnO2,t
2KCIO3 2KCI+3O2
H2SO4,t
C2H5OH CH2=CH2 . +H2O
этан этен
меню
Слайд 11VI По направлению
По направлению различаю:
1. Необратимые реакции протекают в данных
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
2. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
В органической химии признак обратимости отражают названия – антонимы процессов:
Гидрирование – дегидрирование,
Гидратация – дегидратация,
Полимеризация – деполимеризация.
Обратимы все реакции этерификации и гидролиза белков, сложные эфиры , углевод. Обратимость процессов лежит в основе важнейшего свойства живого организма – обмена веществ.
меню