Все что нас окружает состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. Без химических реакций невозможна жизнь и все многообразие веществ. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Классификация химических реакций
Содержание
- 1. Презентация к уроку Классификация химических реакций
- 2. Отгадай загадку и узнай о
- 3. Что такое химическая реакция?Химические реакции или химические
- 4. По каким признакам можно определить химические реакции?Выделение
- 5. Каковы условия возникновения реакций:1) Образование хлорида аммония2)
- 6. Химическое уравнение – условная запись химической реакции посредством химических формули коэффициентов.
- 7. Расставьте коэффициенты в приведенных схемах химических реакций:I
- 8. I группа:2Mg + O2 = 2MgOII группа:2KNO3
- 9. Экзотермические - реакции протекающие с выделением
- 10. Эндотермические – реакции протекающие с поглощением
- 11. ,,,1 = И
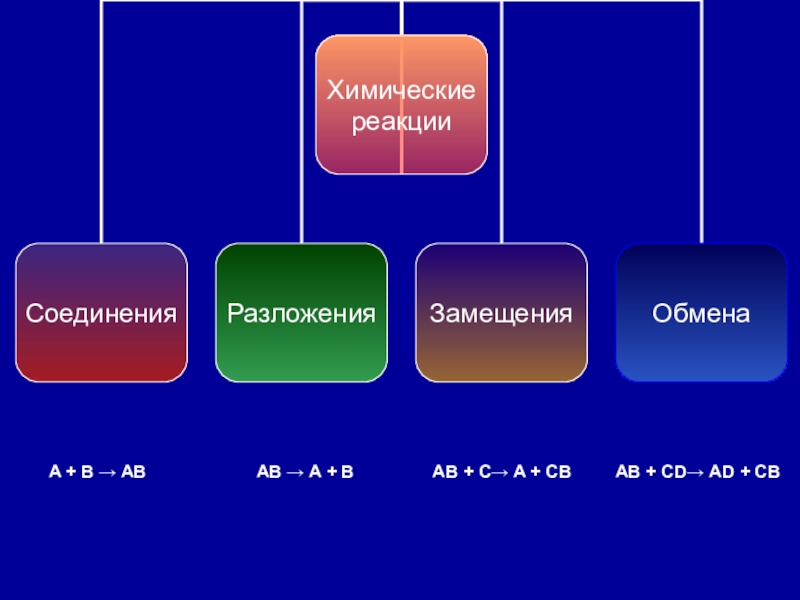
- 12. Классификацияхимических реакций
- 13. O=2KNO3 = 2KNO2 + O2↑O+ONНитрат калия Нитрит калия КислородOOO
- 14. Реакция разложенияРеакция разложения – реакция,
- 15. MgO+=2Mg + O2 = 2 MgOOКислородМагнийОксид магнияMgOOMgMg
- 16. Реакции соединенияРеакция соединения – реакция, в ходе,
- 17. ZnH+=Zn + 2HCl = ZnCl2 + H2↑Cl+СолянаякислотаЦинкХлорид цинкаВодородHClHClZn
- 18. Реакция замещенияРеакция замещения – реакция
- 19. SO4+=Na2SO4 + BaCl2 = 2NaCl + BaSO4↓+Хлорид барияСульфат натрияХлорид натрияСульфат барияNaSO4BaClBaClNa
- 20. Реакция обменаРеакция обмена – реакция,
- 21. A + B → AB AB →
- 22. С А М О С Т О
- 23. I вариантРеакции соединения:4Li + O2 → 2Li2OLi2O
- 24. Задание II.H2SiO3 → SiO2 + H2O;NaNO3 →
- 25. «5», если вы набрали 8 – 15
- 26. РефлексияСделай выводПодумай, кого из одноклассников ты бы отметил за работу на уроке?
- 27. ВЫВОДЫ: Классификация реакций:по тепловому эффекту экзотермическая реакция эндотермическая реакцияпо
- 28. Домашнее задание§ 30 упр. 1, 4.
- 29. Спасибо за урок!
Отгадай загадку и узнай о чем пойдет речь на сегодняшнем урокеОна идет, она прошла! Никто
Слайд 1
Слайд 2 Отгадай загадку и узнай о чем пойдет
речь на сегодняшнем уроке
Она
идет,
она
прошла! Никто
не скажет,
что пришла!
Она - ********** ******* !
Слайд 3Что такое химическая реакция?
Химические реакции или химические явления – это процессы,
в результате которых из одних веществ образуются другие;
Слайд 4По каким признакам можно определить химические реакции?
Выделение газа;
Образование осадка;
Выделение (поглощение) тепла
и света;
Появление или изменение запаха;
Изменение цвета;
Появление или изменение запаха;
Изменение цвета;
Слайд 5Каковы условия возникновения реакций:
1) Образование хлорида аммония
2) Горение магния
3) Взаимодействие алюминия
с иодом
Смешивание веществ;
Нагревание;
Измельчение;
Соприкосновение ;
Растворение;
Слайд 6
Химическое уравнение –
условная запись химической реакции
посредством химических формул
и
коэффициентов.
Слайд 7Расставьте коэффициенты в приведенных схемах химических реакций:
I группа:
Mg + O2 =
MgO
II группа:
KNO3 = KNO2 + O2⭡
III группа:
Zn + HCl = ZnCl2 + H2 ⭡
IV группа:
Na2SO4 + BaCl2 = NaCl + BaSO4↓
V группа:
P + O2 = P2O5 + Q
VI группа:
N2 + O2 = NO – Q
II группа:
KNO3 = KNO2 + O2⭡
III группа:
Zn + HCl = ZnCl2 + H2 ⭡
IV группа:
Na2SO4 + BaCl2 = NaCl + BaSO4↓
V группа:
P + O2 = P2O5 + Q
VI группа:
N2 + O2 = NO – Q
Слайд 8I группа:
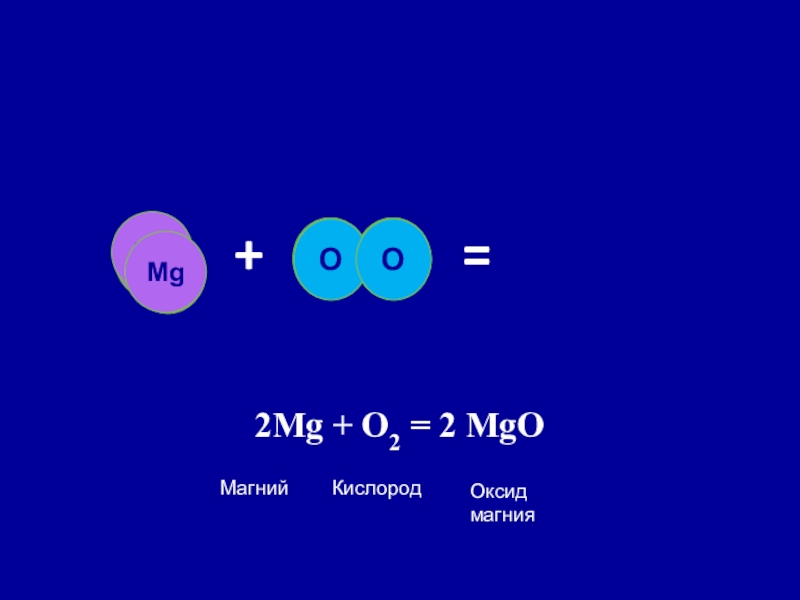
2Mg + O2 = 2MgO
II группа:
2KNO3 = 2KNO2 + O2⭡
III
группа:
Zn + 2HCl = ZnCl2 + H2 ⭡
IV группа:
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
V группа:
4P + 5O2 =2P2O5 + Q
VI группа:
N2 + O2 = 2NO – Q
Различаются ли между собой реакции?
Zn + 2HCl = ZnCl2 + H2 ⭡
IV группа:
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
V группа:
4P + 5O2 =2P2O5 + Q
VI группа:
N2 + O2 = 2NO – Q
Различаются ли между собой реакции?
Слайд 9Экзотермические -
реакции протекающие с выделением теплоты
4P + 5O2 =
2P2O5 + Q
CH4+2O2 = CO2+2H2O + Q
CH4+2O2 = CO2+2H2O + Q
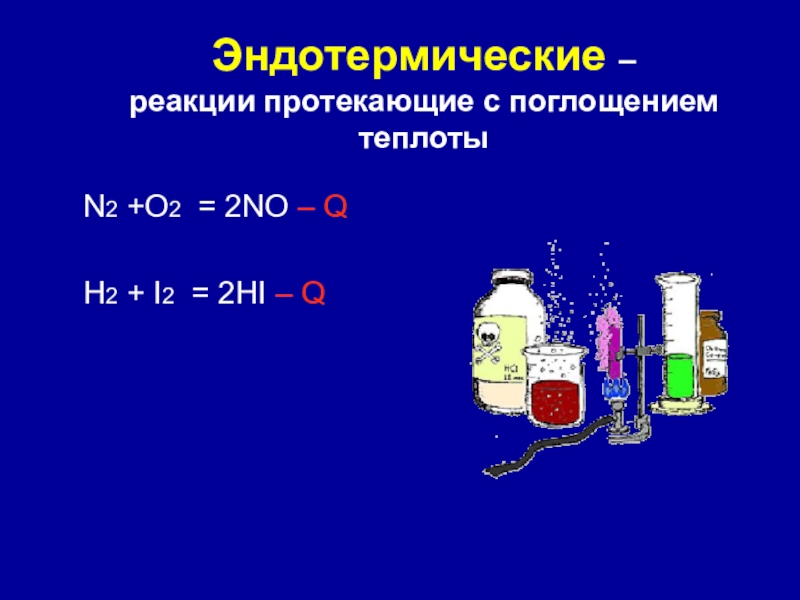
Слайд 10Эндотермические –
реакции протекающие с поглощением теплоты
N2 +O2 = 2NO –
Q
H2 + I2 = 2HI – Q
H2 + I2 = 2HI – Q
Слайд 14 Реакция разложения
Реакция разложения – реакция, в которой из одного
исходного вещества образуется несколько новых веществ.
Электролиз воды
2H2O = 2H2 + O2⭡
Разложение нитрата калия
2KNO3 = 2KNO2 + O2⭡
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2⭡
Электролиз воды
2H2O = 2H2 + O2⭡
Разложение нитрата калия
2KNO3 = 2KNO2 + O2⭡
Разложение перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2⭡
Слайд 16Реакции соединения
Реакция соединения – реакция, в ходе, которой из нескольких простых
и сложных веществ образуется одно более сложное вещество.
Взаимодействие оксида кальция с водой
CaO + H2O = Ca(OH)2
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
Горение оксида серы (IV)
2SO2 + O2 = 2SO3
Взаимодействие оксида кальция с водой
CaO + H2O = Ca(OH)2
Взаимодействие оксида серы (IV) с водой
SO2 + H2O = H2SO3
Горение оксида серы (IV)
2SO2 + O2 = 2SO3
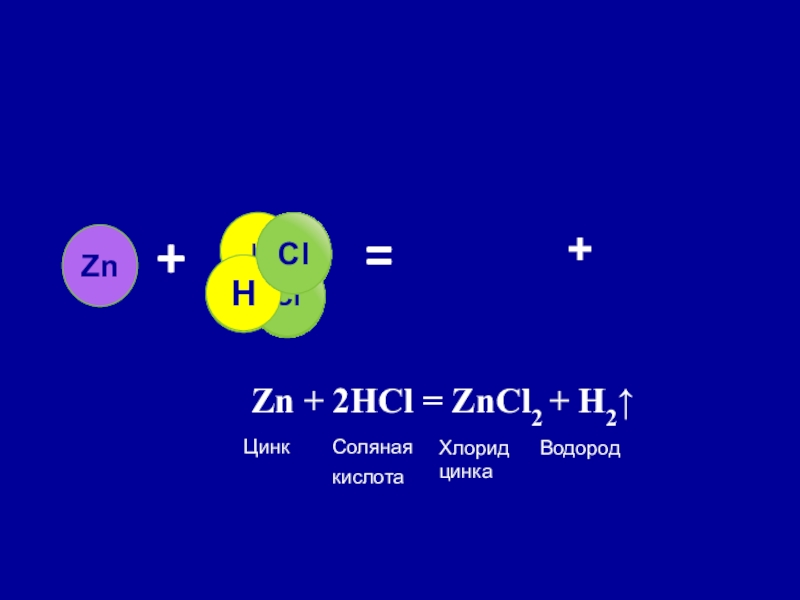
Слайд 18 Реакция замещения
Реакция замещения – реакция между простым и сложным
веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества.
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2⭡
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2⭡
Взаимодействие железа с раствором сульфата меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
Взаимодействие цинка с соляной кислотой
Zn + 2HCl = ZnCl2 + H2⭡
Взаимодействие натрия с водой
2Na + 2H2O = 2NaOH + H2⭡
Взаимодействие железа с раствором сульфата меди (II)
Fe + CuSO4 = FeSO4 + Cu↓
Слайд 19
SO4
+
=
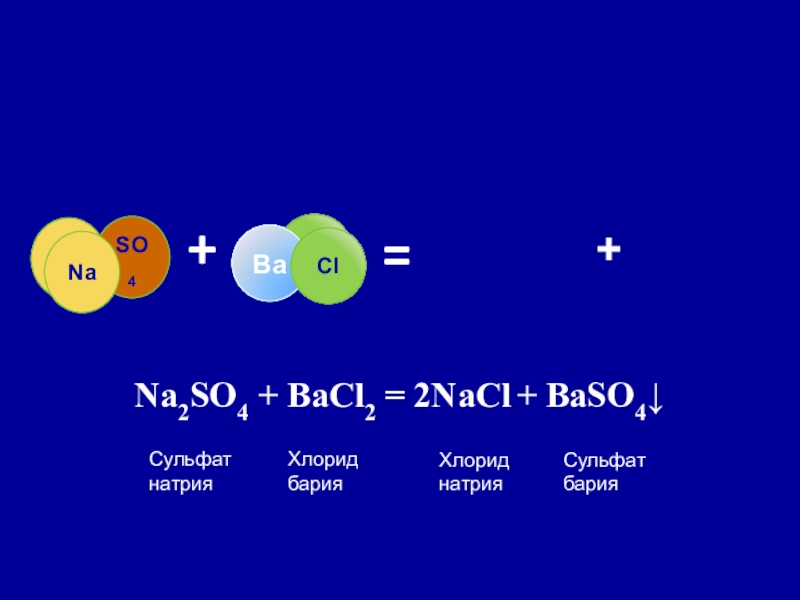
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
+
Хлорид бария
Сульфат натрия
Хлорид натрия
Сульфат бария
Na
SO4
Ba
Cl
Ba
Cl
Na
Слайд 20 Реакция обмена
Реакция обмена – реакция, в результате которой два
вещества обмениваются своими составными частями, образуя два новых вещества.
Взаимодействие растворов сульфата меди (II) и гидроксида калия
CuSO4 + 2KOH = Cu(OH)2⭣ + K2SO4
Взаимодействие раствора гидроксида натрия с азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3⭡ + 2H2O
Взаимодействие растворов сульфата меди (II) и гидроксида калия
CuSO4 + 2KOH = Cu(OH)2⭣ + K2SO4
Взаимодействие раствора гидроксида натрия с азотной кислотой
NaOH + HNO3 = NaNO3 + H2O
Взаимодействие хлорида аммония с гидроксидом кальция
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3⭡ + 2H2O
Слайд 23I вариант
Реакции соединения:
4Li + O2 → 2Li2O
Li2O + H2O → 2LiOH
Реакции
обмена:
2HCl + MgO → MgCl2 + H2O
II вариант
Реакции разложения:
2Fe(OH)3 → Fe2O3 + 3H2O
4HNO3 → 4NO2 + 2H2O + O2
Реакции замещения:
CuSO4 + Fe → FeSO4 + Cu
2HCl + MgO → MgCl2 + H2O
II вариант
Реакции разложения:
2Fe(OH)3 → Fe2O3 + 3H2O
4HNO3 → 4NO2 + 2H2O + O2
Реакции замещения:
CuSO4 + Fe → FeSO4 + Cu
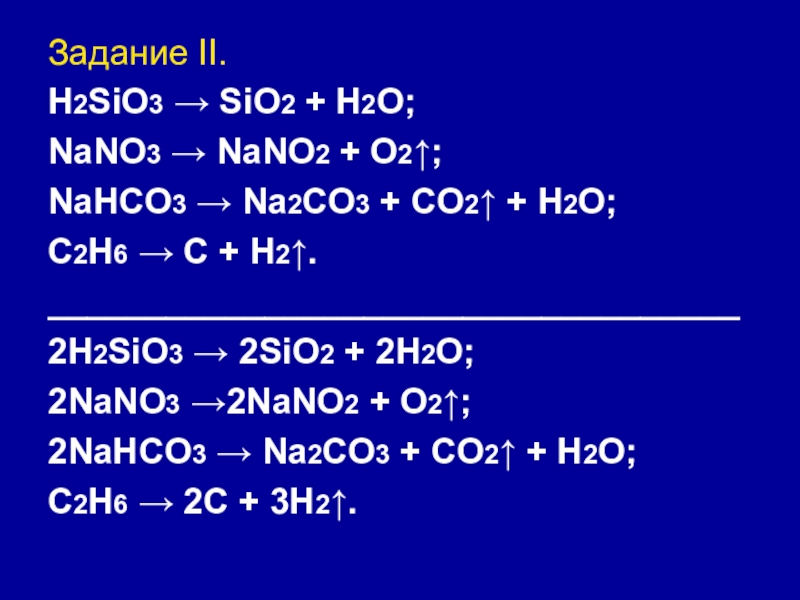
Слайд 24Задание II.
H2SiO3 → SiO2 + H2O;
NaNO3 → NaNO2 + O2↑;
NaHCO3 →
Na2CO3 + CO2↑ + H2O;
C2H6 → C + H2↑.
___________________________________
2H2SiO3 → 2SiO2 + 2H2O;
2NaNO3 →2NaNO2 + O2↑;
2NaHCO3 → Na2CO3 + CO2↑ + H2O;
C2H6 → 2C + 3H2↑.
C2H6 → C + H2↑.
___________________________________
2H2SiO3 → 2SiO2 + 2H2O;
2NaNO3 →2NaNO2 + O2↑;
2NaHCO3 → Na2CO3 + CO2↑ + H2O;
C2H6 → 2C + 3H2↑.
Слайд 25«5», если вы набрали 8 – 15 баллов
«4», если вы набрали
4 – 8 баллов
«3», если вы набрали 2 – 4 балла
«3», если вы набрали 2 – 4 балла
Поставь себе оценку:
Слайд 27ВЫВОДЫ:
Классификация реакций:
по тепловому эффекту
экзотермическая реакция
эндотермическая реакция
по числу и составу исходых веществ
и продуктов реакции
реакция соединения
реакция разложения
реакция замещения
реакция обмена
реакция соединения
реакция разложения
реакция замещения
реакция обмена