- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Карбоновые кислоты
Содержание
- 1. Презентация к уроку Карбоновые кислоты
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
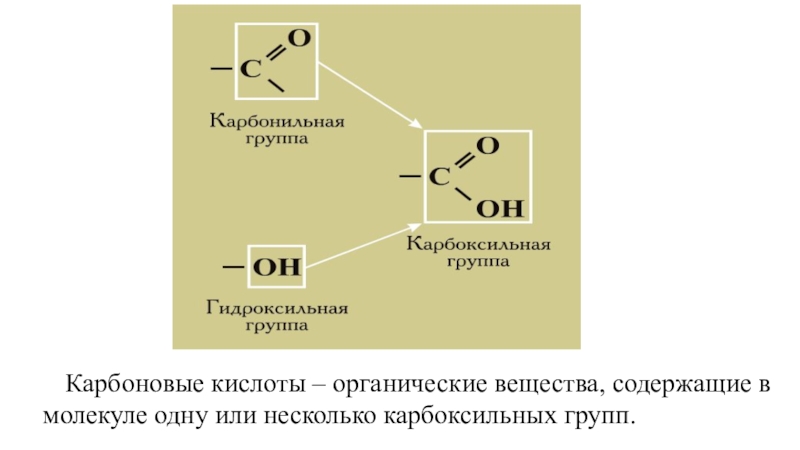
- 6. Карбоновые кислоты – органические вещества, содержащие в молекуле одну или несколько карбоксильных групп.
- 7. Классификация карбоновых кислот 1) по количеству карбоксильных
- 8. Номенклатура. R – COOH общая формула карбоновых
- 9. Слайд 9
- 10. Физические свойства карбоновых кислот: (работа с учебником) Низшие
- 11. Применение Муравьиная кислота – в медицине - муравьиный
- 12. Химические свойства карбоновых кислотХимические свойства карбоновых кислот
- 13. Получение карбоновых кислот Окисление альдегидовВ промышленности: 2RCHO
- 14. Задачи:Какая масса гидроксида натрия потребуется для полной
Карбоновые кислоты – органические вещества, содержащие в молекуле одну или несколько карбоксильных групп.
Слайд 6Карбоновые кислоты – органические вещества, содержащие в молекуле одну или несколько
карбоксильных групп.
Слайд 7Классификация карбоновых кислот 1) по количеству карбоксильных групп: а) одноосновные R –
COOH (метановая, этановая кислоты)
б) многоосновные HOOC – R – COOH (щавелевая, янтарная кислоты).
2) по природе углеводородного радикала: а) предельные (метановая, этановая кислоты); б) ароматические (бензойная кислота);
г) непредельные (олеиновая, линолевая, линоленовая кислоты).
б) многоосновные HOOC – R – COOH (щавелевая, янтарная кислоты).
2) по природе углеводородного радикала: а) предельные (метановая, этановая кислоты); б) ароматические (бензойная кислота);
г) непредельные (олеиновая, линолевая, линоленовая кислоты).
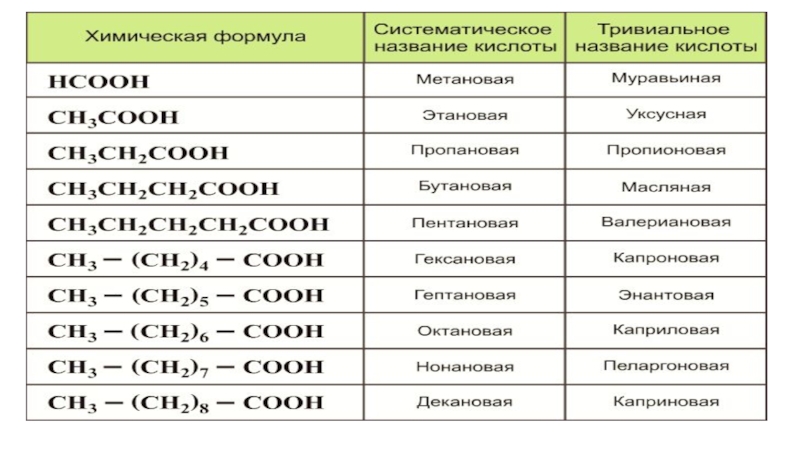
Слайд 8Номенклатура. R – COOH общая формула карбоновых кислот. CnH2n+1 – COOH общая
формула предельных одноосновных карбоновых кислот
Для определения названия в соответствии с международной номенклатурой придерживаются порядка:
1) Выделяют главную цепь.
2) Нумеруют цепь, начиная с карбоксильной группы;
3) Называют номер атома углерода, при котором находится радикал;
4) Называют радикал;
5) Называют углеродную цепь;
6) Добавляют суффикс - овая кислота
Слайд 10Физические свойства карбоновых кислот: (работа с учебником) Низшие карбоновые кислоты — жидкости
с острым запахом, хорошо растворимые в воде. С повышениемотносительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и ввиде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Слайд 11Применение
Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор
муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
Слайд 12Химические свойства карбоновых кислот
Химические свойства карбоновых кислот обусловлены в первую очередь
особенностями их строения. Так, растворимые в воде кислоты способны диссоциировать на ионы:
R-COOH↔R-COO— + H+.
Благодаря наличию в воде иона H+ они имеют кислый вкус, способны менять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты – слабые электролиты.
Карбоновые кислоты обладают химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействуют с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4):
2CH3-COOh + Zn → (CH3COO)2Zn + H2↑ (1);
2CH3-COOH + CuO→ (CH3COO)2Cu + H2O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH3-COOH + NaHCO3→ CH3COONaацетат натрия + H2O + CO2↑ (4).
Специфическое свойство предельных, а также непредельных карбоновых кислот, проявляемое за счет функциональной группы, — взаимодействие со спиртами.
Карбоновые кислоты взаимодействуют со спиртами при нагревании и в присутствии концентрированной серной кислоты. Например, если к уксусной кислоте прилить этиловый спирт и немного серной кислоты, то при нагревании появляется запах этилового эфира уксусной кислоты (этилацетата):
CH3-COOH + C2H5OH ↔CH3-C(O)-O-C2H5 + H2O.
Слайд 13 Получение карбоновых кислот
Окисление альдегидов
В промышленности: 2RCHO + O2 →2RCOOH
Окисление спиртов:
RCH2OH + O2→ RCOOH + H2O
Окисление углеводородов: 2C4H10 + 5O2 →4CH3COOH + 2H2O
4.Из солей (лабораторный способ): CH3COONaкр.+ H2SO4 конц. →CH3COOH + NaHSO4
Окисление углеводородов: 2C4H10 + 5O2 →4CH3COOH + 2H2O
4.Из солей (лабораторный способ): CH3COONaкр.+ H2SO4 конц. →CH3COOH + NaHSO4
Слайд 14Задачи:
Какая масса гидроксида натрия потребуется для полной нейтрализации 180 г
35% раствора уксусной кислоты?
Какое количество вещества и какая масса ацетата натрия образуется при взаимодействии растворов, содержащих 45 г уксусной кислоты и 45 г гидроксида натрия?
Д/з § 27 - 28, записи в тетр. Какая масса гидроксида натрия необходима для нейтрализации 600г 20%-ного раствора уксусной кислоты?
Какое количество вещества и какая масса ацетата натрия образуется при взаимодействии растворов, содержащих 45 г уксусной кислоты и 45 г гидроксида натрия?
Д/з § 27 - 28, записи в тетр. Какая масса гидроксида натрия необходима для нейтрализации 600г 20%-ного раствора уксусной кислоты?