- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химиии по теме Водород
Содержание
- 1. Презентация к уроку химиии по теме Водород
- 2. ДЕВИЗ УРОКА:Знание только тогда знание, когда оно
- 3. Давайте вспомним:1.Что является графическим отображением периодического закона?2.Каков
- 4. О каком веществе идет речь?Первый я на
- 5. Водород, его физические и химические свойства.
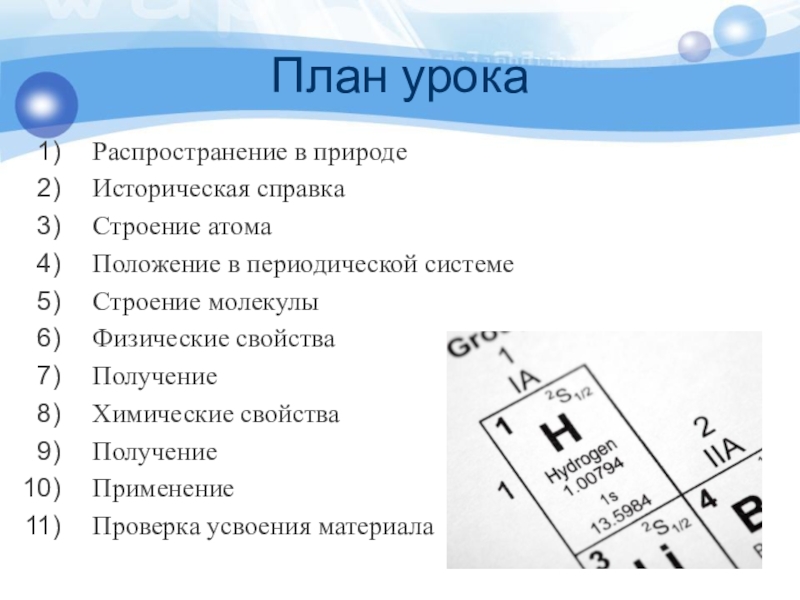
- 6. План урокаРаспространение в природеИсторическая справкаСтроение атомаПоложение в периодической системеСтроение молекулыФизические свойстваПолучениеХимические свойстваПолучениеПрименение Проверка усвоения материала
- 7. Через тернии к звёздам... Цель:Познакомиться с
- 8. . Распространенность в природеНа долю водорода приходится 50 % массыСолнца и других звезд
- 9. Земная кора(массовая доля)
- 10. В составе атмосферного воздуха присутствие водорода менее 0,0001 %
- 11. В воде на долю водорода приходится 11%
- 12. Распространение на Земле
- 13. Распространённость во ВселеннойВодород — самый распространённый элемент
- 14. Слайд 14
- 15. Генри Кавендиш Знаменитый английский физик и
- 16. В 1779 г. Антуан Лавуазье получил водород при
- 17. Русское название «водород» предложил химик М. Ф.
- 18. Строение атомаИзотопы водородаПорядковый номер 1Группа – IПериод
- 19. . Положение в периодической системе
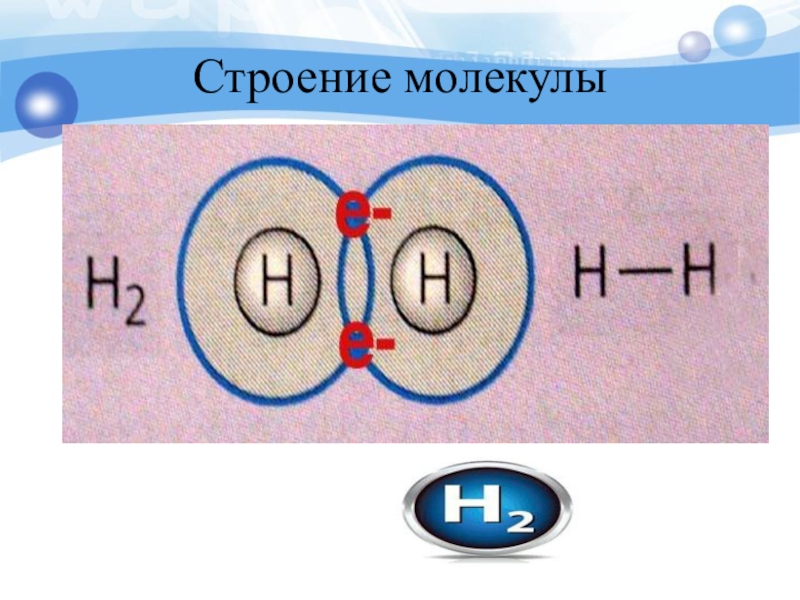
- 20. Строение молекулы
- 21. Физические свойстваГаз без цвета, вкуса и запаха.Легче
- 22. Водород в 14,5 раз легче воздухаВодород самый
- 23. Опыт Пилатра де РозьераФранцузский химик решил проверить,
- 24. Гремучий газ(Этот газ – водород. В легких
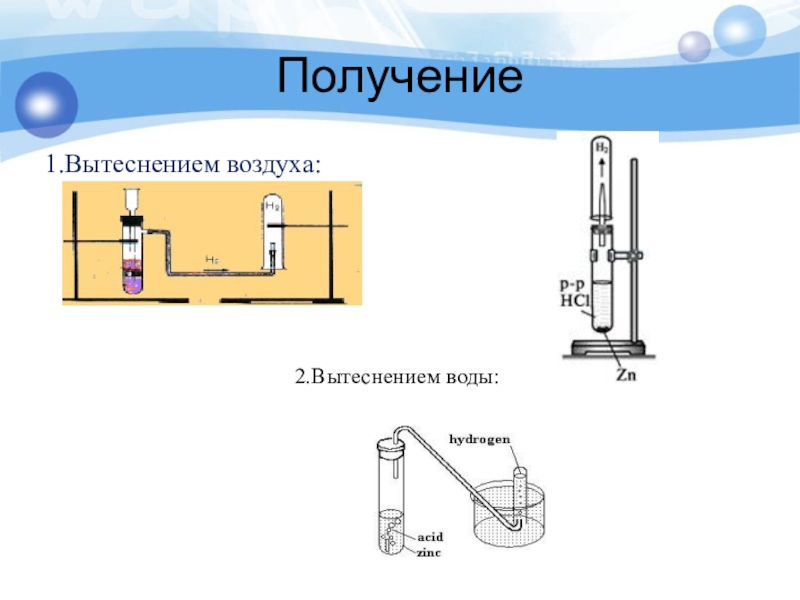
- 25. Получение1.Вытеснением воздуха:2.Вытеснением воды:
- 26. ПолучениеВ промышленности – конверсией водяных паров с
- 27. Химические свойстваВзаимодействие с металлами: Ca + H2 =
- 28. ПрименениеХимическая промышленность: получение аммиака, метанола, мыла, пластмасс и др.
- 29. Применение Пищевая промышленность: а) производство маргарина б) пищевая добавка Е949 (упаковочный газ)
- 30. ПрименениеТопливо (ракетное, машинное) Военная промышленность (производство водородных бомб)Резка и сварка металлов
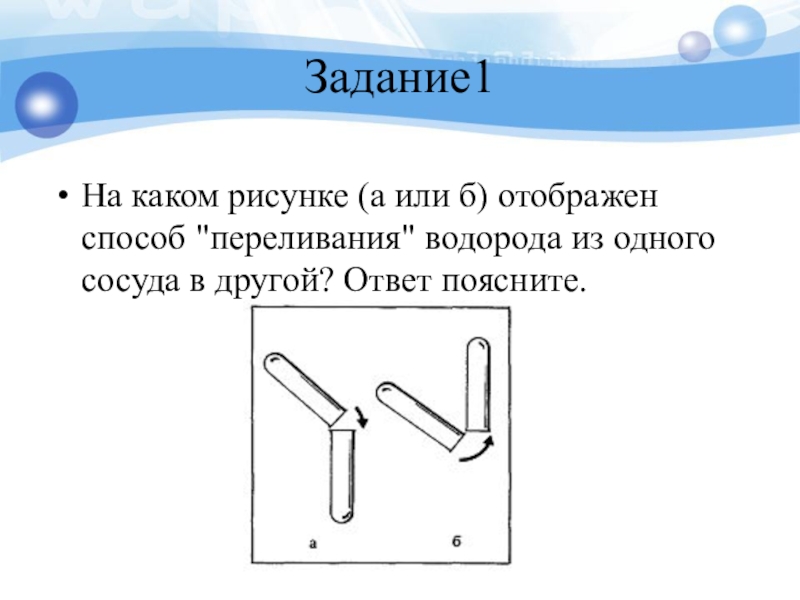
- 31. Задание1На каком рисунке (а или б) отображен
- 32. Задание 2Водород является продуктом взаимодействия:1) Cu +
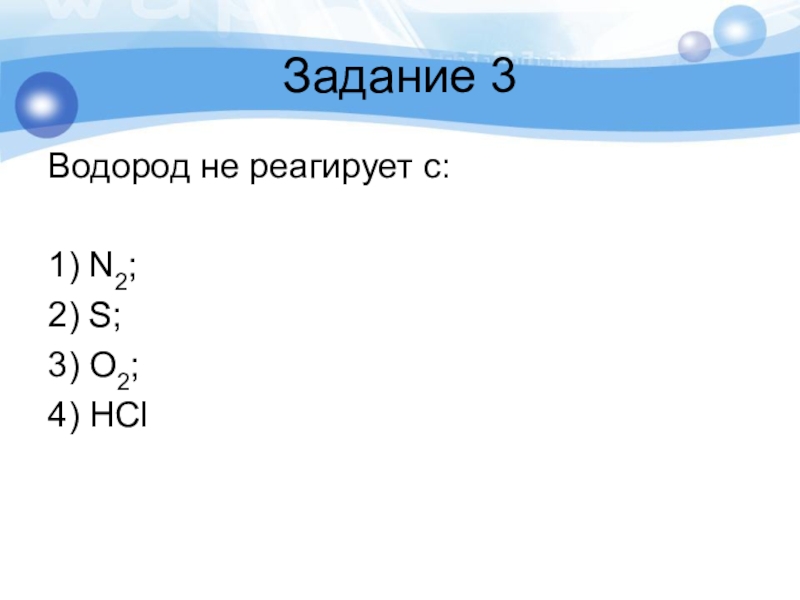
- 33. Задание 3Водород не реагирует с:1) N2; 2) S; 3) O2; 4) HCl
- 34. Задание 4Водород реагирует:1) только с простыми веществами;
- 35. Задание 5Водород реагирует с:1) Н2О; 2) SO3; 3) Cl2; 4) Au
- 36. Задание 6Неверным является утверждение:1) Водород самый легкий
- 37. Задание 7Восстановительные свойства водород проявляет при взаимодействии с1)калием2)натрием3)кальцием4)йодом
- 38. Задание 8Взаимодействие водорода с кислородом является реакцией1)разложения2)замещения3)эндотермической4)экзотермической
- 39. Задание 9Химические свойства водорода используются при:1) получении
- 40. Задание 10Формула продукта реакции и коэффициент перед
- 41. ответы1-б2-2
Слайд 2ДЕВИЗ УРОКА:
Знание только тогда
знание, когда оно
а не памятью.
Л.Н. Толстой
Слайд 3Давайте вспомним:
1.Что является графическим отображением периодического закона?
2.Каков физический смысл порядкового номера?
3.Физический
4.Физический смыл номера группы?
5. На какие две большие группы делятся химические элементы?
6.Как называется связь, возникающая между атомами неметаллов?
7. Какую связь мы называем ковалентной полярной?
8. Что такое изотопы?
Слайд 4О каком веществе идет речь?
Первый я на белом свете:
Во Вселенной, на
Гость из космоса пришёл, В воде приют себе нашёл.
Я, газ легчайший и бесцветный, Неядовитый и безвредный. Соединяясь с кислородом, Я для питья даю вам воду.
Слайд 6План урока
Распространение в природе
Историческая справка
Строение атома
Положение в периодической системе
Строение молекулы
Физические свойства
Получение
Химические
Получение
Применение
Проверка усвоения материала
Слайд 7Через тернии
к звёздам...
Цель:
Познакомиться с распространением водорода в природе
Познакомиться с
Изучить физические и химические свойства водорода в сравнении с кислородом
Рассмотреть основные области применения водорода
Слайд 13Распространённость во Вселенной
Водород — самый распространённый
элемент во Вселенной.
На его
около 92 % всех атомов
водород — основная составная
часть звёзд и межзвёздного газа.
В условиях звёздных температур
водород существует в виде плазмы,
в межзвёздном пространстве этот
элемент существует в виде отдельных
молекул, атомов и ионов .
Слайд 15Генри Кавендиш
Знаменитый английский физик и химик Г.Каведиш в 1766 исследовал
Слайд 16В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская ее
Водород
Он установил, что «горючий воздух» входит в состав воды и может быть из нее получен.
В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество.
Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду».
Слайд 17Русское название «водород» предложил химик М. Ф. Соловьев в 1824 году.
На рубеже 18 и 19 века было установлено,
что атом водорода очень легкий (по
сравнению с атомами других элементов),
и вес (масса) атома водорода был принят
за единицу.
.
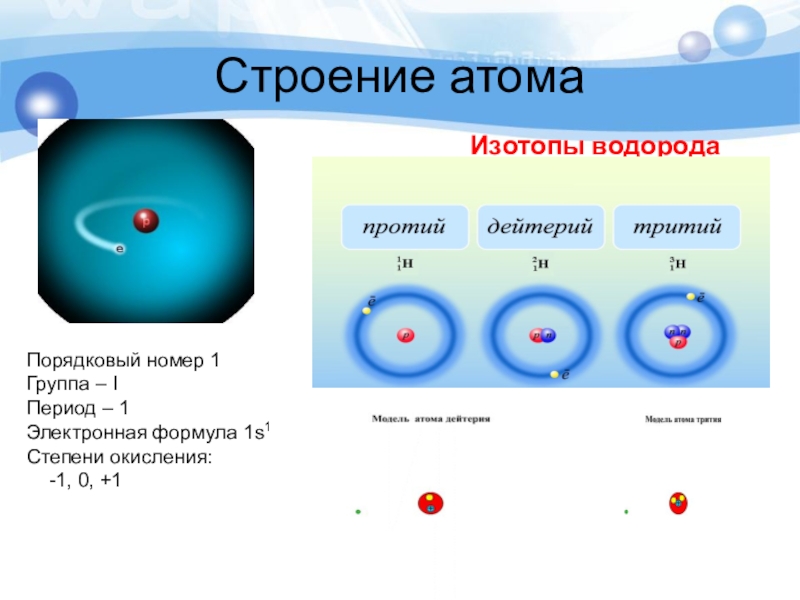
Слайд 18Строение атома
Изотопы водорода
Порядковый номер 1
Группа – I
Период – 1
Электронная формула 1s1
Степени
-1, 0, +1
Слайд 21Физические свойства
Газ без цвета, вкуса и запаха.
Легче воздуха в 14,5 раз.
Плохо
Хорошо растворим в некоторых металлах (например, Pd).
Самая высокая теплопроводность среди газообразных веществ (в 7 раз выше теплопроводности воздуха).
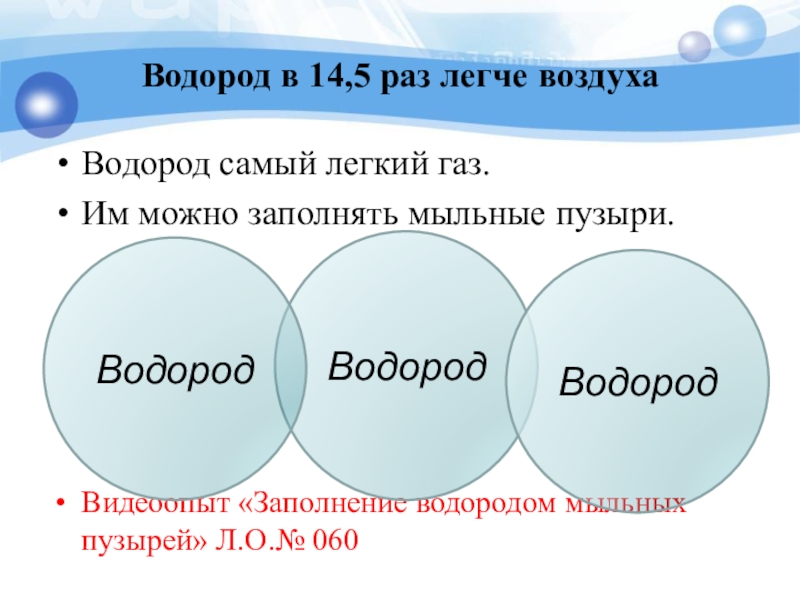
Слайд 22Водород в 14,5 раз легче воздуха
Водород самый легкий газ.
Им можно заполнять
Видеоопыт «Заполнение водородом мыльных пузырей» Л.О.№ 060
Водород
Водород
Водород
Слайд 23Опыт Пилатра де Розьера
Французский химик решил проверить, что
будет, если вдохнуть этот
такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться проник ли газ в легкие.
Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако газ легких экспериментатора смешался с воздухом, и произошел сильный взрыв.
Розье впоследствии писал: «Я думал, что у меня вылетят все зубы вместе с корнями». Какой газ вдохнул Розье?
Проводить подобные эксперименты опасно для жизни.
Слайд 24Гремучий газ
(Этот газ – водород. В легких он смешался с кислородом
Смесь 2V(H2) и 1V(O2) называют гремучим газом
Видеоопыт «Приготовление и взрыв гремучей смеси» Л.О.№ 023
Слайд 26Получение
В промышленности – конверсией водяных паров с углем или метаном:
С +
CH4 + H2O = CO + 3H2
II. В лаборатории:
1) действием разбавленных кислот (кроме HNO3) на металлы: Zn + 2HCl = ZnCl2 + H2
2) взаимодействием кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2
3) разложением гидридов водой:
NaH + H2O = NaOH + H2
4) действием щелочей на Zn или Al:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5) электролизом воды:
2H2O = 2H2 + O2
Получение водорода и проверка его на чистоту Л.О.№ 022
Слайд 27Химические свойства
Взаимодействие с металлами:
Ca + H2 = CaH2
CaH2 + 2H2O =
2) Взаимодействие с неметаллами
H2 + F2 = 2HF
2H2 + C = CH4
2H2 + O2 = 2H2O
3) Восстановление металлов из оксидов:
Fe2O3 + 3H2 = 2Fe + 3H2O
Видеоопыты : №020 «Взаимодействие водорода с кислородом»
№ 055»Взаимодействие водорода с хлором»,
№019 «Восстановление меди из оксида меди)
Слайд 29Применение
Пищевая промышленность:
а) производство маргарина
б) пищевая добавка Е949 (упаковочный газ)
Слайд 30Применение
Топливо (ракетное, машинное)
Военная промышленность (производство водородных бомб)
Резка и сварка металлов
Слайд 31Задание1
На каком рисунке (а или б) отображен способ "переливания" водорода из
Слайд 32Задание 2
Водород является продуктом взаимодействия:
1) Cu + HCl;
2) Zn +
3) Cu + H2O;
4) S + NaOH
Слайд 34Задание 4
Водород реагирует:
1) только с простыми веществами;
2) с простыми и
3) только со сложными веществами;
4) только с неметаллами.
Слайд 36Задание 6
Неверным является утверждение:
1) Водород самый легкий газ.
2) Водород хорошо растворяется
3)Молекула водорода двухатомна.
4) Гидриды –это бинарные соединения,состоящие из металла и водорода
Слайд 37Задание 7
Восстановительные свойства водород проявляет при взаимодействии с
1)калием
2)натрием
3)кальцием
4)йодом
Слайд 38Задание 8
Взаимодействие водорода с кислородом является реакцией
1)разложения
2)замещения
3)эндотермической
4)экзотермической
Слайд 39Задание 9
Химические свойства водорода используются при:
1) получении сверхнизких температур;
2) наполнении
3) получении металлов из их оксидов;
4) отводе теплоты в электрических машинах.
Слайд 40Задание 10
Формула продукта реакции и коэффициент перед ней в уравнении реакции
1) HCl;
2) 2HCl;
3) 3HCl;
4) 4HCl
Слайд 41ответы
1-б
2-2
3-4 10 отметка «5»
4-2 8-9 отметка «4»
5-4 5-7 отметка «3»
6-2 менее 5 отметка «2»
7-4
8-4
9-3
10-2