- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии в 9 классе по теме: Углерод как простое вещество.
Содержание
- 1. Презентация к уроку химии в 9 классе по теме: Углерод как простое вещество.
- 2. План урокаОбщая характеристика элементов IVА группы.Изменение свойств
- 3. Строение атомовОбщая электронная формула внешнего слояS2
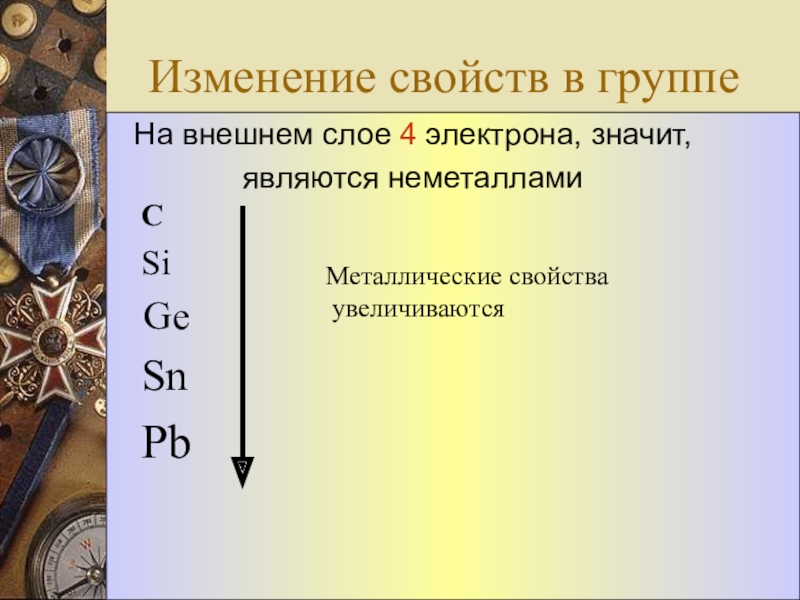
- 4. Изменение свойств в группе С Si Ge Sn PbМеталлические свойства увеличиваются
- 5. Окислительные и восстановительные свойства:Эл0 + 4е →
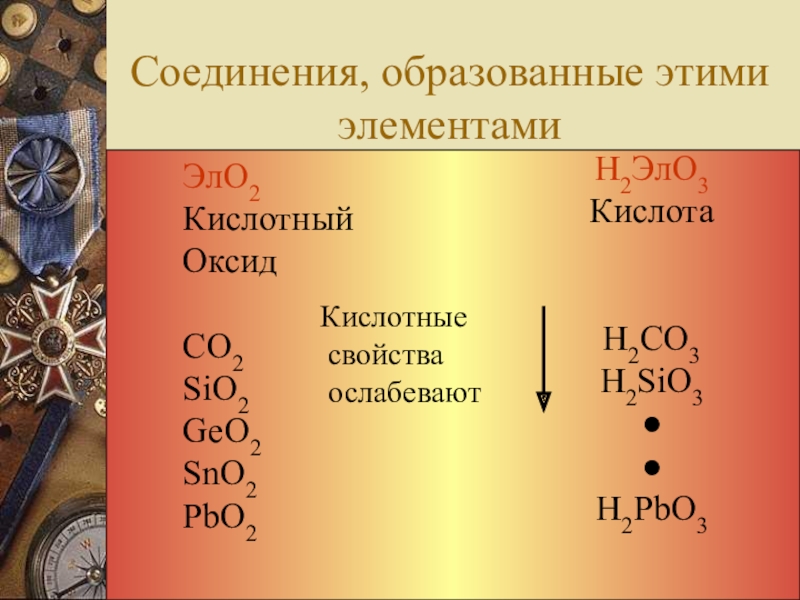
- 6. Соединения, образованные этими элементамиЭлО2КислотныйОксидСО2SiO2GeO2SnO2PbO2Кислотные свойства ослабеваютН2ЭлО3КислотаН2СО3Н2SiO3●●Н2PbO3
- 7. УГЛЕРОД В ПРИРОДЕУглерод в природе встречается в
- 8. Аллотропные модификации углеродаАлмазГрафитКарбинФуллерены
- 9. А Л М А ЗАлмаз-бесцветное,прозрачное вещество с
- 10. А Л М А ЗКристаллы алмаза бывают синего, голубого, красного,черного цветов.Окраска алмазов обусловливается наличием примесей.
- 11. А Л М А З Алмаз-»царь камней»Ограненные прозрачные алмазы называются бриллиантамиСкипетр Императорский с алмазом «Орлов»Алмаз «Шах»
- 12. А Л М А З Применение алмазов:камни ювелиров«алмазный инструмент»:резцыбурышлифовальные кругисверланапильники
- 13. Г Р А Ф И ТВещество серо-стального
- 14. Г Р А Ф И Т Применение
- 15. Г Р А Ф И ТСходное с
- 16. П О Ч Е М УА Л
- 17. А Л М А З Алмаз имеет
- 18. Г Р А Ф И Т Графит
- 19. Как доказать, что алмаз и графит состоят
- 20. К А Р Б И Н Самая
- 21. Ф У Л Л Е Р Е
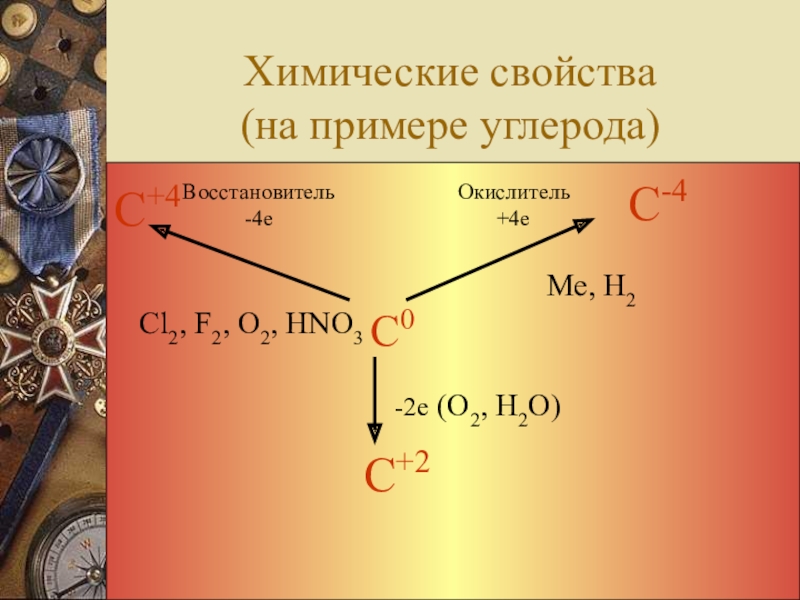
- 22. Химические свойства (на примере углерода)С+4С0С-4С+2Восстановитель-4еОкислитель+4е-2е (О2, Н2О)Cl2, F2, O2, HNO3 Me, H2
- 23. Химические свойстваВ реакциях с активными неметаллами углерод
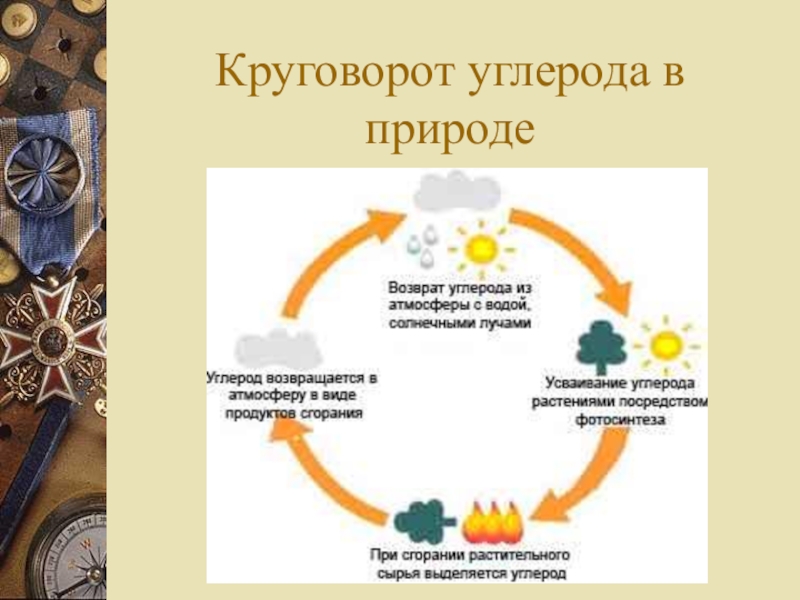
- 24. Круговорот углерода в природе
- 25. Тест1. Конфигурация внешнего электронного уровня элементов подгруппы
- 26. ПРОВЕРЬ ПОЛУЧЕННЫЕ ЗНАНИЯОтветы к тесту 1.а; 2.в; 3.а; 4.б; 5.в; 6.а; 7.в
Слайд 1«Общая характеристика элементов IV А группы. Углерод как простое вещество».
Учитель Лизина
Атемарская СОШ
Слайд 2План урока
Общая характеристика элементов IVА группы.
Изменение свойств в группе
Соединения, образованные этими
Углерод в природе
Аллотропные модификации
Химические свойства углерода
Адсорбция
Применение
Круговорот углерода в природе.
Слайд 3
Строение атомов
Общая электронная формула внешнего слоя
S2 P2
+6С
+14Si )2)8)4
+32Ge )2)8)18)4
+50Sn )2)8)18)18)4
+82Pb )2)8)18)32)18)4
Р - элементы
Слайд 5
Окислительные и восстановительные свойства:
Эл0 + 4е → Эл-4 окислитель
степень окисления -4,0,+2,+4
В группе окислительные свойства уменьшаются ↓
Слайд 6
Соединения, образованные этими элементами
ЭлО2
Кислотный
Оксид
СО2
SiO2
GeO2
SnO2
PbO2
Кислотные
свойства
ослабевают
Н2ЭлО3
Кислота
Н2СО3
Н2SiO3
●
●
Н2PbO3
Слайд 7УГЛЕРОД В ПРИРОДЕ
Углерод в природе встречается в виде алмаза и графита.
MgCO3 - магнезит. В воздухе углерод содержится в виде углекислого газа (0.03 % по объему). Содержится углерод и в соединениях, растворенных в морской воде. Углерод входит в состав растений и животных, содержится в нефти и природном газе.
Слайд 9А Л М А З
Алмаз-бесцветное,прозрачное вещество с сильной лучепреломляемостью.
Его плотность 3,5г/cм3
Алмаз-самое
Слайд 10А Л М А З
Кристаллы алмаза бывают синего, голубого, красного,черного цветов.
Окраска
Слайд 11А Л М А З
Алмаз-»царь камней»
Ограненные прозрачные алмазы называются бриллиантами
Скипетр Императорский
Алмаз «Шах»
Слайд 12А Л М А З
Применение алмазов:
камни ювелиров
«алмазный инструмент»:
резцы
буры
шлифовальные круги
сверла
напильники
Слайд 13Г Р А Ф И Т
Вещество серо-стального цвета
Мягок и жирен на
Его плотность 2,3 г/см3
Хороший проводник электричества
Самое тугоплавкое вещество на Земле
Химически инертен
Слайд 14Г Р А Ф И Т
Применение графита:
Электроды для электролиза
Облицовка сопел
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Стержни для карандашей
Замедлители нейтронов в ядерных реакторах
Слайд 15Г Р А Ф И Т
Сходное с графитом строение имеют:
картриджи
резина
косметическая тушь
типографская
Сажа
Древесный уголь
Кокс
адсорбент для очистки газов и жидкостей
твердое топливо
восстановитель при выплавке чугуна из руд
Слайд 16П О Ч Е М У
А Л М А З -
Г Р А Ф И Т – очень мягкий ?
Кристаллическая решетка алмаза
Кристаллическая решетка графита
Слайд 17А Л М А З
Алмаз имеет атомную кристаллическую решетку, в
Слайд 18Г Р А Ф И Т
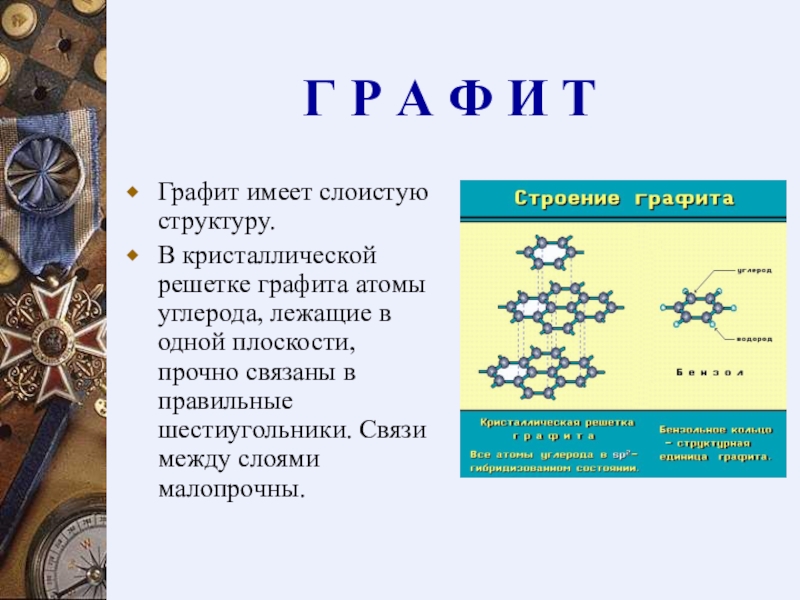
Графит имеет слоистую структуру.
В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны.
Слайд 19Как доказать, что алмаз и графит состоят из одного элемента –
Из алмаза можно получить графит, а из графита при высокой температуре и высоком давлении получают искусственные алмазы.
При горении алмаза и графита образуется только углекислый газ: С+О2=СО2
Слайд 20К А Р Б И Н
Самая термодинамически устойчивая форма элементного
Атомы углерода образуют цепочки двух видов:
=С=С=С=С=С=С= или
-С≡С-С ≡С-С ≡С-
Карбин имеет среднюю твердость
Слайд 21Ф У Л Л Е Р Е Н Ы
Состоят из молекул
Фуллерены темно - красного цвета
С60 имеет структуру полого усеченного икосаэдра, построенного из 20 шестиугольников и 12 пятиугольников.
Слайд 22
Химические свойства
(на примере углерода)
С+4
С0
С-4
С+2
Восстановитель
-4е
Окислитель
+4е
-2е (О2, Н2О)
Cl2, F2, O2, HNO3
Me, H2
Слайд 23Химические свойства
В реакциях с активными неметаллами углерод легко окисляется:
C+O2=CO2
2C+O2=2CO
C+2S=CS2
C+2F2=CF4
Углерод может проявлять
C+2CuO=Cu+CО2
C+2H2SO4(конц.)=CO2+2SO2+H2O
2C+BaSO4=BaS+2CO2
В реакциях с металлами и менее активными неметаллами углерод -
окислитель:
2C+H2=C2H2
C+Si=SiC
2C+Ca=CaC2
3C+4Al=Al4C3
Слайд 25Тест
1. Конфигурация внешнего электронного уровня элементов подгруппы углерода:
а) ns2np2
б) ns2np3
в) ns2np4
г) ns1np2
2. Наиболее характерная валентность элементов подгруппы углерода:
а) II
б) III
в) IV
г) V
3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз:
а) уменьшаются
б) уменьшаются, затем возрастают
в) возрастают
г) не изменяются
4. Углерод является:
а) восстановителем
б) восстановителем и окислителем
в) окислителем
г) не проявляет окислительно-восстановительных свойств
5. Атомную слоистую кристаллическую решетку имеет:
а) алмаз
б) фуллерен
в) графит
г) карбин
6. Наибольшей прочностью отличается кристаллическая решетка:
а) атомная
б) ионная
в) атомная слоистая
г) молекулярная
7. Наиболее химически активна аллотропная модификация углерода:
а) алмаз
б) фуллерен
в) графит
г) карбин