Ростовской области
Гречко З.П.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Реакции ионного обмена 8 класс
Содержание
- 1. Презентация к уроку химии Реакции ионного обмена 8 класс
- 2. «Скажи мне, и я забуду;
- 3. Цель урока.Получить представление о применении реакций ионного обмена в профессиональной деятельности и в повседневной жизни.
- 4. Девиз урока: «Что пользы в том,
- 5. Повторяем термины.-электролитическая диссоциация- катионы- анионы- кислоты- основания- соли- реакция обмена- условия необратимости реакций ионного обмена
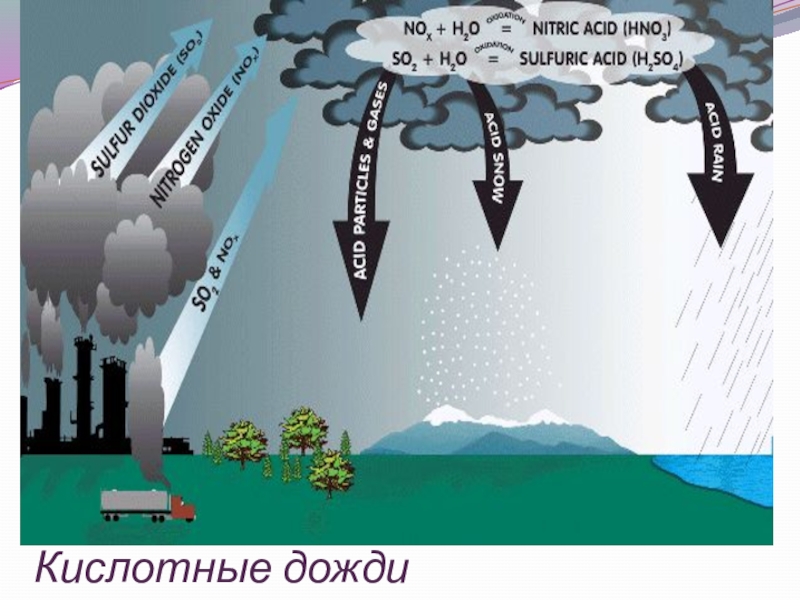
- 6. Кислотные дожди
- 7. Источники кислотных дождей:
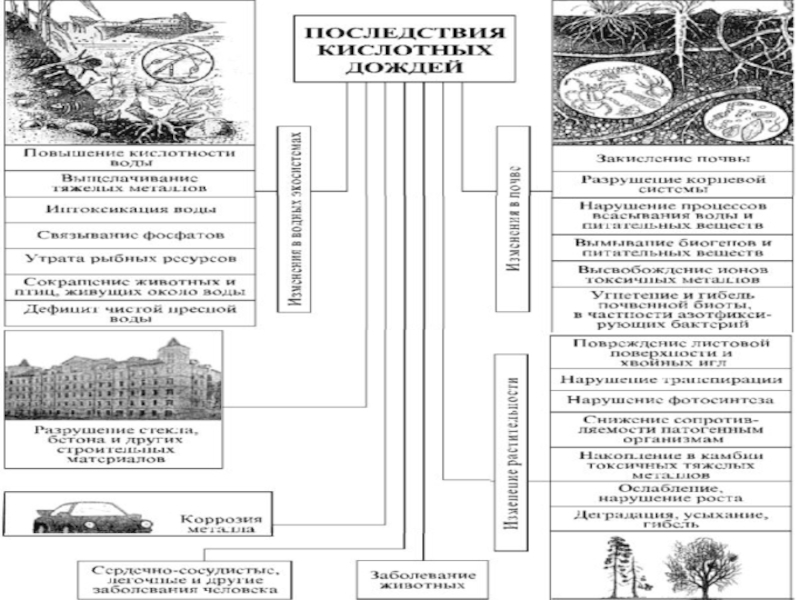
- 8. Слайд 8
- 9. Задачи урока.Образовательная: изучить особенности реакций ионного обмена
- 10. Решить задачу:Вы – директор предприятия. Экспертами-экологами обнаружены
- 11. Известняк, мел, мрамор, туф, содержащие карбонат кальция,
- 12. Слайд 12
- 13. Задание:При повышении кислотности воды в ней быстро
- 14. Задание:Известкование -защита от кислотных дождей.Составьте полное и
- 15. СвинецТоксическое действие свинца.Постоянное поступление свинца в организм
- 16. Слайд 16
- 17. Ртуть.Ртуть оказывает токсическое действие на человека, теплокровных
- 18. Слайд 18
- 19. Кадмий.Токсическое действие кадмияВ организме человека кадмий накапливается
- 20. Слайд 20
- 21. Задача. Предложите ионные реакции для очистки сточных
- 22. Задача. В сточных водах животноводческих ферм отмечено
- 23. Задачи.В сточных водах гальванического цеха химического завода
- 24. Снижение токсического действия ионов металлов
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Железо. Играет важную роль в жизни практически
- 29. Слайд 29
- 30. Серебро.Ионы серебра выступают в роли защитников, уничтожая
- 31. Слайд 31
- 32. Единственный путь, ведущий к знанию- деятельность.
- 33. Спасибо за внимание!
«Скажи мне, и я забуду; Покажи мне, и я , может быть запомню, Вовлеки меня, и я пойму…» Конфуций
Слайд 2 «Скажи мне, и я забуду; Покажи мне, и я , может
быть запомню,
Вовлеки меня, и я пойму…»
Конфуций
450 г до н.э.
Слайд 3Цель урока.
Получить представление о применении реакций ионного обмена в профессиональной деятельности
и в повседневной жизни.
Слайд 4Девиз урока: «Что пользы в том, что ты много знал, раз ты не
умел применять твои знания к твоим нуждам»
Ф. Петрарка
Слайд 5Повторяем термины.
-электролитическая диссоциация
- катионы
- анионы
- кислоты
- основания
- соли
- реакция обмена
- условия
необратимости реакций ионного обмена
Слайд 9Задачи урока.
Образовательная: изучить особенности реакций ионного обмена на примере качественных реакций
на ионы; развивать умения записывать уравнения реакции в молекулярной и ионной формах, расширить представления о роли реакций ионного обмена в природе и жизни человека.
Развивающая: развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
Воспитательная: продолжить формирование представлений о взаимосвязи живой и неживой природы. воспитывать трудолюбие, культуру речи и общения, самостоятельность в выборе решения проблемы, воспитывать экологическую культуру, бережное отношение к природе и своему здоровью.
Развивающая: развивать логическое мышление, память, внимание, умение сравнивать и анализировать, умение применять полученные знания и навыки при выполнении практических упражнений.
Воспитательная: продолжить формирование представлений о взаимосвязи живой и неживой природы. воспитывать трудолюбие, культуру речи и общения, самостоятельность в выборе решения проблемы, воспитывать экологическую культуру, бережное отношение к природе и своему здоровью.
Слайд 10Решить задачу:
Вы – директор предприятия. Экспертами-экологами обнаружены отклонения от нормы состава
воды из близлежащего озера и установлена причина: большие выбросы SO2 вашим предприятием. Что вы предпримете?
– Закроете предприятие.
– Усовершенствуете очистные сооружения.
– Займетесь очисткой воды в озере.
Обоснуйте выбранный вами вариант.
– Закроете предприятие.
– Усовершенствуете очистные сооружения.
– Займетесь очисткой воды в озере.
Обоснуйте выбранный вами вариант.
Слайд 11Известняк, мел, мрамор, туф, содержащие карбонат кальция, разрушаются под действием кислотных
дождей:
СаСО3 + Н2SО4 =Са2+ + SO42–+ СО2 + Н2О,
СаСО3 + 2HNO3 =Са2+ + 2NО3– + СО2+Н2О.
СаСО3 + Н2SО4 =Са2+ + SO42–+ СО2 + Н2О,
СаСО3 + 2HNO3 =Са2+ + 2NО3– + СО2+Н2О.
Слайд 13Задание:
При повышении кислотности воды в ней быстро нарастает содержание алюминия за
счет взаимодействия:
Аl(ОН)3 + 3H+ = Al3+ + 3Н2О.
Составьте молекулярное и полное ионное уравнения этой реакции.
Аl(ОН)3 + 3H+ = Al3+ + 3Н2О.
Составьте молекулярное и полное ионное уравнения этой реакции.
Слайд 14Задание:
Известкование -защита от кислотных дождей.
Составьте полное и сокращенное ионное уравнения реакций
1), 4).
1)МgСО3 + Н2SО3 = МgSО3 + СО2 + Н2О,
2)СаСО3+ Н2SО3 = СаSО3 + СО2 + Н2О,
3)МgСО3 + 2НNО3 = + Мg(NО3)2 +СО2 + Н2О.
4)СаСО3 + 2НNО3 = Са(NО3)2 + СО2 + Н2О.
1)МgСО3 + Н2SО3 = МgSО3 + СО2 + Н2О,
2)СаСО3+ Н2SО3 = СаSО3 + СО2 + Н2О,
3)МgСО3 + 2НNО3 = + Мg(NО3)2 +СО2 + Н2О.
4)СаСО3 + 2НNО3 = Са(NО3)2 + СО2 + Н2О.
Слайд 15Свинец
Токсическое действие свинца.
Постоянное поступление свинца в организм вызывает его острое отравление.
Характерный признак отравления - появление каймы по краю десен, землянисто – бледная окраска кожных покровов, усталость, тошнота, рвота, боли в животе, повышение кровяного давления.
Источники загрязнения.
Промышленные и бытовые сточные воды, выбросы автотранспорта производство фотоматериалов, спичек. красок, аккумуляторов.
Источники загрязнения.
Промышленные и бытовые сточные воды, выбросы автотранспорта производство фотоматериалов, спичек. красок, аккумуляторов.
Слайд 17Ртуть.
Ртуть оказывает токсическое действие на человека, теплокровных животных, птиц, рыб, гидробионтов.
При отравлении ртутью появляются симптомы: расстройство речи, ухудшение слуха, потеря памяти и усталость, нарушение координации движений, ЦНС.
Источники загрязнения
Сжигание топлива, металлургические процессы, потери ртути на предприятиях по производству хлора и каустической соды, сжигание мусора, сточные воды, коксование угля.
Слайд 19Кадмий.
Токсическое действие кадмия
В организме человека кадмий накапливается в почках, при его
избытке развивается болезнь «итай-итай». Это искривление и деформация костей, сопровождающиеся сильными болями, необычайная хрупкость и ломкость костей. Кадмий повышает кровяное давление и обладает канцерогенными свойствами.
Источники кадмия- сточные воды, активное и пассивное курение.
Источники кадмия- сточные воды, активное и пассивное курение.
Слайд 21Задача.
Предложите ионные реакции для очистки сточных вод автотранспортного предприятия от
катионов Pb2+ и Cu2+, оказывающих токсическое действие на живые организмы.
Напишите сокращенные ионные уравнения.
Напишите сокращенные ионные уравнения.
Слайд 22Задача.
В сточных водах животноводческих ферм отмечено повышенное содержание катионов Ca2+
и Zn2+.
Предложите реактивы, с помощью которых можно очистить воду от этих ионов.
Напишите сокращенные ионные уравнения.
Предложите реактивы, с помощью которых можно очистить воду от этих ионов.
Напишите сокращенные ионные уравнения.
Слайд 23Задачи.
В сточных водах гальванического цеха химического завода обнаружены катионы Fe3+, Fe2+,
Ni2+ и анионы Cl-, SO42-.
Как с помощью реакций ионного обмена можно очистить эти стоки?
Поработайте в парах над решением подобных задач:
Как с помощью реакций ионного обмена можно очистить эти стоки?
Поработайте в парах над решением подобных задач:
Слайд 28Железо.
Играет важную роль в жизни практически всех организмов, за исключением
некоторых бактерий.
Входит в состав множества ферментов и белков, участвующих в окислительно-восстановительных реакциях, главным образом в процессе дыхания.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма.
Входит в состав множества ферментов и белков, участвующих в окислительно-восстановительных реакциях, главным образом в процессе дыхания.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма.
Слайд 30Серебро.
Ионы серебра выступают в роли защитников, уничтожая болезнетворные бактерии, вирусы, грибки.
Их действие распространяется более чем на 650 видов бактерий
При употреблении ионных растворов серебра активизируются обменные процессы в организме человека, повышается иммунитет.
Наиболее богаты серебром мозг, железы внутренней секреции, печень, почки и кости скелета.
Длительное применение больших доз серебра – концентрацией раствора 30 – 50 мг/л в течение 7-8 лет может привести к отложению серебра в коже и изменению окраски кожи – аргирии.
При употреблении ионных растворов серебра активизируются обменные процессы в организме человека, повышается иммунитет.
Наиболее богаты серебром мозг, железы внутренней секреции, печень, почки и кости скелета.
Длительное применение больших доз серебра – концентрацией раствора 30 – 50 мг/л в течение 7-8 лет может привести к отложению серебра в коже и изменению окраски кожи – аргирии.