- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии по теме Щелочные металлы
Содержание
- 1. Презентация к уроку химии по теме Щелочные металлы
- 2. Строение атома Физические свойства Химические свойства
- 3. ПАСПОРТ ЭЛЕМЕНТА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
- 4. Слайд 4
- 5. Место жительства1. Период -
- 6. Место жительства1. Период - 1
- 7. Металлические свойства -Соседи по подгруппе
- 8. Слайд 8
- 9. Родился в Англии. Изучал действие тока на
- 10. Физические свойства1. Общие со всеми металлами:
- 11. Na0 -
- 12. 2. Взаимодействие с хлором: (Д.З.) 3. Взаимодействие с серой: (Д.З.)Взаимоотношения с другими веществами
- 13. 4. Взаимодействие с водой: Na +
- 14. ρ (Н20)=1г/см3ρ (Na)=0,97г/см3+Q
- 15. Физические свойства1. Общие со всеми металлами:
- 16. 4. Взаимодействие с водой:
- 17. Ближайшие родственники и их характер1) Высший оксид -2) Высший гидроксид -Na2OосновныйNaOH(основание)щелочь
- 18. Песенка (на мотив песни «Замечательный сосед»)Мы
- 19. Реагируют активно, С тем что попадается,
- 20. Что ж, знакомство состоялось, Прозвенит сейчас звонок,
Слайд 2 Строение атома
Физические свойства
Химические свойства
Применение
Соединения
Щелочные металлы
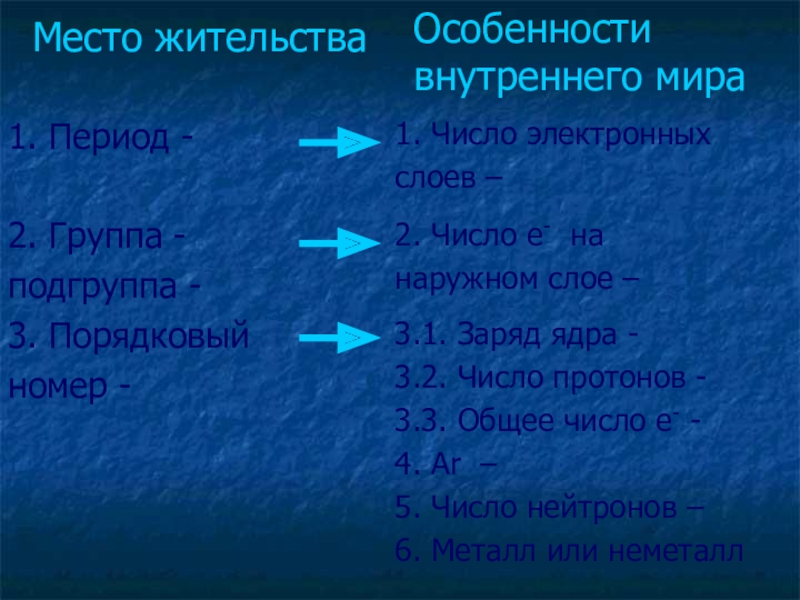
Слайд 5Место жительства
1. Период -
2. Группа -
подгруппа -
3. Порядковый
номер -
1. Число электронных
слоев –
2. Число e- на
наружном слое –
3.1. Заряд ядра -
3.2. Число протонов -
3.3. Общее число e- -
4. Ar –
5. Число нейтронов –
6. Металл или неметалл
Особенности внутреннего мира
Слайд 6Место жительства
1. Период - 1
2. Группа - I
подгруппа - главная
3. Порядковый
номер - 11
1. Число электронных
слоев – 1
2. Число e- на
наружном слое – 1
3.1. Заряд ядра - +11
3.2. Число протонов - 11
3.3. Общее число e- - 11
4. Ar – 23
5. Число нейтронов – 23-11 =12
6. Металл
Особенности внутреннего мира
Слайд 7Металлические свойства -
Соседи по подгруппе
1. Число электронов на внешнем слое
2. Степени окисления –
3. Химическая связь в соединениях –
4. Сравнение свойств соседей
Li
Na
K
Rb
Cs
Fr
щелочных металлов
1
0;
ионная
увеличивается
увеличиваются
увеличиваются
+1
Радиус атома -
Металлические свойства -
Восстановительные свойства -
Радиус атома -
Металлические свойства -
Радиус атома -
Радиус атома -
Металлические свойства
Радиус атома -
Металлические свойства
Металлические свойства -
Радиус атома -
Слайд 8
1. Название –
натрий
2. Нахождение в природе –
в солях
3. Открытие –
Г.Деви, 1807г.
4. Получение –
электролиз (восстановление электричес- ким током) расплавов солей, щелочей
NaCl NaOH
Слайд 9Родился в Англии. Изучал действие тока на вещества, в том числе
К, Na, Ba, Ca, Mg и Sr.
Дэви был удостоен титула лорда за научные заслуги.
С 1820 года стал президентом Лондонского Королевского общества – английской академии наук.
Гемфри Дэви
(1778-1829)
Слайд 10Физические свойства
1. Общие со всеми металлами:
1. Электропроводность
3. Металлический блеск
2. Особые свойства щелочных металлов:
Слайд 11 Na0 - 1ē => Na +1
1. Взаимодействие с кислородом:
+1 -1
а) Na + O2 => Na2O2 (пероксид натрия)
б)
Свойства
+1 -2
Li0 + O20 => Li2O
Li0 - 1ē => Li +1 (ок-ся, ок-е, в-ль) │ 4
O20 + 2ē*2 => 2O-2 (в-ся, в-е, ок-ль)│ 1
4Li + O2 = 2Li2O
Проверь
себя!
Слайд 12
2. Взаимодействие с хлором: (Д.З.)
3. Взаимодействие с серой: (Д.З.)
Взаимоотношения
Слайд 134. Взаимодействие с водой:
Na + H2O =
5. Взаимодействие с концентрированными
кислотами:
Na + HCl =
ВЫВОД:в химических реакциях щелочные
металлы выступают в качестве сильных …………………………………………..
Слайд 15Физические свойства
1. Общие со всеми металлами:
1. Электропроводность
3. Металлический блеск
2. Особые свойства щелочных металлов:
1. Мягкость
2. Легкость
3. Легкопавкость
Слайд 164. Взаимодействие с водой:
+1 -2
Na0 + H2O => NaOH + H2 0
Na0 - 1ē => Na+1 (ок-ся, ок-е, в-ль) │ 2
2H+1 + 1ē*2 => H2 (в-ся, в-е, ок-ль) │ 1
-----------------------------------------------------------------------
2Na + 2H2O = 2NaOH + H2
5. Взаимодействие с концентрированными кислотами:
Na + HCl = NaCl + H2 (Д.З.)
ВЫВОД: в химических реакциях щелочные металлы выступают в качестве сильных
восстановителей.
Слайд 17Ближайшие родственники
и их характер
1) Высший оксид -
2) Высший гидроксид -
Na2O
основный
NaOH
(основание)
щелочь
Слайд 18Песенка
(на мотив песни «Замечательный сосед»)
Мы металлы изучаем,
Нам их все
Но средь них 6 самых-самых
На Земле в активе есть:
Na, K, Cs, Li
и Rb с Fr – ем,
В первой группе их ищите,
Ну, а знать их надо всем!
Слайд 19Реагируют активно,
С тем что попадается,
Потому в свободном виде
Щелочами гидроксиды
Их зовутся в химии,
Могут вызывать ожоги,
Осторожней с ними вы!
Слайд 20Что ж, знакомство состоялось,
Прозвенит сейчас звонок,
Я надеюсь вам,
Мой понравился урок.
Я успехов вам желаю,
За урок благодарю
И на память, на прощанье
Эту песенку дарю.