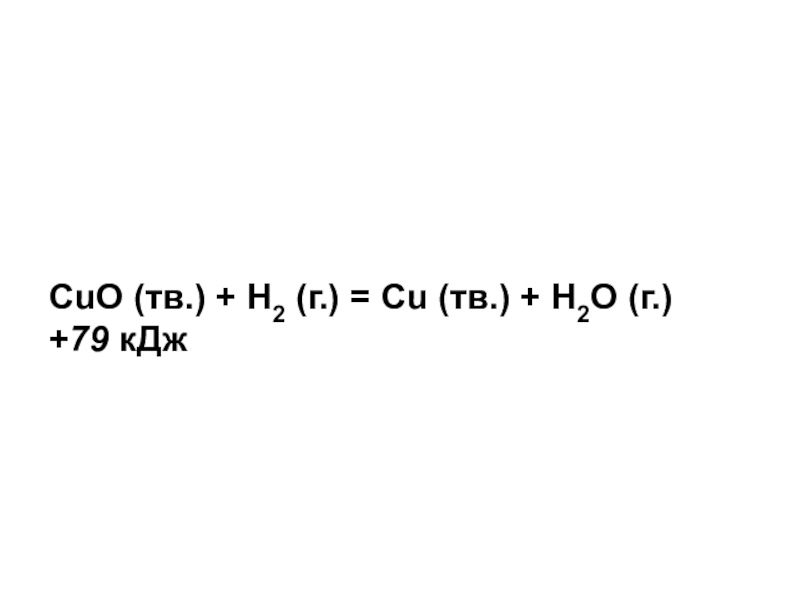- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии Обобщение по теме Химические реакции
Содержание
- 1. Презентация к уроку химии Обобщение по теме Химические реакции
- 2. Классификация реакций Скорость химической реакции Химическое равновесие Гидролиз Электролиз
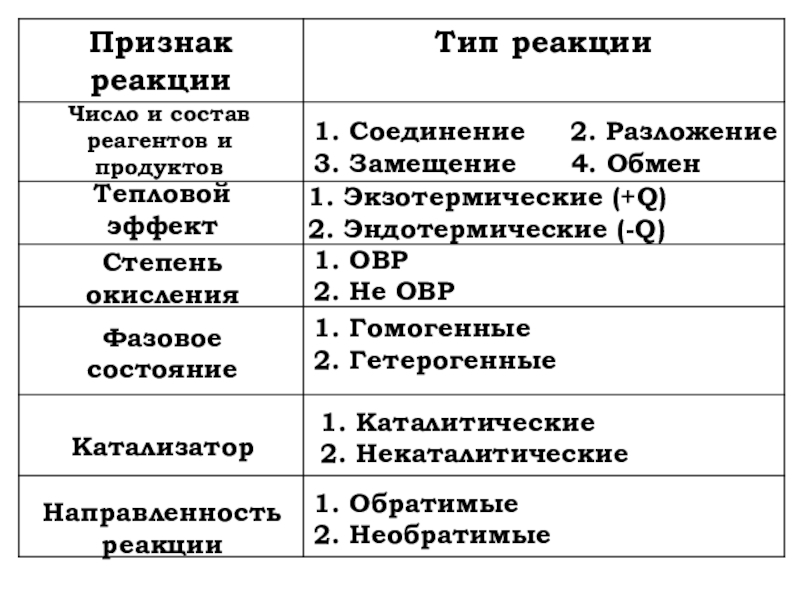
- 3. Классификация химических реакций
- 4. Число и состав реагентов и продуктов1. Соединение
- 5. CuO (тв.) + H2 (г.) = Cu (тв.) + H2O (г.) +79 кДж
- 6. Число и состав реагентов и продуктовТепловойэффектCтепеньокисленияФазовое состояниеКатализатор Направленностьреакции
- 7. Реакция Замещения Экзотермическая ОВР Гетерогенная Некаталитическая Необратимая6Б максимум
- 8. Скорость химических реакций
- 9. Скорость реакции зависит от:1. Природы реагирующих
- 10. Обратимость химических реакцийХимическое равновесие
- 11. Химическое равновесие смещают: концентрация (г,ж) температура давление
- 12. Как сместить равновесие вправо: Fe2O3(тв) +3H2(г)
- 13. Какие факторы смещают влево равновесие процесса2CO(г) +
- 14. Гидролиз солей
- 15. Рассмотрите гидролиз солей (если он возможен):1.Ca(NO3)2
- 16. В водных растворах, каких солей лакмус красный:а) NH4NO3б) Na3PO4в) AlBr3г) K2SO4
- 17. Электролиз
- 18. Установите соответствие между формулой вещества и продуктом,
Классификация реакций Скорость химической реакции Химическое равновесие Гидролиз Электролиз
Слайд 4Число и состав реагентов и
продуктов
1. Соединение 2. Разложение
3.
Замещение 4. Обмен
Тепловой
эффект
1. Экзотермические (+Q)
2. Эндотермические (-Q)
Cтепень
окисления
1. ОВР
2. Не ОВР
1. Гомогенные
2. Гетерогенные
1. Каталитические
2. Некаталитические
Фазовое состояние
Катализатор
Направленность
реакции
1. Обратимые
2. Необратимые
Слайд 6Число и состав реагентов и
продуктов
Тепловой
эффект
Cтепень
окисления
Фазовое состояние
Катализатор
Направленность
реакции
Слайд 9 Скорость реакции зависит от:
1. Природы реагирующих веществ
2. Концентрации реагирующих веществ
3.
Катализатора
4. Поверхности соприкосновения веществ
5. Температура (правило Вант-Гоффа)
4. Поверхности соприкосновения веществ
5. Температура (правило Вант-Гоффа)
Слайд 12 Как сместить равновесие вправо:
Fe2O3(тв) +3H2(г) ↔ 2Fe(тв) + 3H2O(г)
- Q
1. Увеличить концентрацию H2
3. Увеличить температуру
4. Добавить катализатор
2. Увеличить давление
Слайд 13Какие факторы смещают влево равновесие процесса
2CO(г) + O2(г)↔ 2CO2(г)+Q :
а) Увеличение
концентрации СO2
б) Уменьшение концентрации СO2
в) Увеличение давления
г) Уменьшение давления
д) Понижение температуры
е) Повышение температуры
ж) Изменение природы катализатора
б) Уменьшение концентрации СO2
в) Увеличение давления
г) Уменьшение давления
д) Понижение температуры
е) Повышение температуры
ж) Изменение природы катализатора
Слайд 15 Рассмотрите гидролиз солей (если он возможен):
1.Ca(NO3)2 2.Na2S 3.CrCI3
1.Гидролизу
не подвергается
2. Гидролиз по аниону:
Na2S + H2O ↔ NaHS + NaOH
3. Гидролиз по катиону:
CrCI3 + H2O ↔ CrOHCI2 + HCI
2. Гидролиз по аниону:
Na2S + H2O ↔ NaHS + NaOH
3. Гидролиз по катиону:
CrCI3 + H2O ↔ CrOHCI2 + HCI
Слайд 18Установите соответствие между формулой вещества и продуктом, который образуется на инертном
аноде в результате электролиза водного раствора этого вещества