- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии на тему Химическая связь (8 класс)
Содержание
- 1. Презентация к уроку химии на тему Химическая связь (8 класс)
- 2. на основании знаний о строении атомов
- 3. ЧТО НАДО ВСПОМНИТЬВ чем особенности строения атомов
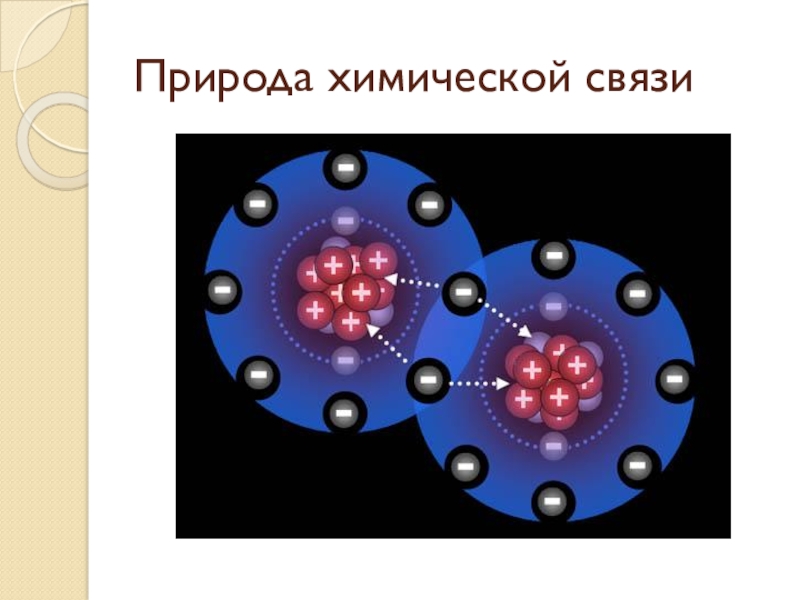
- 4. Природа химической связи
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
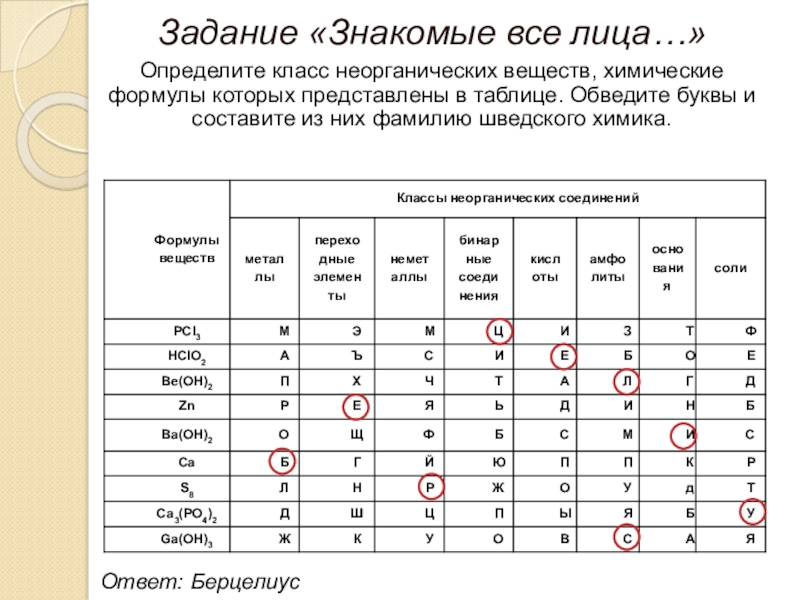
- 14. Задание «Знакомые все лица…»Определите класс неорганических веществ,
- 15. Слайд 15
- 16. Энергия химической связи – количество теплоты, поглощаемое
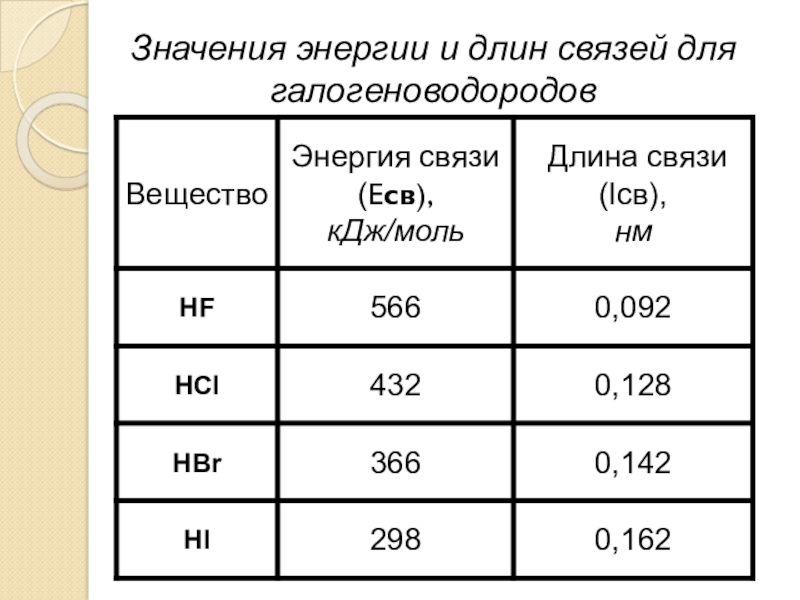
- 17. Значения энергии и длин связей для галогеноводородов
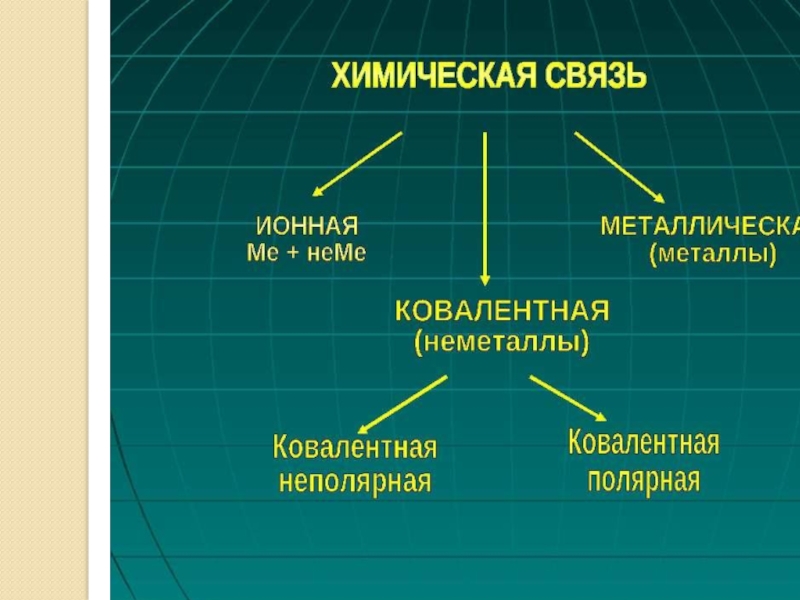
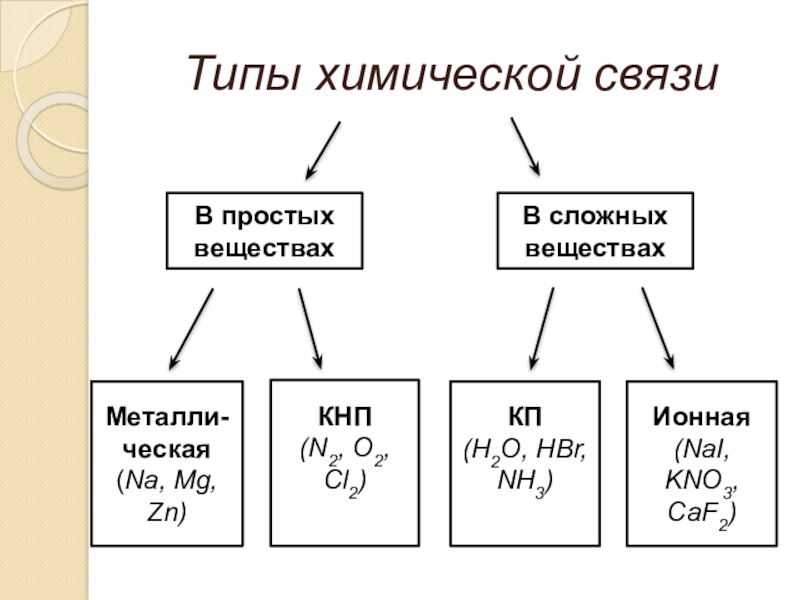
- 18. Типы химической связиВ простых веществахВ сложных веществахМеталли-ческая(Na, Mg, Zn)КНП(N2, O2, Cl2)КП(H2O, HBr, NH3)Ионная(NaI, KNO3, СaF2)
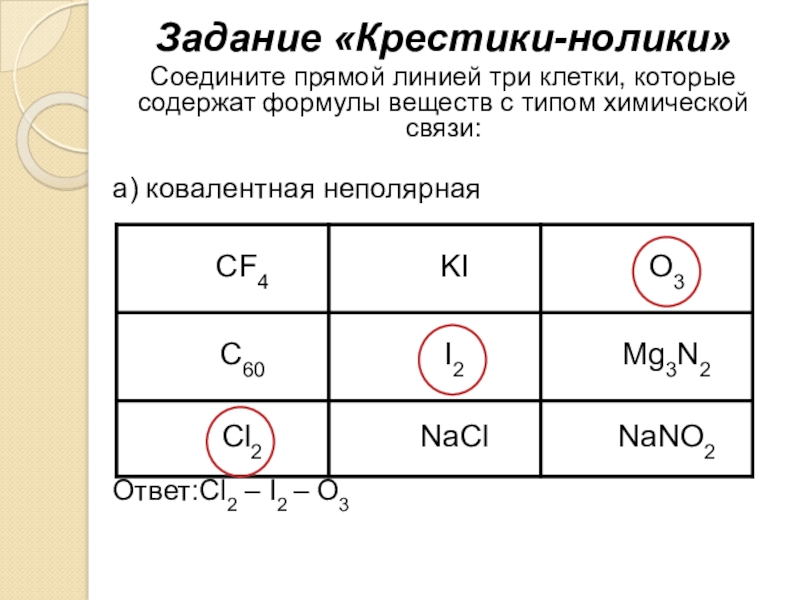
- 19. Задание «Крестики-нолики»Соедините прямой линией три клетки, которые
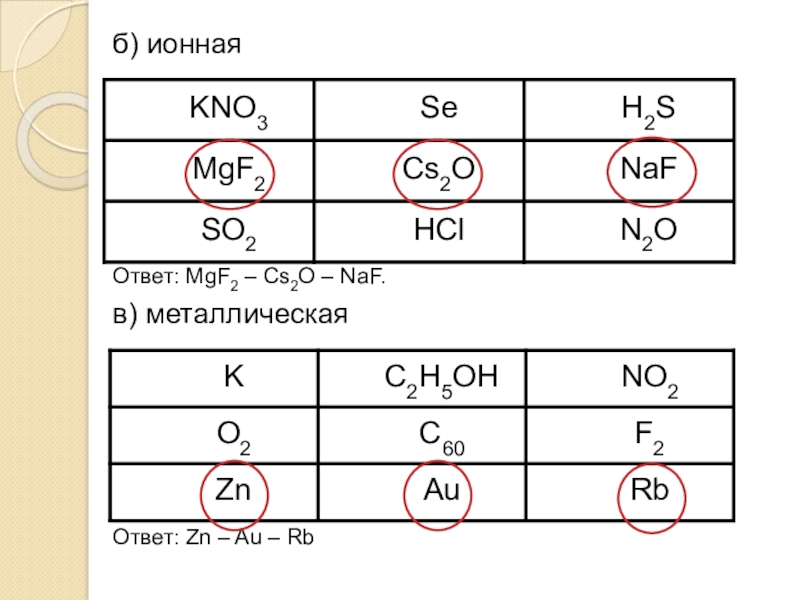
- 20. б) ионнаяОтвет: MgF2 – Cs2O – NaF.в) металлическаяОтвет: Zn – Au – Rb
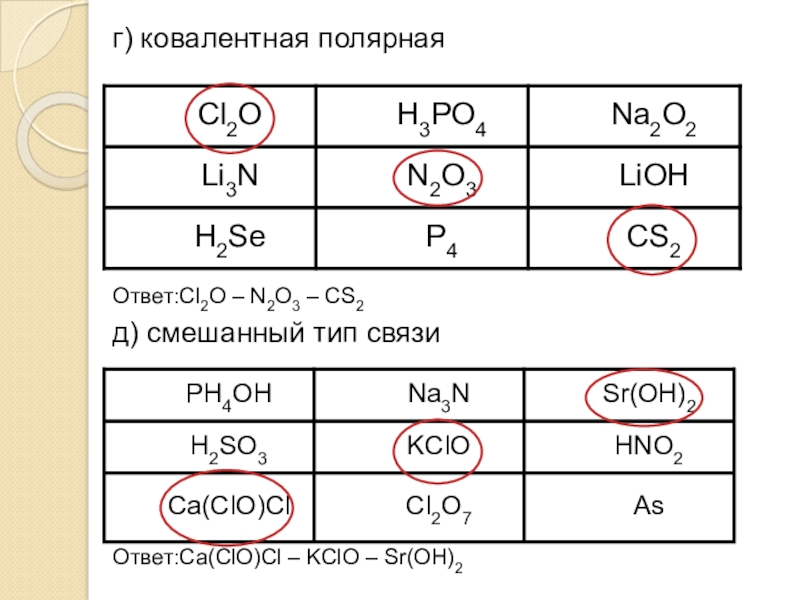
- 21. г) ковалентная полярнаяОтвет:Cl2O – N2O3 – CS2 д) смешанный тип связиОтвет:Ca(ClO)Cl – KClO – Sr(OH)2
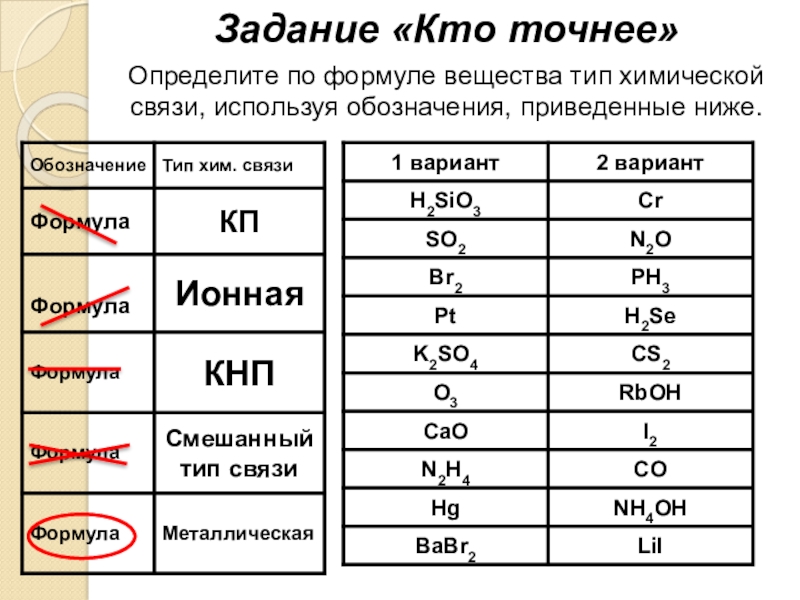
- 22. Задание «Кто точнее»Определите по формуле вещества тип химической связи, используя обозначения, приведенные ниже.
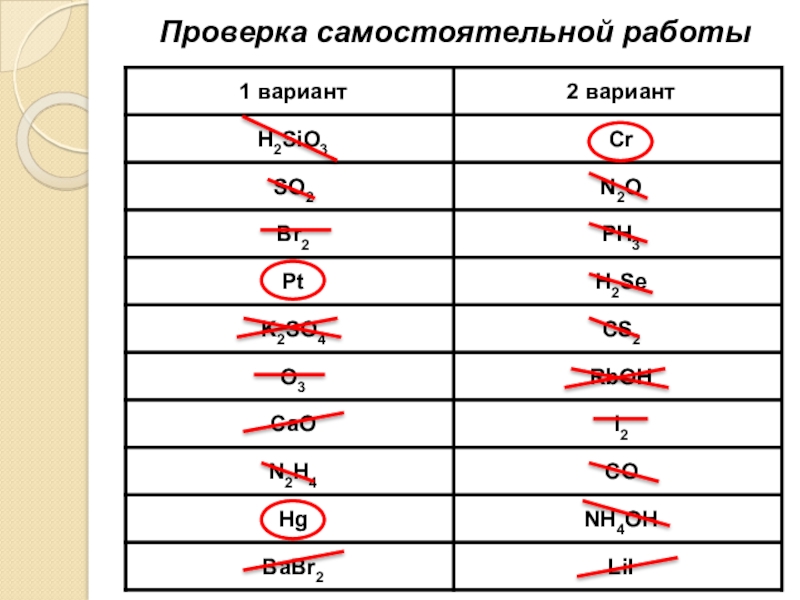
- 23. Проверка самостоятельной работы
- 24. Кроссворд П Е Р Е
Слайд 1Химическая связь.
Виды химической связи
От берега до берега
Можно сделать мост.
Соединить два
В молекулу – вопрос…
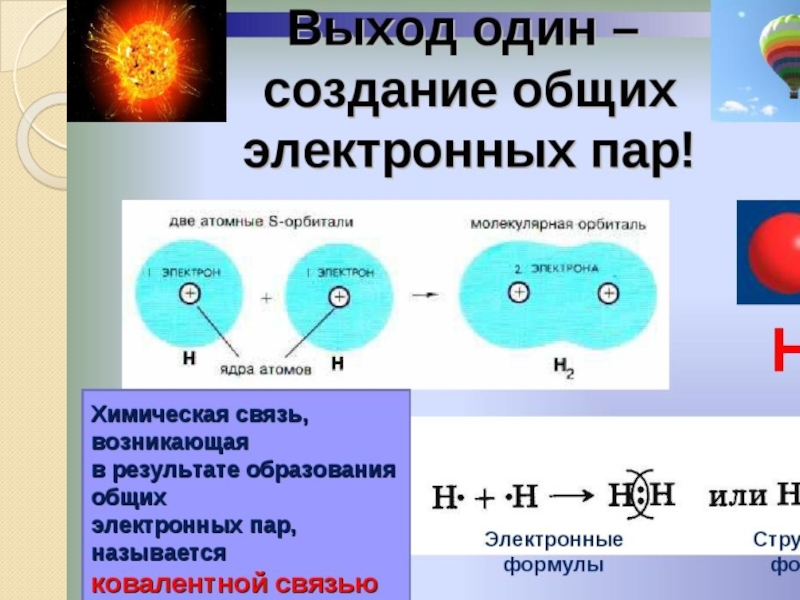
Слайд 2
на основании знаний о строении атомов разобраться, что и как
познакомиться с различными видами химической связи;
Задачи урока:
Слайд 3ЧТО НАДО ВСПОМНИТЬ
В чем особенности строения атомов металлов, неметаллов и инертных
Что собой представляют завершенные и незавершенные слои?
Сколько электронов на внешнем слое атомов элементов главных подгрупп?
Как по положению элемента в ПСХЭ определить число парных и непарных электронов на внешнем слое? Возможности распаривания.
Слайд 14Задание «Знакомые все лица…»
Определите класс неорганических веществ, химические формулы которых представлены
Ответ: Берцелиус
Слайд 16Энергия химической связи – количество теплоты, поглощаемое при разрыве ковалентной связи
Длина химической связи – расстояние между ядрами связываемых атомных частиц одного химического элемента или разных элементов (единицы – нанометр (нм), пикометр (пм)).
Слайд 18Типы химической связи
В простых веществах
В сложных веществах
Металли-
ческая
(Na, Mg, Zn)
КНП
(N2, O2, Cl2)
КП
(H2O,
Ионная
(NaI, KNO3, СaF2)
Слайд 19Задание «Крестики-нолики»
Соедините прямой линией три клетки, которые содержат формулы веществ с
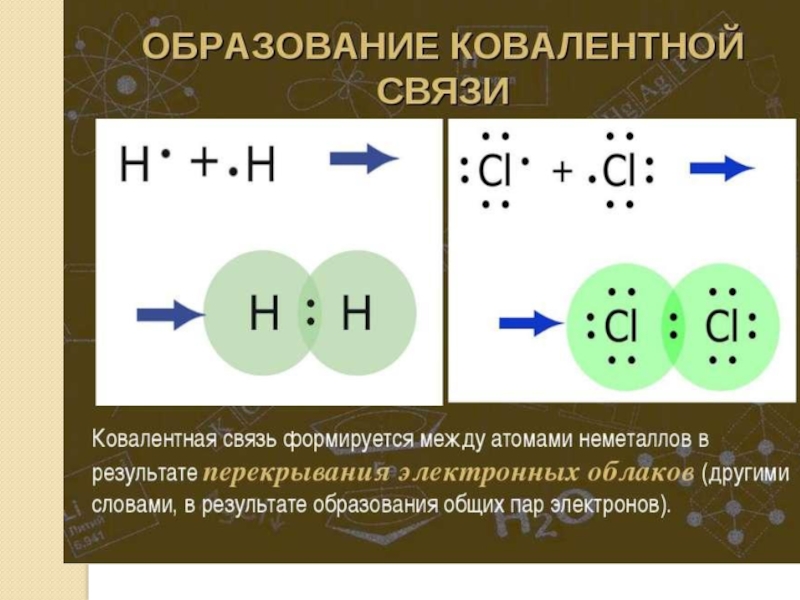
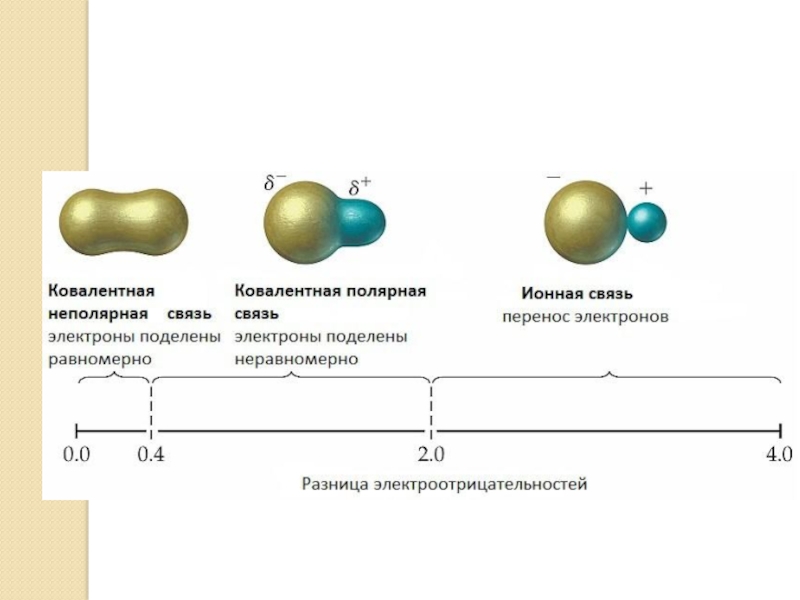
а) ковалентная неполярная
Ответ:Cl2 – I2 – O3
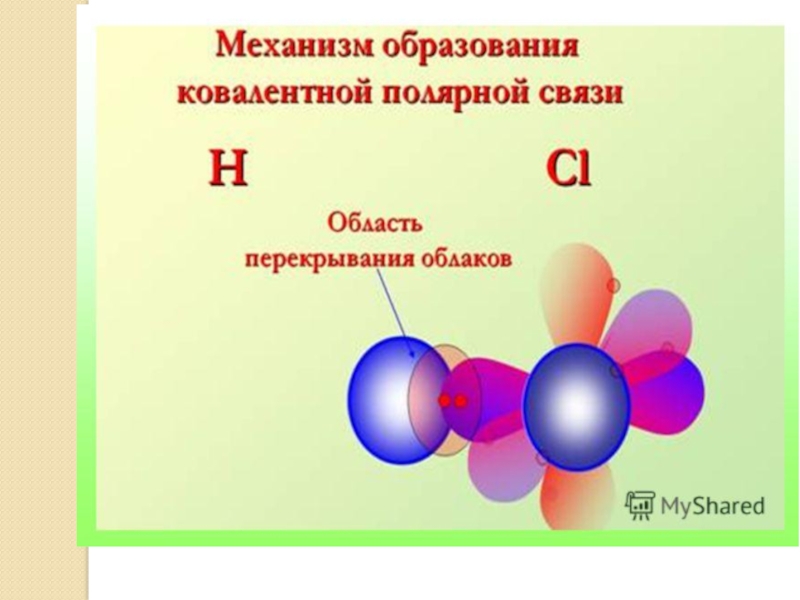
Слайд 21г) ковалентная полярная
Ответ:Cl2O – N2O3 – CS2
д) смешанный тип связи
Ответ:Ca(ClO)Cl
Слайд 22Задание «Кто точнее»
Определите по формуле вещества тип химической связи, используя обозначения,
Слайд 24Кроссворд
П Е Р Е С Т Р
О
Л
Я
Р
Н
А
Я
Э
Н
Е
Г
И
Я
М
Е
Т
А
Л
Л
И
Ч
Е
К
А
Я
Н
Е
П
О
Л
Я
Н
А
Я
У
С
Т
О
Ч
И
В
О
С
Т
Ь
И
О
Н
Н
Я
Д Л И Н
1 – образование химической связи обусловлено взаимодействием атомных частиц и сопровождается … электронных оболочек (орбиталей) внешнего энергетического уровня;
2 – вид химической связи, образующийся в сложных веществах между атомными частицами неметаллов;
3 – количество теплоты, поглощаемое при разрыве связи или выделяемое при ее образовании;
4 – вид химической связи, образующийся в простых металлических веществах;
5 – вид химической связи, образующийся в простых веществах между частицами неметаллов;
6 – в виде свободных (изолированных) атомов существуют только благородные газы (гелий, неон, аргон, криптон, ксенон и радон), что обусловлено высокой … их электронных структур;
7 – вид химической связи, образующийся в сложных веществах между атомными частицами металлов и неметаллов;
8 – расстояние между ядрами связываемых атомных частиц.