- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии на тему Электролиты и неэлектролиты. Электролитическая диссоциация 9 класс
Содержание
- 1. Презентация к уроку химии на тему Электролиты и неэлектролиты. Электролитическая диссоциация 9 класс
- 2. Проводят ли электрический ток вода, соль и раствор соли?
- 3. Механизм растворения в воде веществ с различной
- 4. Механизм растворения в воде веществ с ИОННОЙ
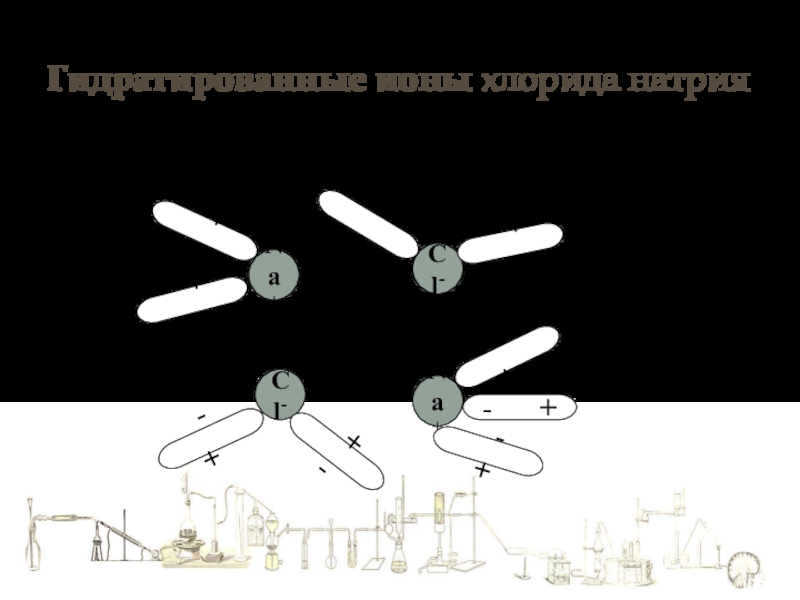
- 5. Гидратированные ионы хлорида натрияNa+Cl-Cl-Na+ +
- 6. Механизм растворения в воде веществ с ИОННОЙ
- 7. Слайд 7
- 8. Механизм растворения в воде веществ с КОВАЛЕНТНОЙ
- 9. + - +
- 10. Соли и щелочи проводят ток не только
- 11. Электролиты - вещества, водные растворы и расплавы которых проводят электрический ток В приборе - раствор электролита
- 12. Неэлектролиты - вещества, водные растворы и расплавы
- 13. Вещества (проводят электрический ток) Кислоты (HCl; H2SO4);Основания
- 14. Электролитическая диссоциация - процесс распада электролита на
- 15. Теория электролитической диссоциации1. Электролиты при растворении в воде или расплавлении распадаются
- 16. Теория электролитической диссоциацииУравнение диссоциации записывают упрощенноKCl →
- 17. Теория электролитической диссоциацииУравнение диссоциации записывают упрощенноKCl →
- 18. Теория электролитической диссоциацииУравнение диссоциации записывают упрощенноKCl →
- 19. Теория электролитической диссоциации2. Ионы отличаются от атомов
- 20. Теория электролитической диссоциации2. Ионы отличаются от атомов
- 21. Теория электролитической диссоциации2. Ионы отличаются от атомов
- 22. Теория электролитической диссоциации3. В растворах и расплавах электролиты
- 23. Растворение – физико-химический процессПри растворение в воде
- 24. Гидратированные ионы могут отличаться по окраске от
- 25. Домашнее задание§ 6 – учить!
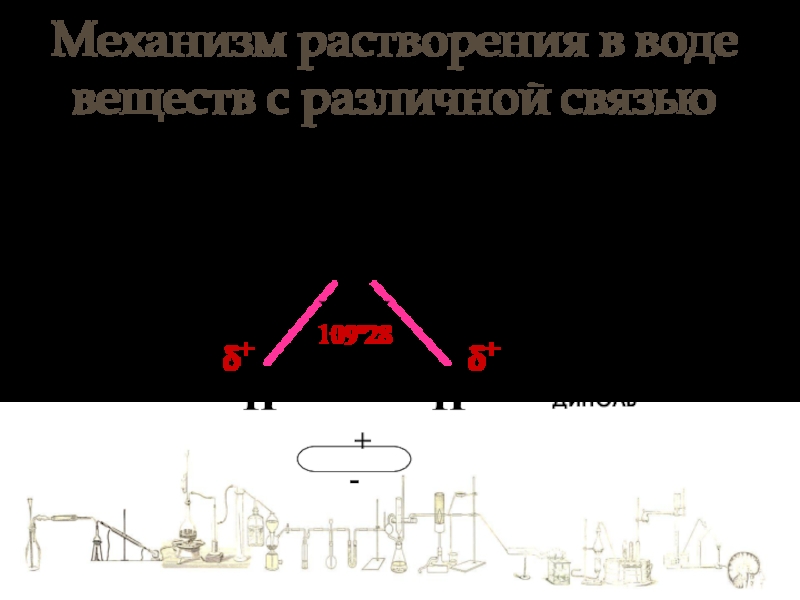
Слайд 3Механизм растворения в воде веществ с различной связью
О
Н
Н
109º28
+
δ+
δ+
Молекулы воды полярный
Вода – полярный растворитель
ДИПОЛЬ
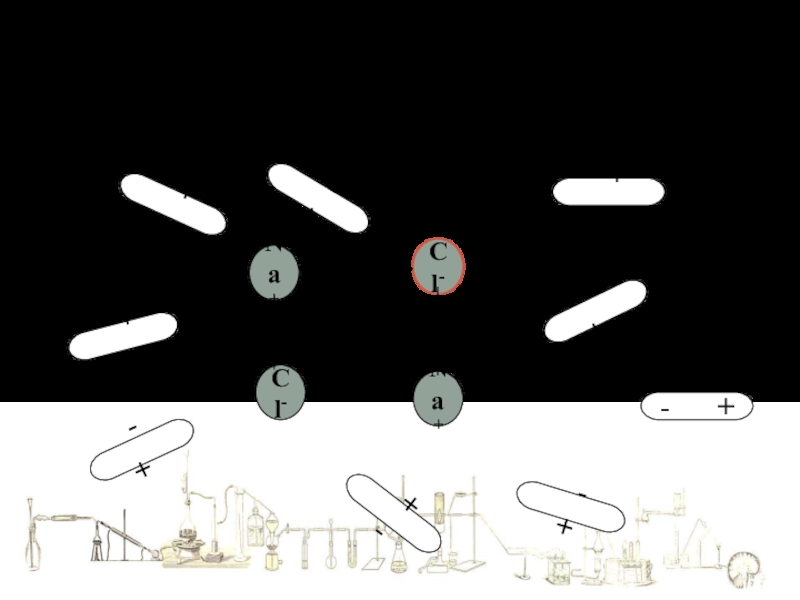
Слайд 4Механизм растворения в воде веществ с ИОННОЙ связью
Na+
Cl-
Cl-
Na+
+
+ -
+ -
- +
- +
- +
+ -
+ -
+ -
Кристалл NaCl
Слайд 6Механизм растворения в воде веществ с ИОННОЙ связью
Процессу гидратации способствует большая
При 20о она равна 81.
Это значить, что химическая связь между ионами в воде в 81 раз слабее, чем в вакууме.
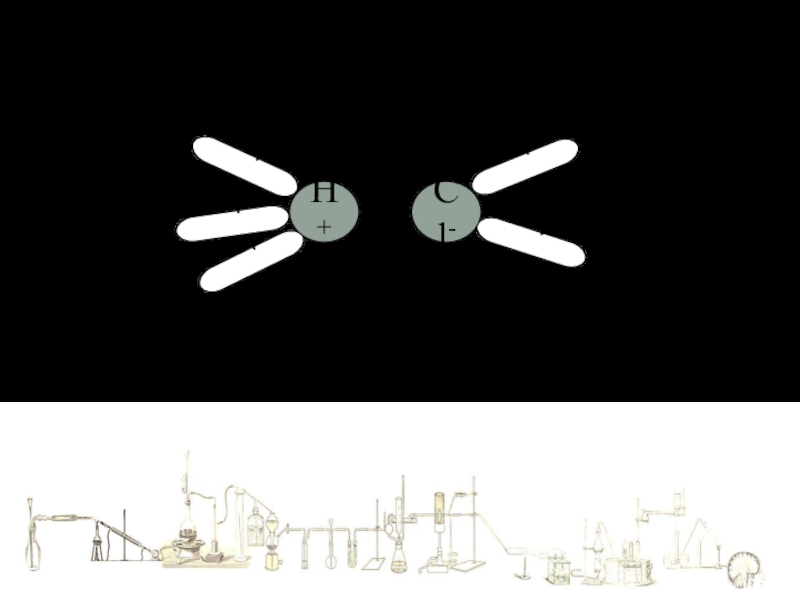
Слайд 8Механизм растворения в воде веществ с КОВАЛЕНТНОЙ ПОЛЯРНОЙ связью
+
+ -
+ -
+ -
+ -
+ -
+ -
Под действием полярного растворителя ковалентная полярная связь поляризуется еще больше (Ионизируется), вследствие чего становится ионной.
Слайд 10Соли и щелочи проводят ток не только в растворах, но и
А сахар, ацетон и спирт ток не проводят.
Слайд 11
Электролиты -
вещества, водные растворы и расплавы которых
проводят электрический ток
В приборе - раствор электролита
Слайд 12
Неэлектролиты -
вещества, водные растворы и расплавы которых
НЕ проводят
В приборе – раствор неэлектролита
Слайд 13Вещества
(проводят электрический ток)
Кислоты (HCl; H2SO4);
Основания (NaOH; Ba(OH)2);
Соли (NaCl; CuSO4).
(не
ДИСТИЛИРОВАННАЯ ВОДА
Органические вещества;
Газы (O2; H2; CO2);
Оксиды (CuO; Fe2O3).
Слайд 14 Электролитическая диссоциация - процесс распада электролита на ионы при растворении в
Сванте Август
Аррениус
1859-1927гг.
Шведский физико-химик,
создатель теории
электролитической
диссоциации.
Слайд 15Теория электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на положительно заряженные ионы (катионы) и отрицательно
В водных растворах ионы химически связаны с молекулами воды - гидратированы
Слайд 16Теория электролитической диссоциации
Уравнение диссоциации записывают упрощенно
KCl → K+ + Cl-
1. Электролиты при растворении в воде
В водных растворах ионы химически связаны с молекулами воды - гидратированы
Слайд 17Теория электролитической диссоциации
Уравнение диссоциации записывают упрощенно
KCl → K+ + Cl-
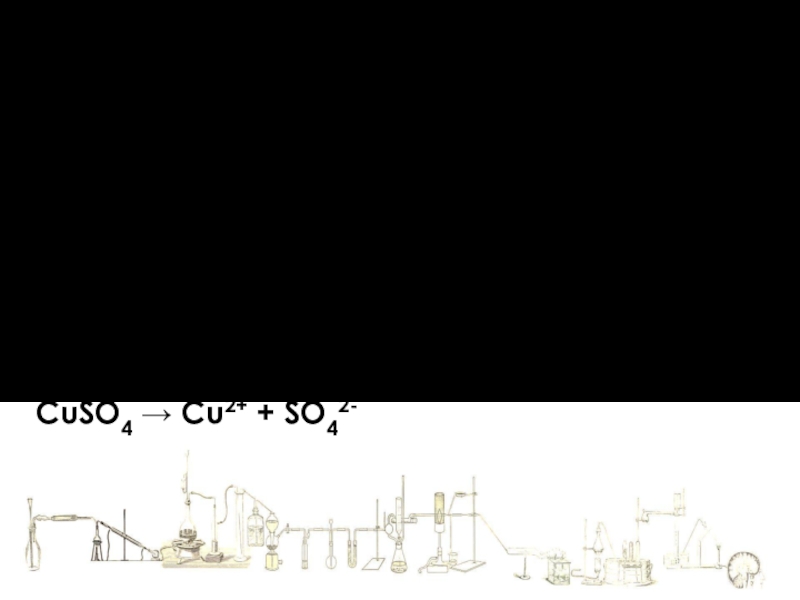
CuSO4 →
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на положительно заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды - гидратированы
Слайд 18Теория электролитической диссоциации
Уравнение диссоциации записывают упрощенно
KCl → K+ + Cl-
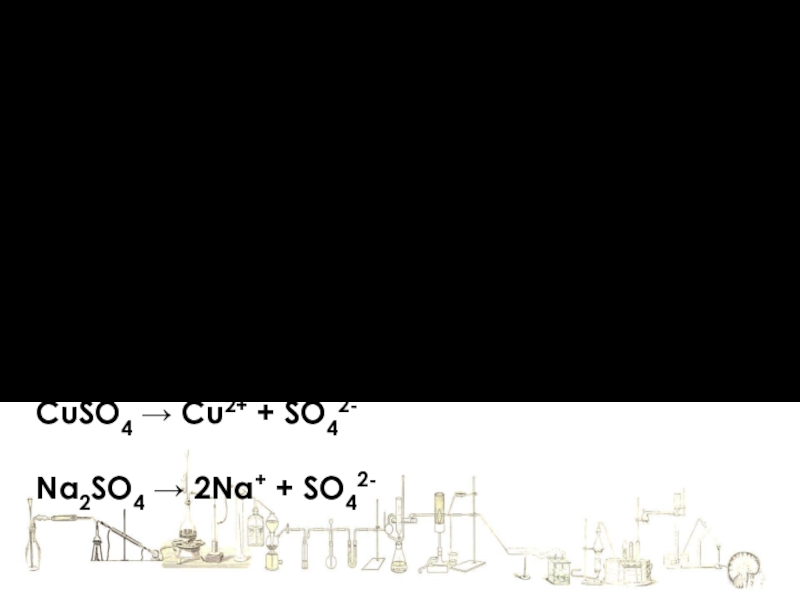
CuSO4 →
Na2SO4 → 2Na+ + SO42-
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на положительно заряженные ионы (катионы) и отрицательно заряженные (анионы).
В водных растворах ионы химически связаны с молекулами воды - гидратированы
Слайд 19Теория электролитической диссоциации
2. Ионы отличаются от атомов по строению и свойствам.
Ионы
Изобразите электронное строение атома и иона натрия.
Атом
Ион
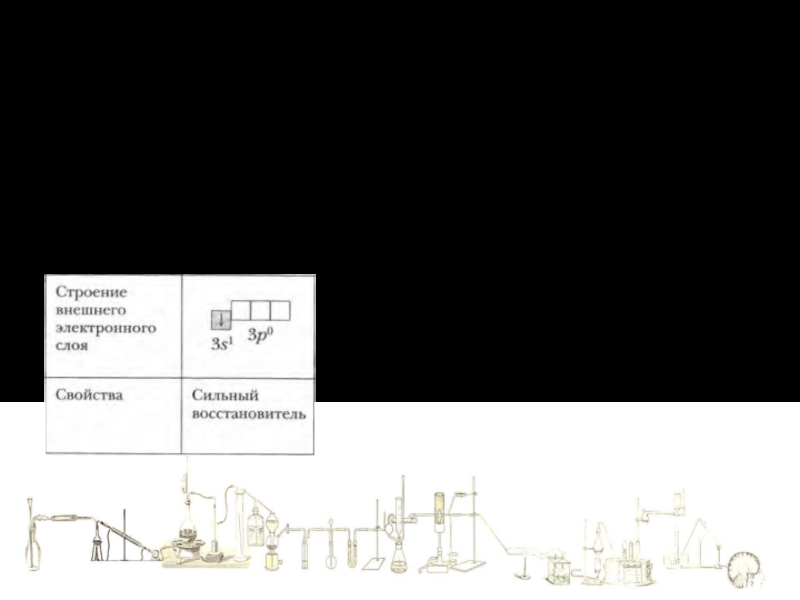
Слайд 20Теория электролитической диссоциации
2. Ионы отличаются от атомов по строению и свойствам.
Ионы
Изобразите электронное строение атома и иона натрия.
Атом
Ион
Слайд 21Теория электролитической диссоциации
2. Ионы отличаются от атомов по строению и свойствам.
Ионы
Изобразите электронное строение атома и иона натрия.
Атом
Ион
Слайд 22Теория электролитической диссоциации
3. В растворах и расплавах электролиты проводят электрический ток. При
катионы к катоду (-) анионы к аноду (+)
Слайд 23Растворение – физико-химический процесс
При растворение в воде серной кислоты выделяется большое
При растворении аммиачной селитры (нитрата аммония) NH4NO3 – поглощается тепло.
Тепловые явления являются признаком химической реакции.
Слайд 24Гидратированные ионы могут отличаться по окраске от негидратированных
CuSO4 – белый порошок
Гидратированные
При выпаривании образуются голубые кристаллы медного купороса CuSO4*5H2O