- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии для 9 класса Оксид серы (IV). Сернистая кислота.
Содержание
- 1. Презентация к уроку химии для 9 класса Оксид серы (IV). Сернистая кислота.
- 2. ПланОксид серы (IV)1. Состав. Строение 3. Химические свойстваСернистая кислота1. Состав. Строение 2. 2.Физические свойстваХимические свойства
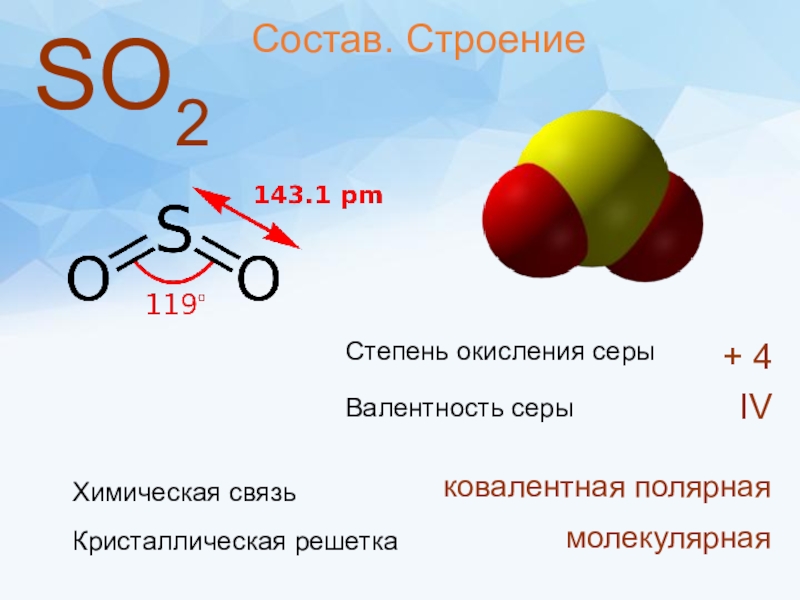
- 3. SО2Степень окисления cеры + 4Валентность серы IVСостав. СтроениеХимическая связьковалентная полярнаяКристаллическая решеткамолекулярная
- 4. Физические свойства Оксидa серы (IV) Оксид серы
- 5. Химические свойства оксида серы (IV)К какой группе
- 6. 1. Кислотный оксид +Вода= Кислота SO2
- 7. Окислительные свойства
- 8. Состав. Строение Н2SО3Степень окисления фосфора +
- 9. Качественная реакция на сульфит-ионЛабораторный опыт:Налейте в 2
- 10. Мой личный результатЯ знаю …Я умею…
- 11. Домашнее задание1. Прочитать параграф 20 стр. 71-722. Выполнить задание 1 стр. 73
- 12. Слайд 12
Слайд 2План
Оксид серы (IV)
1. Состав. Строение
3. Химические свойства
Сернистая кислота
1. Состав.
2.
2.Физические свойства
Химические свойства
Слайд 3SО2
Степень окисления cеры
+ 4
Валентность серы
IV
Состав. Строение
Химическая связь
ковалентная полярная
Кристаллическая решетка
молекулярная
Слайд 4Физические свойства Оксидa серы (IV)
Оксид серы (IV), или сернистый газ,
Более чем в 2 раза тяжелее воздуха.
Хорошо растворяется в воде, с образованием нестойкой сернистой кислоты.
Ядовит.
При охлаждении до -10°С сжижается в бесцветную жидкость.
Слайд 5Химические свойства оксида серы (IV)
К какой группе оксидов относится оксид серы
Оксид серы (IV) кислотный оксид
Какие свойства характерны для кислотных оксидов?
Взаимодействие с водой, основаниями, основными оксидами.
Составьте уравнения реакций оксида серы (IV) c:
водой,
гидроксидом калия,
оксидом кальция
Слайд 61. Кислотный оксид +Вода= Кислота
SO2 + H2O = H2SO3
2.
SO2 + 2KOH = K2SO3 + H2O
SO2 + 2OH - = SO3 2- + H2O
3. Основной оксид + Кислотный оксид = Соль
CaO + SO2 = CaSO3
Слайд 7Окислительные свойства SО2
SO2 +
Восстановительные свойства SО2
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
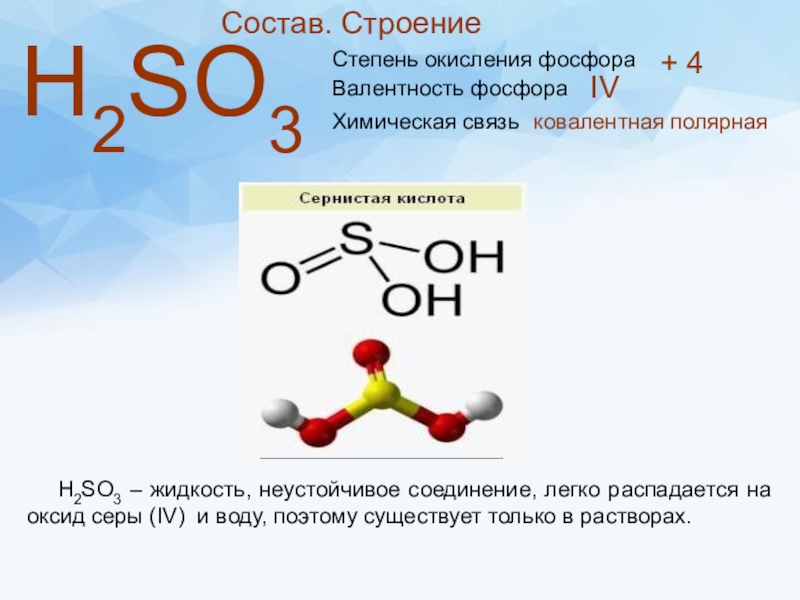
Слайд 8 Состав. Строение
Н2SО3
Степень окисления фосфора
+ 4
Валентность фосфора
IV
Химическая связь
ковалентная
Н2SО3 – жидкость, неустойчивое соединение, легко распадается на оксид серы (IV) и воду, поэтому существует только в растворах.
Слайд 9Качественная реакция на сульфит-ион
Лабораторный опыт:
Налейте в 2 пробирки по 1 мл
Na2SO3 + H2 SO4 = Na2SO4 + H2SO3 (H2 O + SO2 )
2H+ + SO32– = H2 O + SO 2
Na2SO3 + 2HCl = 2NaCl + H2SO3 (H2 O + SO2 )
2H+ + SO32– = H2 O + SO 2