- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии
Содержание
- 1. Презентация к уроку химии
- 2. Сегодня на уроке вы узнаете:Понятие об ацетиленовых
- 3. Понятие об алкинахАлкины – углеводороды, содержащие в
- 4. Характеристика тройной связиВид гибридизации –
- 5. Схема образования sp -гибридных орбиталей
- 6. Номенклатура Согласно международной
- 7. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12Этин ПропинБутинПентинГексинГептин
- 8. Изомерия алкинов Изомерия положения тройной связи (начиная
- 9. 2. Изомерия углеродного скелета (начиная с С5Н8):СН
- 10. 3. Межклассовая изомерия с алкадиенами и циклоалкенами,
- 11. Выполните упражнение:Назовите вещество.Составьте к нему три изомера
- 12. Проверь правильность, выполненного задания.СН3 С
- 13. Физические свойстваТемпературы кипения и плавления алкинов, так
- 14. Ацетилен получают в промышленности двумя способами:1. Термический
- 15. Химические свойства алкиновХимические свойства ацетилена и его
- 16. Реакции присоединения1. Галогенирование Обесцвечивание бромной воды
- 17. 2. Гидрогалогенирование. Реагируют с галогенводородами (HCl, HBr)
- 18. Правило В.В.Марковникова: водород присоединяется к наиболее
- 19. 3. Гидрирование. Вступают в реакцию гидрирования (присоединение
- 20. 4. Гидратация. реакция Кучерова
- 21. ОкислениеАцетилен и его гомологи окисляются перманганатом калия
- 22. Горение ацетиленаПри сгорании (полном окислении) ацетилена выделяется
- 23. Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с
- 24. Реакция полимеризации1. Димеризация под действием водного раствора
- 25. Применение алкинов
- 26. Молодцы!
Сегодня на уроке вы узнаете:Понятие об ацетиленовых углеводородах.Характеристика тройной связи.Изомерия и номенклатура алкинов.Физические свойства.Получение алкинов.Свойства алкинов.Применение алкинов.
Слайд 1АЛКИНЫ
Подготовила:
преподаватель химии
Муромского индустриального техникума
Шпидонова Марина Юрьевна
Слайд 2Сегодня на уроке вы узнаете:
Понятие об ацетиленовых углеводородах.
Характеристика тройной связи.
Изомерия и
номенклатура алкинов.
Физические свойства.
Получение алкинов.
Свойства алкинов.
Применение алкинов.
Физические свойства.
Получение алкинов.
Свойства алкинов.
Применение алкинов.
Слайд 3Понятие об алкинах
Алкины – углеводороды, содержащие в молекуле одну тройную связь
между атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
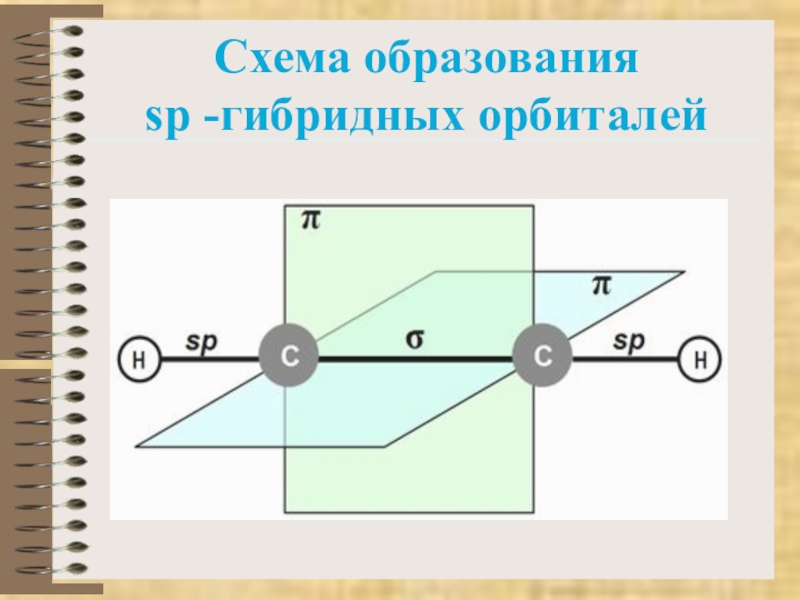
Слайд 4Характеристика
тройной связи
Вид гибридизации – sp
Валентный угол
– 180
У алкинов связь -С≡С- 0,12 нм
Строение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π
У алкинов связь -С≡С- 0,12 нм
Строение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π
Слайд 6Номенклатура
Согласно международной номенклатуре названия ацетиленовых
углеводородов
производят от соответствующего алкана
с заменой суффикса –ан на –ин.
Главную цепь нумеруют с того конца, к которому ближе расположена тройная связь.
Положение тройной связи обозначают номером того атома углерода, который ближе к началу цепи.
1 2 3 4 5
CH3 – C ≡ C – CH – CH3
|
CH3
4-метилпентин-2
производят от соответствующего алкана
с заменой суффикса –ан на –ин.
Главную цепь нумеруют с того конца, к которому ближе расположена тройная связь.
Положение тройной связи обозначают номером того атома углерода, который ближе к началу цепи.
1 2 3 4 5
CH3 – C ≡ C – CH – CH3
|
CH3
4-метилпентин-2
Слайд 8Изомерия алкинов
Изомерия положения тройной связи (начиная с С4Н6):
СН ≡С−СН2−СН3
бутин-1
СН3−С≡С−СН3
бутин-2
СН3−С≡С−СН3
бутин-2
Слайд 92. Изомерия углеродного скелета (начиная с С5Н8):
СН ≡С−СН2−СН2−СН3
пентин-1
СН ≡С−СН−СН3
⏐
СН3
3-метилбутин-1
СН ≡С−СН−СН3
⏐
СН3
3-метилбутин-1
Слайд 103. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН ≡С–СН2–СН3
бутин-1
СН2=СН–СН=СН2
бутадиен-1,3
СН = СН
⏐ ⏐ CН2 –СН2
циклобутен
Слайд 11Выполните упражнение:
Назовите вещество.
Составьте к нему три изомера разных видов изомерии. Назовите
изомеры.
СН3 С С СН СН3
СН3
Слайд 12Проверь правильность, выполненного задания.
СН3 С С СН
СН3 4-метилпентин 2
СН3
СН3 С С СН2 СН2 СН3 гексин 2
СН С СН2 СН СН3 4-метилпентин 1
СН3
СН2 С СН СН СН3 4-метилпентадиен 1,2
СН3
СН3
СН3 С С СН2 СН2 СН3 гексин 2
СН С СН2 СН СН3 4-метилпентин 1
СН3
СН2 С СН СН СН3 4-метилпентадиен 1,2
СН3
Слайд 13Физические свойства
Температуры кипения и плавления алкинов, так же как и алкенов,
закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Слайд 14Ацетилен получают в промышленности двумя способами:
1. Термический крекинг метана:
1500°С
2СН4 ⎯⎯→ С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O ⎯⎯→ C2H2 + Ca(OH)2
2СН4 ⎯⎯→ С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O ⎯⎯→ C2H2 + Ca(OH)2
Получение алкинов
Слайд 15Химические свойства алкинов
Химические свойства ацетилена и его гомологов в основном определяются
наличием в их молекулах тройной связи. Наиболее характерны для алкинов реакции присоединения.
Слайд 16Реакции присоединения
1. Галогенирование
Обесцвечивание бромной воды является качественной реакцией на
все непредельные углеводороды
HC≡CH + Br2 СН=СН
| |
Br Br
Слайд 172. Гидрогалогенирование.
Реагируют с галогенводородами (HCl, HBr) (реакция идет в две стадии
по правилу Марковникова)
1 2 3 1 2 3
СН ≡ С – CH3 + НBr → СН2 = C – СН3
пропин │
Br
2-бромпропен
CH2 = СBr – СН3 + НBr → СН3 – CBr2 – СН3
2-бромпропен 2,2-дибромпропан
1 2 3 1 2 3
СН ≡ С – CH3 + НBr → СН2 = C – СН3
пропин │
Br
2-бромпропен
CH2 = СBr – СН3 + НBr → СН3 – CBr2 – СН3
2-бромпропен 2,2-дибромпропан
Слайд 18Правило В.В.Марковникова:
водород присоединяется к наиболее гидрогенизированному атому углерода при
двойной связи, то есть к атому углерода с наибольшим числом водородных атомов.
Слайд 193. Гидрирование.
Вступают в реакцию гидрирования (присоединение Н2)
t,P
СН ≡ СН + Н2 → СН2 = СН2
этин этен
(ацетилен)
t,P
СН2 = CH2 + Н2 → СН3 – СН3
этен этан
Слайд 21Окисление
Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи и
образованием карбоновых кислот:
R−C≡C−R’ + 3[O] + H2O ⎯→ R−COOH + R’−COOH
5С2Н2 + 8KMnО4 + 12Н2SO4 → 5НООС – СООН
этин раствор марганцовки щавелевая кислота
+ 8MnSО4 + 4К2SO4 + 12Н2O
Алкины обесцвечивают раствор
KMnO4, что используется
для их качественного
определения.
R−C≡C−R’ + 3[O] + H2O ⎯→ R−COOH + R’−COOH
5С2Н2 + 8KMnО4 + 12Н2SO4 → 5НООС – СООН
этин раствор марганцовки щавелевая кислота
+ 8MnSО4 + 4К2SO4 + 12Н2O
Алкины обесцвечивают раствор
KMnO4, что используется
для их качественного
определения.
Слайд 22Горение ацетилена
При сгорании (полном окислении) ацетилена выделяется большое количества тепла:
HC≡CH +
2О2 ⎯→
2СО2 + Н2О + Q
2СО2 + Н2О + Q
Слайд 23Реакции замещения
При взаимодействии ацетилена (или R−C≡C−H) с аммиачными
растворами оксида серебра выпадают
осадки нерастворимых ацетиленидов:
HC≡CH + 2[Ag(NH3)2]OH ⎯→ AgC≡CAg ↓ + 4NH3 + 2H2O
HC≡CH + 2[Ag(NH3)2]OH ⎯→ AgC≡CAg ↓ + 4NH3 + 2H2O
Качественная реакция на
концевую тройную связь
Слайд 24Реакция полимеризации
1. Димеризация под действием водного раствора CuCl и NH4Cl:
НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
(винилацетилен)
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
С, 600 °С
3НC≡CH ⎯⎯→ С6H6 (бензол)
(винилацетилен)
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
С, 600 °С
3НC≡CH ⎯⎯→ С6H6 (бензол)


















![Презентация к уроку химии ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и образованием карбоновых кислот:R−C≡C−R’ + 3[O] +](/img/thumbs/d6cebc9cf46dcfc5e2d9e82fcd486906-800x.jpg)

![Презентация к уроку химии Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с аммиачнымирастворами оксида серебра выпадают Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с аммиачнымирастворами оксида серебра выпадают осадки нерастворимых ацетиленидов:HC≡CH + 2[Ag(NH3)2]OH ⎯→](/img/thumbs/e160c4e90143b9464edca60cbe16df3c-800x.jpg)








