- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии 10 класс Алкены
Содержание
- 1. Презентация к уроку химии 10 класс Алкены
- 2. Цели урокаЗнать: строение алкенов, характерные типы химических
- 3. Понятие об алкенахАлкены – углеводороды, содержащие в
- 4. Характеристика двойной связи (С ═ С)Вид гибридизации
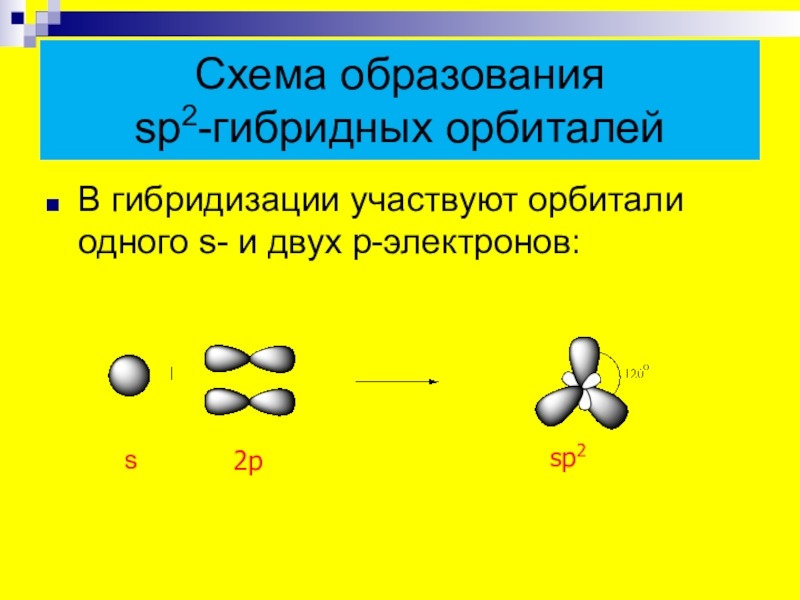
- 5. Схема образования sp2-гибридных орбиталейВ гибридизации участвуют орбитали одного s- и двух p-электронов:s 2psp2
- 6. Гомологический ряд алкеновЭтен ПропенБутенПентенГексенГептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14Общая формула СnН2n
- 7. Изомерия алкеновДля алкенов возможны два типа изомерии: 1-ый
- 8. Примеры изомеров углеродного скелета (С5Н10) 1
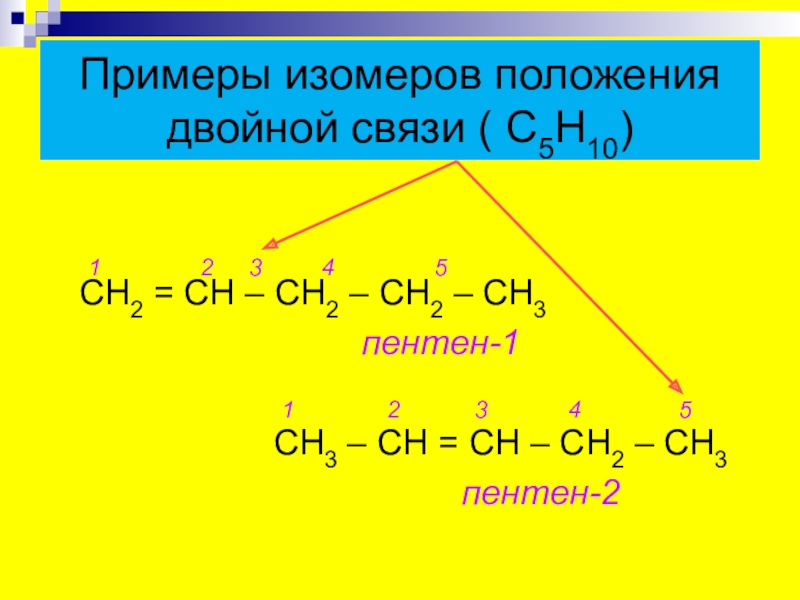
- 9. Примеры изомеров положения двойной связи ( С5Н10)
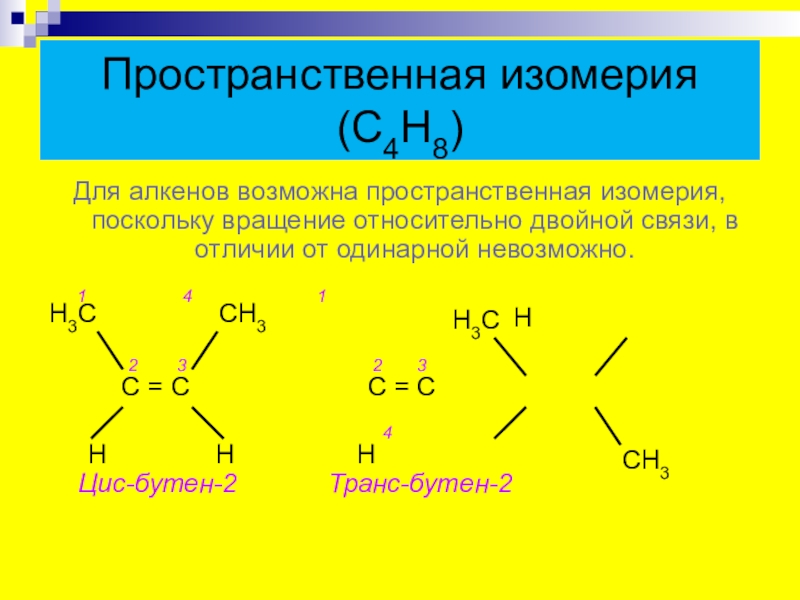
- 10. Пространственная изомерия (С4Н8)Для алкенов возможна пространственная изомерия,
- 11. Геометрические изомеры бутенаЦис-изомерТранс-изомер
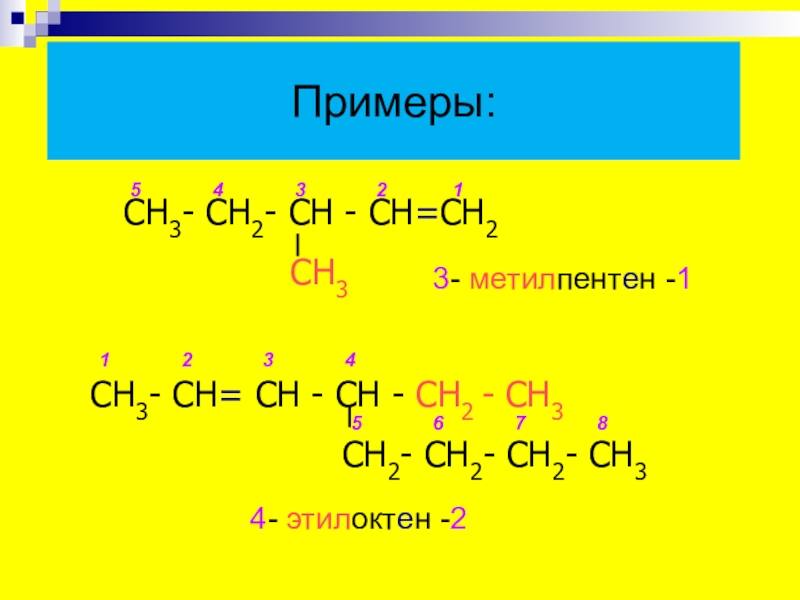
- 12. Примеры:4- этилоктен -2 СН3- СН2- СН
- 13. Физические свойства алкеновАлкены плохо растворимы в воде,
- 14. Химические свойства алкеновПо химическим свойствам алкены резко
- 15. Типы химических реакций, которые характерны для алкеновРеакции присоединения.Реакции полимеризации.Реакции окисления.
- 16. Реакции присоединения1. Гидрирование.CН2 = СН2 + Н2
- 17. Реакции присоединения3. Гидрогалогенирование. 1
- 18. Гидрогалогенирование гомологов этиленаПравило В.В. МарковниковаАтом водорода присоединяется
- 19. Реакции полимеризации (свободно-радикальное присоединение)Полимеризация – это последовательное
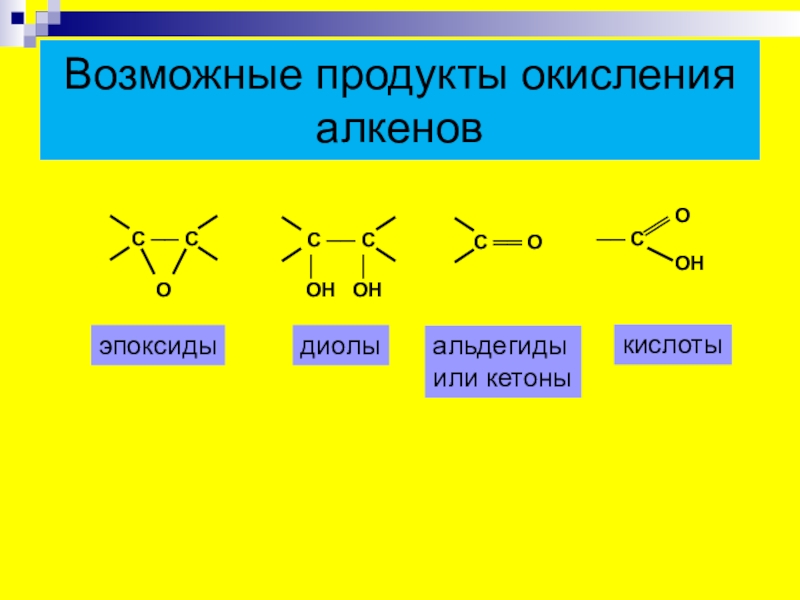
- 20. Возможные продукты окисления алкеновэпоксидыдиолыальдегидыили кетоныкислоты
- 21. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата
- 22. Реакции окисления3. Каталитическое окисление. а) 2СН2 = СН2
- 23. Горение алкенов Алкены горят красноватым светящимся пламенем,
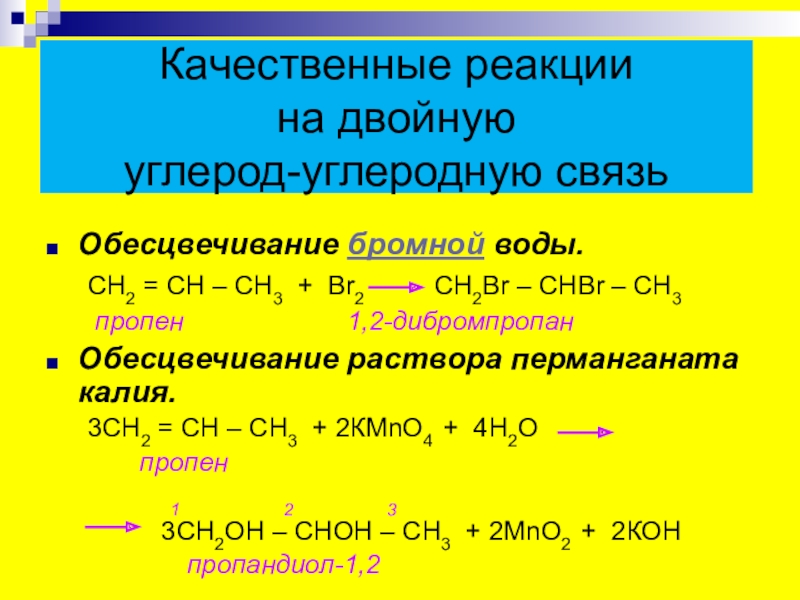
- 24. Качественные реакции на двойную углерод-углеродную
- 25. Применение Алкены широко используются в
- 26. Это интересноВсем известный полиэтилен был получен был
- 27. 1
- 28. а) СН3-СН=СН2 + НСl → ?б) СН2=СН-СН2-СН3
- 29. Спасибо за работу!
Слайд 1
Непредельные углеводороды ряда этилена.
Учитель химии МОУ ИРМО
«Оекская СОШ»
Дунаева Светлана
Слайд 2Цели урока
Знать: строение алкенов, характерные типы химических реакций (реакции присоединения, полимеризации,
Уметь: устанавливать зависимость «состав – строение - свойства – применение», составлять молекулярные и структурные формулы алкенов, называть их, записывать уравнения реакций с участием алкенов, определять тип химической реакции
Слайд 3Понятие об алкенах
Алкены – углеводороды, содержащие в молекуле одну двойную связь
Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 4Характеристика двойной связи
(С ═ С)
Вид гибридизации –
Валентный угол –
Длина
Строение ─
Вид связи –
По типу перекрывания –
Слайд 5Схема образования
sp2-гибридных орбиталей
В гибридизации участвуют орбитали одного s- и двух
s
2p
sp2
Слайд 6Гомологический ряд алкенов
Этен
Пропен
Бутен
Пентен
Гексен
Гептен
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
Общая формула СnН2n
Слайд 7Изомерия алкенов
Для алкенов возможны два типа изомерии:
1-ый тип – структурная изомерия:
углеродного скелета
положения двойной связи
межклассовая
2-ой тип – пространственная изомерия:
геометрическая
Слайд 8Примеры изомеров углеродного скелета (С5Н10)
1 2 3
СН3 СН3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН3 – С = СН – СН3
СН3 2-метилбутен-2
Слайд 9Примеры изомеров положения двойной связи ( С5Н10)
1
пентен-1
1 2 3 4 5
СН3 – СН = СН – СН2 – СН3
пентен-2
Слайд 10Пространственная изомерия (С4Н8)
Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной
1 4 1
Н
2 3 2 3
С = С С = С
4
Н Н Н Цис-бутен-2 Транс-бутен-2
Н3С
СН3
Н3С
СН3
Слайд 12Примеры:
4- этилоктен -2
СН3- СН2- СН - СН=СН2
СН3- СН= СН - СН - СН2 - СН3
СН2- СН2- СН2- СН3
1
2
3
4
5
6
7
8
1
2
3
4
5
3- метилпентен -1
Слайд 13Физические свойства алкенов
Алкены плохо растворимы в воде, но хорошо растворяются в
С2– С4 - газы
С5– С16 - жидкости
С17… - твёрдые вещества
С увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Слайд 14Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов. Алкены
Слайд 15Типы химических реакций, которые характерны для алкенов
Реакции присоединения.
Реакции полимеризации.
Реакции окисления.
Слайд 16Реакции присоединения
1. Гидрирование.
CН2 = СН2 + Н2 СН3 – СН3
Условия реакции: катализатор – Ni, Pt, Pd
2. Галогенирование.
1 2 3
CН2 = СН – СН3 + Сl – Сl СН2 – СН – СН3
пропен
Cl Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
Слайд 17Реакции присоединения
3. Гидрогалогенирование.
1
СН2 = СН – СН2 – СН3 + Н – Сl CН3 – СН – СН2 – СН3
Бутен-1 Cl
2-хлорбутан
4. Гидратация.
1 2 3 1 2 3
CН2 = СН – СН3 + Н – ОН СН3 – СН – СН3
пропен
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
Слайд 18Гидрогалогенирование гомологов этилена
Правило
В.В. Марковникова
Атом водорода присоединяется к наиболее гидрированному атому
Слайд 19Реакции полимеризации
(свободно-радикальное присоединение)
Полимеризация – это последовательное соединение одинаковых молекул в более
σ σ σ
СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
π π π
σ σ σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2 (– СН2 – СН2 –)n
Этен полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
Слайд 21Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия).
3СН2 = СН2 +
3СН2 - СН2 + 2МnО2 + 2КОН
ОН ОН
Или
С2Н4 + (О) + Н2О С2Н4(ОН)2
этандиол
этен
Слайд 22Реакции окисления
3. Каталитическое окисление.
а) 2СН2 = СН2 + (О)
этен уксусный альдегид
Условия реакции: катализатор – влажная смесь двух солей PdCl2 и CuCl2.
б) 2СН2 = СН2 + (О) 2СН2 СН2
этен
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350ºС
Слайд 23 Горение алкенов
Алкены горят красноватым светящимся пламенем, в то время как
При недостатке кислорода
Слайд 24Качественные реакции
на двойную
углерод-углеродную связь
Обесцвечивание бромной воды.
СН2 = СН –
пропен 1,2-дибромпропан
Обесцвечивание раствора перманганата калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1 2 3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
Слайд 25
Применение
Алкены широко используются в промышленности в качестве исходных веществ для
Слайд 26Это интересно
Всем известный полиэтилен был получен был получен в 1933 году
В 1943 году из полиэтилена стали изготавливать посуду, ящики, бутылки, упаковку, предметы домашнего обихода
Благодаря Его Величеству Случаю в 1938 году американский учёный Р. Планкетт получил тефлон, обладающий исключительной химической устойчивостью.
Слайд 27 1
а) СН3─С═СН─СН2─СН─СН3
СН3 СН3
1 4 5 6
б) Н3С СН2─СН2─СН3
2 3
С ═ С
Н Н
2 1
в) СН3─СН2─С═СН2
3 4 5
СН3─СН─СН2─СН3
Ответы:
а) 2,5-диметилгексен-2
б) цис-изомер-гексен-2
в) 3-метил-2-этилпентен-1
Назовите следующие алкены
Слайд 28а) СН3-СН=СН2 + НСl → ?
б) СН2=СН-СН2-СН3 + НBr → ?
В)
Ответы: а) СН3-СН=СН2 + НСl → СН3-СНCl-СН3
б) СН2=СН-СН2-СН3 + НBr → СН3-СНBr-СН2-СН3
в) СН3-СН2-СН=СН2 + НОН → СН3-СН2-СН-СН3
ОН
Используя правило В.В.Марковникова, напишите уравнения следующих реакций присоединения: