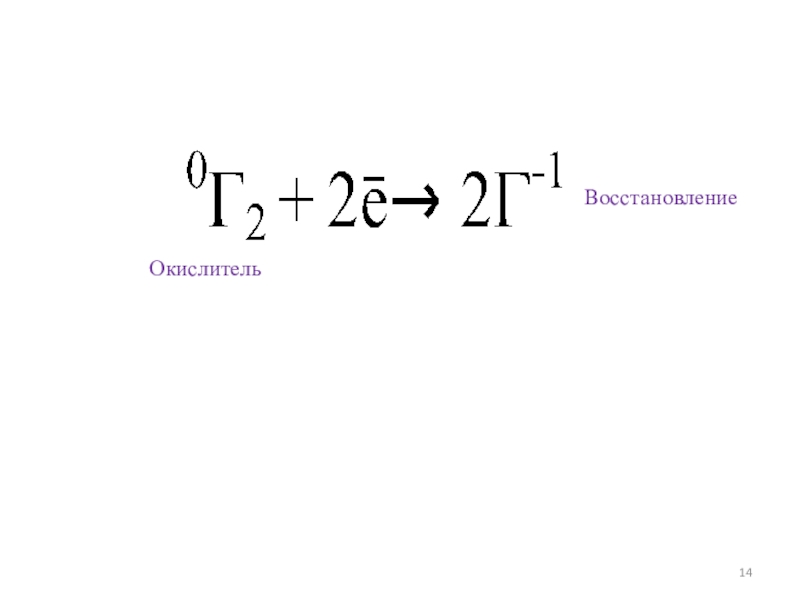- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Галогены
Содержание
- 1. Презентация к уроку Галогены
- 2. Задание 1Выберите те определения, которые можно отнести
- 3. Битва при г. Ипр 22 апреля 1915 года
- 4. Электронная формула атомов элемента, образовавшего газ 1s2 2 s2 2p6 3 s2 3 p5
- 5. Галогены
- 6. 1. Определить:а) положение галогенов в ПСХЭ Д.И.
- 7. К какому семейству относятся галогены?nS2nP5Электронные аналоги
- 8. Слайд 8
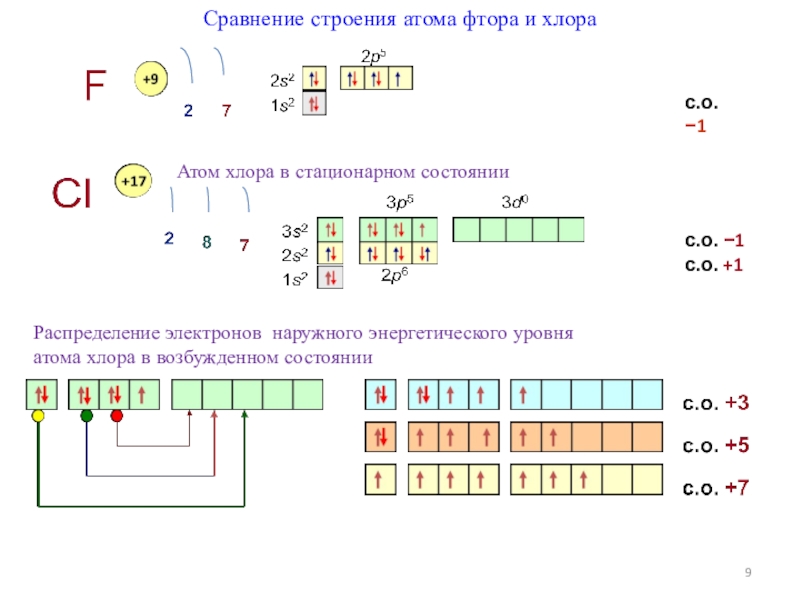
- 9. Сравнение строения атома фтора и хлора с.о.
- 10. ВыводыВ группе:Увеличивается число энергетических уровнейРадиусы атомов возрастаютУменьшается
- 11. - С чем связано изменение агрегатного состояния
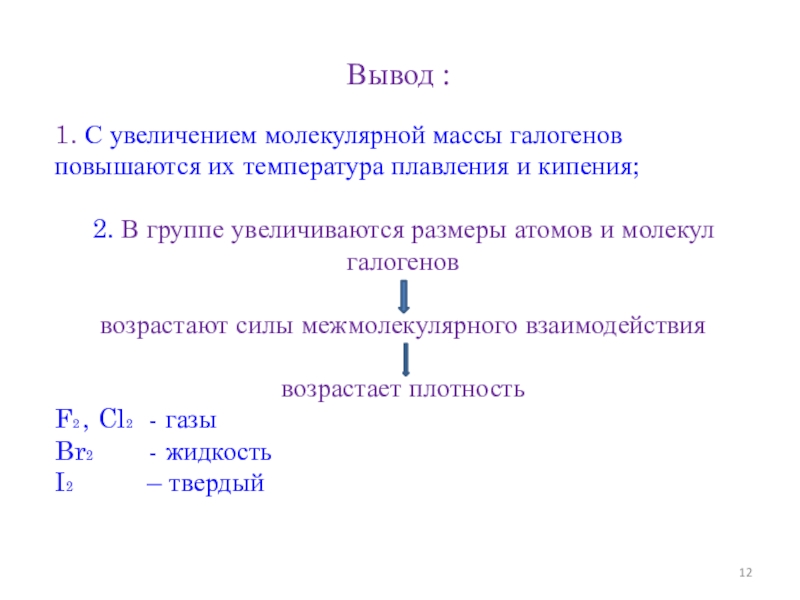
- 12. Вывод :1. С увеличением молекулярной массы галогенов
- 13. Слайд 13
- 14. Восстановление Окислитель
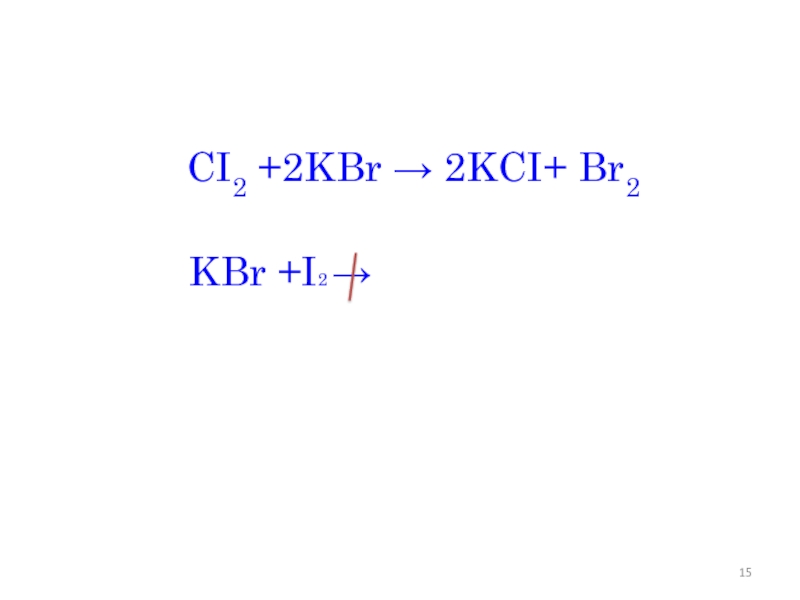
- 15. CI2 +2KBr → 2KCI+ Br2KBr +I2 →
- 16. Взаимодействие хлора с водными растворами а)фторида натрияб) бромида натрияВ) иодида натрия
- 17. Слайд 17
- 18. Горение воды во фторе
- 19. Взаимодействие галогенов с металламиВзаимодействует со всеми металлами
- 20. Вывод: химическая активность ослабевает от фтора к
- 21. Слайд 21
- 22. Задание 2Выберите верные суждения, указав номер правильного
- 23. 5. В ряду F – Cl –
- 24. Задание 4Ответ: 2, 3, 4
- 25. Задание 5Ответ: 4,5
- 26. Задание 6
Слайд 2Задание 1
Выберите те определения, которые можно отнести к неметаллам.
1. Малый радиус
2. Малое количество электронов на внешнем энергетическом уровне.
3. Элементы, чаще отдающие электроны.
4. Большое количество электронов на наружном энергетическом уровне.
5. Большой радиус атома.
6. Элементы, чаще принимающие электроны.
7. Вещества, обладающие только одним видом кристаллической решетки.
8. Элементы с большим значением электроотрицательности.
Слайд 61. Определить:
а) положение галогенов в ПСХЭ Д.И. Менделеева;
б) строение атомов галогенов;
в)
2. Дать сравнительную характеристику галогенов.
Слайд 9Сравнение строения атома фтора и хлора
с.о. −1
с.о. −1
с.о. +1
Атом хлора
Распределение электронов наружного энергетического уровня
атома хлора в возбужденном состоянии
Слайд 10Выводы
В группе:
Увеличивается число энергетических уровней
Радиусы атомов возрастают
Уменьшается прочность связи электронов внешнего
Окислительные свойства ослабевают, восстановительные – усиливаются. Ослабевают неметаллические и усиливаются металлические свойства.
3. Фтор только окислитель.
Хлор, бром, иод могут быть и окислителями и восстановителями.
Слайд 11- С чем связано изменение агрегатного состояния вещества?
Цвета?
Какова закономерность при изменении
температур плавления и кипения?
Изучите материал на стр. 104-105.
Таблицу 7
Рис. 48, 49.
Задание 2
Фтор
Хлор
Бром
Иод
Слайд 12Вывод :
1. С увеличением молекулярной массы галогенов повышаются их температура плавления
2. В группе увеличиваются размеры атомов и молекул галогенов
возрастают силы межмолекулярного взаимодействия
возрастает плотность
F2 , Cl2 - газы
Br2 - жидкость
I2 – твердый
Слайд 19Взаимодействие галогенов с металлами
Взаимодействует со всеми металлами с выделением большого количества
3F2 + 2 Al→ 2 AlF3 + 2989 кДж
3F2 + 2Fe → 2FeF3 + 1974 кДж
С хлором железо реагирует при нагревании
Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока.
Химическая активность йода еще ниже, чем у брома.
С металлами только при нагревании:
Слайд 20Вывод: химическая активность ослабевает от фтора к иоду. Каждый галоген является
F2 Cl2 Br2 I2
Окислительные и неметаллические свойства галогенов
уменьшаются от фтора к иоду
С увеличением радиуса атома уменьшается способность атомов галогенов присоединять галогены.
В результате более активный галоген вытесняет менее активный из его соединений.
Слайд 22
Задание 2
Выберите верные суждения, указав номер правильного суждения:
1. «Галогены» означает «Рождающие
2. Галогены образуют побочную подгруппу седьмой группы ПСХЭ Д.И. Менделеева.
3. Все простые вещества галогены при обычных условиях газы.
4. Фтор проявляет только окислительные свойства.
5. При взаимодействии хлора с железом образуется хлорид железа (II).
6. При взаимодействии галогенов с металлами образуются соли галогениды.
7. Бром может вытеснить йод из раствора его соли.
Слайд 235. В ряду F – Cl – Br – I
б) увеличиваются окислительные свойства элементов
в) уменьшается высшая степень окисления элементов
г) увеличиваются восстановительные свойства элементов
2. В ряду I2 → Br2 → Cl2 → F2 окислительные свойства
а) возрастают; в) не изменяется
б) уменьшается г) изменяется периодически
a
3. Какая степень окисления характерна для фтора:
а) +1; б) – 1; в) +3; г) – 3.
б
6. Реакция иода с порошком алюминия происходит:
а) при нагревании в) при добавлении катализатора (воды)
б) при низком давлении; г) при высоком давлении
в
4. Название какого из данных элементов означает «фиолетовый»:
а) фтор; б) хлор; в) бром; г) иод.
г
г
Задание 3