- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Электролиз 11 класс
Содержание
- 1. Презентация к уроку Электролиз 11 класс
- 2. Электролиз (от электро... и греч. lysis —
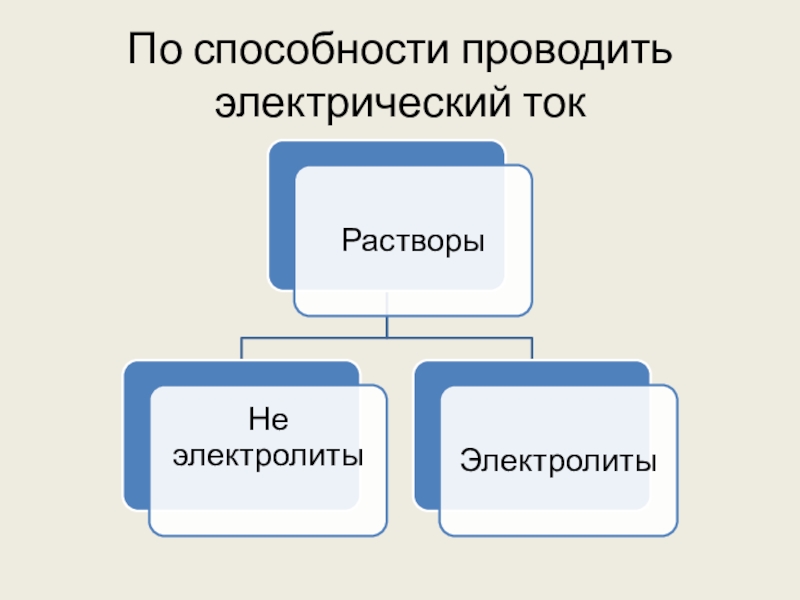
- 3. По способности проводить электрический ток
- 4. Электроли́т — вещество, расплав или раствор которого
- 5. Сильные электролитыпри растворении в воде практически полностью
- 6. Слабые электролитыв водных растворах лишь частично (обратимо)
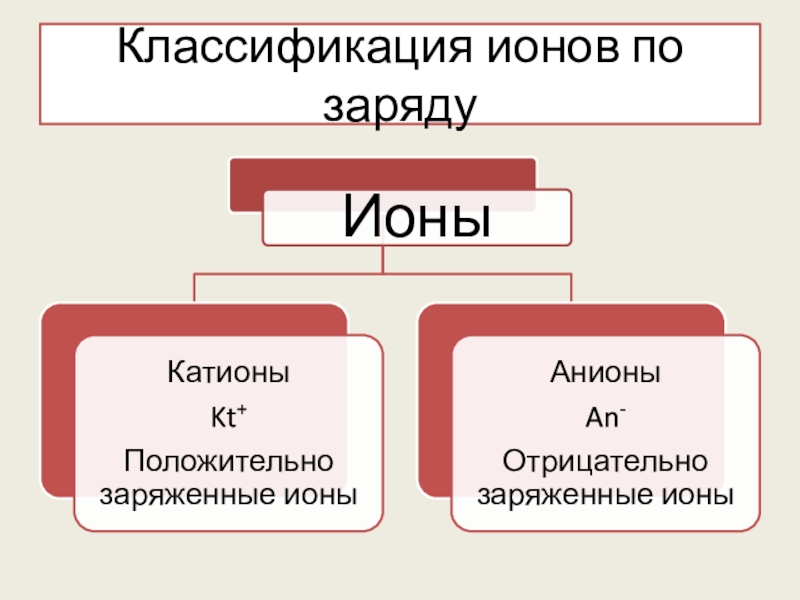
- 7. Классификация ионов по заряду
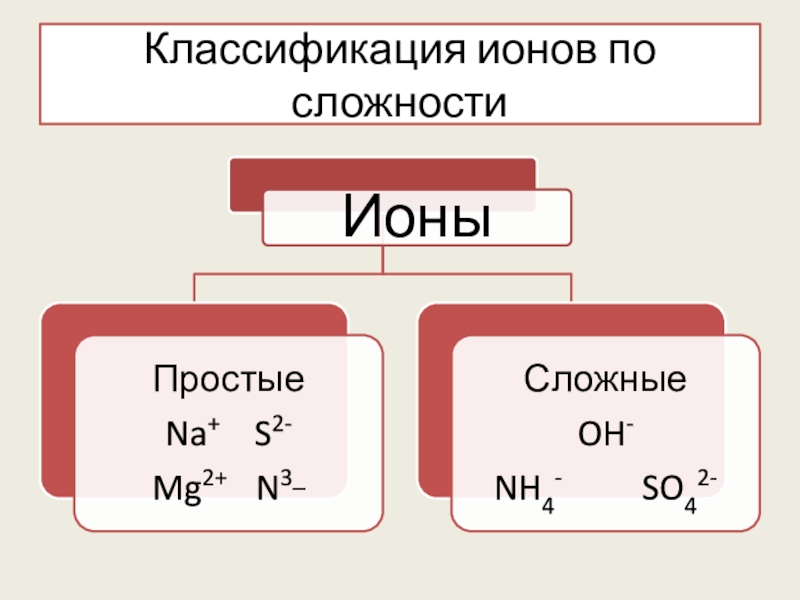
- 8. Классификация ионов по сложности
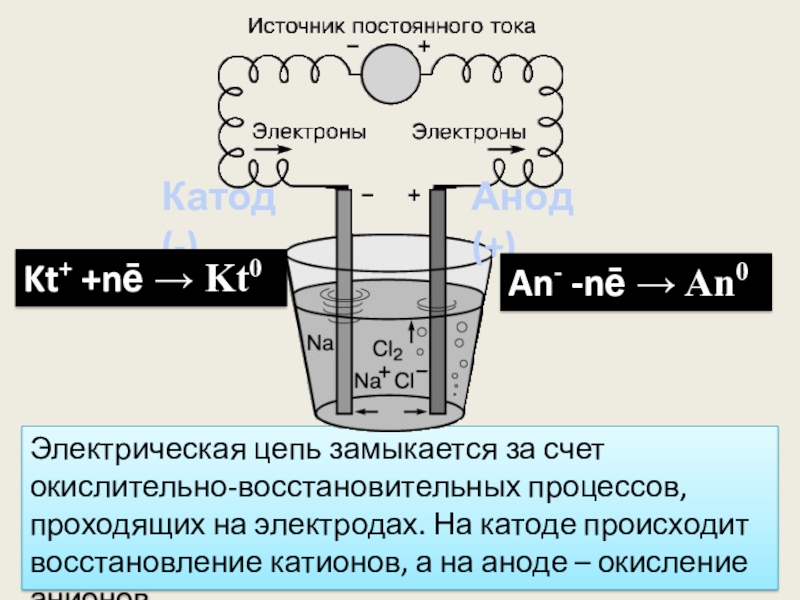
- 9. Катод (-)Анод (+)Отрицательно заряженный электрод называется катодом
- 10. Электрическая цепь замыкается за счет окислительно-восстановительных процессов,
- 11. ЭлектролизЭлектролиз расплавов(нет воды)Электролиз растворов(вода есть и принимает участие в ОВР)
- 12. Электролиз расплавовНа катоде (-) восстанавливаются катионы металла
- 13. №2А) NaCl (хлорид натрия)Катод (-): Na+ +1ē
- 14. №2Б) CaBr2 (бромид кальция)Катод (-): Сa2+ +2ē
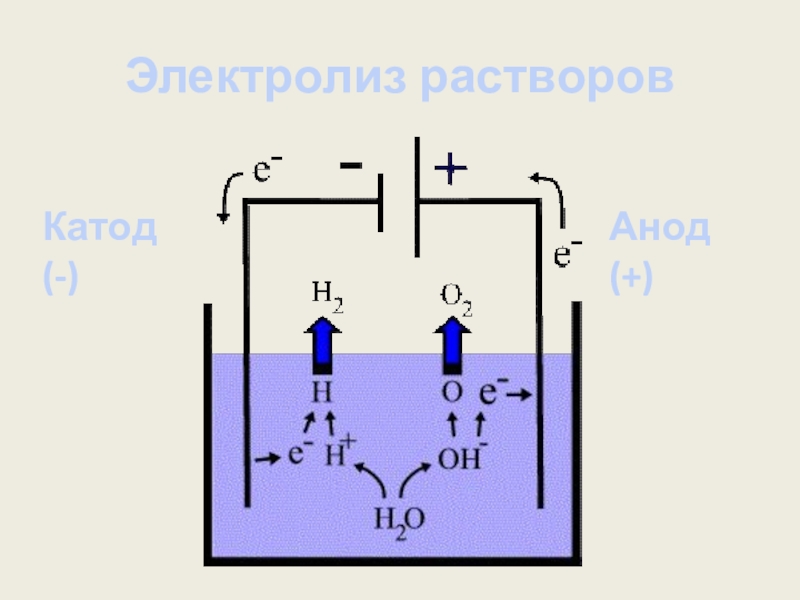
- 15. Электролиз растворовКатод (-)Анод (+)
- 16. На катоде (-) Металлы находящиеся левее магния
- 17. На катоде (-) Эти металлы из водных
- 18. На катоде (-) Эти металлы выделяются при
- 19. На аноде при электролизе водных растворов окисляются
- 20. Окисление на аноде сложных ионовА) В щелочной
- 21. А) KI (йодид калия)Катод (-): 2H2O +
- 22. Г) CuCl2 (хлорид меди)Катод (-): Сu2+ +2ē
- 23. Области применения электролизаПолучение хлора и фтора, щелочей,
- 24. А также…получение оксидных защитных пленок на металлах
- 25. Гальванопластикаполучение путем электролиза точных, легко отделяемых металлических
Слайд 2Электролиз (от электро... и греч. lysis — разложение, растворение, распад), совокупность
Слайд 4Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие
Сильные электролиты — диссоциируют полностью (соли, щелочи, а также сильные кислоты: HCl, HBr, HI, HNO3).
Слабые электролиты — диссоциируют не полностью: вода, слабые кислоты, основания p-, d-, и f- элементов.
Слайд 5Сильные электролиты
при растворении в воде практически полностью диссоциируют на ионы.
При
К сильным электролитам относятся:
Растворимые соли (смотри таблицу растворимости);
Многие неорганические кислоты: HNO3, H2SO4, HClO3, HClO4, HMnO4, HCl, HBr, HI;
Основания щелочных (LiOH, NaOH,KOH) и щелочноземельных (Ca(OH)2, Sr(OH)2, Ba(OH)2) металлов (смотри основания-сильные электролиты в таблице растворимости).
Слайд 6Слабые электролиты
в водных растворах лишь частично (обратимо) диссоциируют на ионы.
При написании
К слабым электролитам относятся:
Почти все органические кислоты и вода (Н2О);
Некоторые неорганические кислоты: H2S, H3PO4, HF, H2SO3 H2CO3, HNO2, H2SiO3 ;
Нерастворимые гидроксиды металлов (Mg(OH)2, Fe(OH)2, Zn(OH)2)
Гидрат аммиака (NH3*H2O)
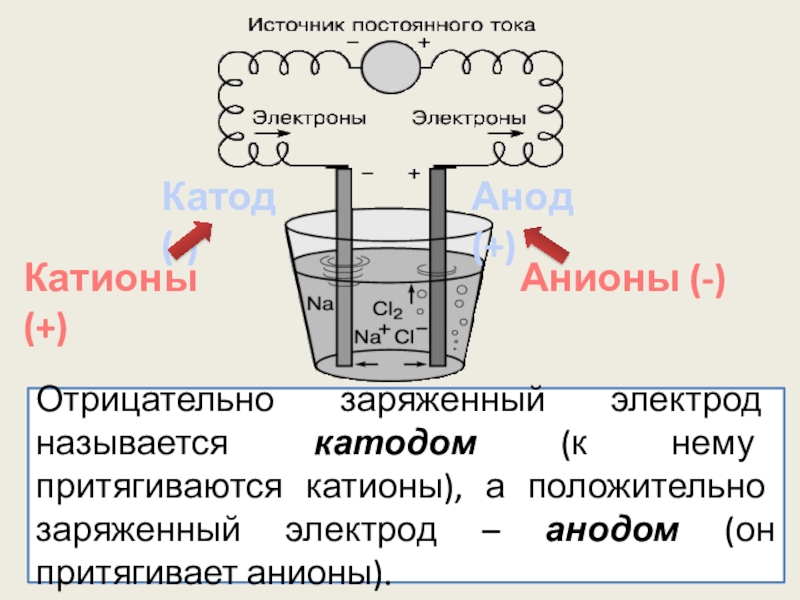
Слайд 9Катод (-)
Анод (+)
Отрицательно заряженный электрод называется катодом (к нему притягиваются катионы),
Катионы (+)
Анионы (-)
Слайд 10Электрическая цепь замыкается за счет окислительно-восстановительных процессов, проходящих на электродах. На
Катод (-)
Анод (+)
Kt+ +nē → Kt0
An- -nē → An0
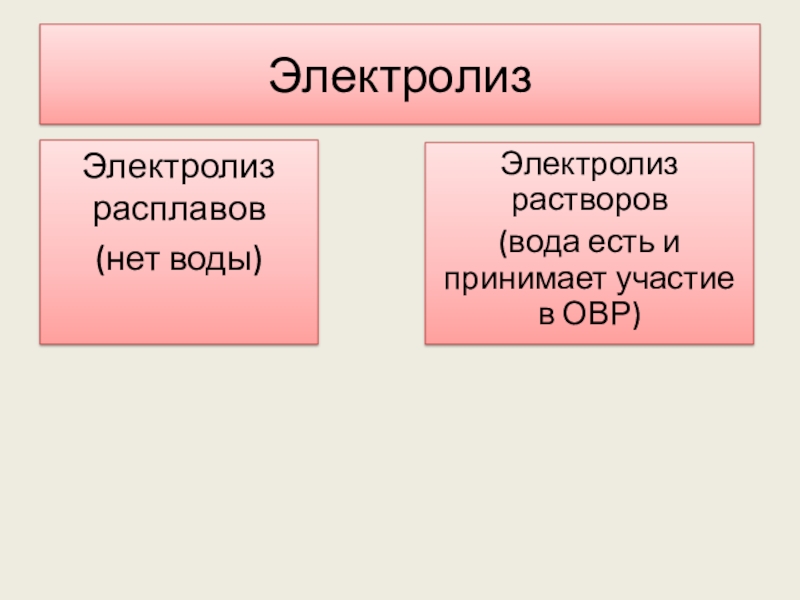
Слайд 11Электролиз
Электролиз расплавов
(нет воды)
Электролиз растворов
(вода есть и принимает участие в ОВР)
Слайд 12Электролиз расплавов
На катоде (-)
восстанавливаются катионы металла до чистого металла:
Na+ +1ē
На аноде (+)
простые анионы окисляются до простого вещества:
2Сl– – 2ē → Сl20 S2– – 2ē → S0
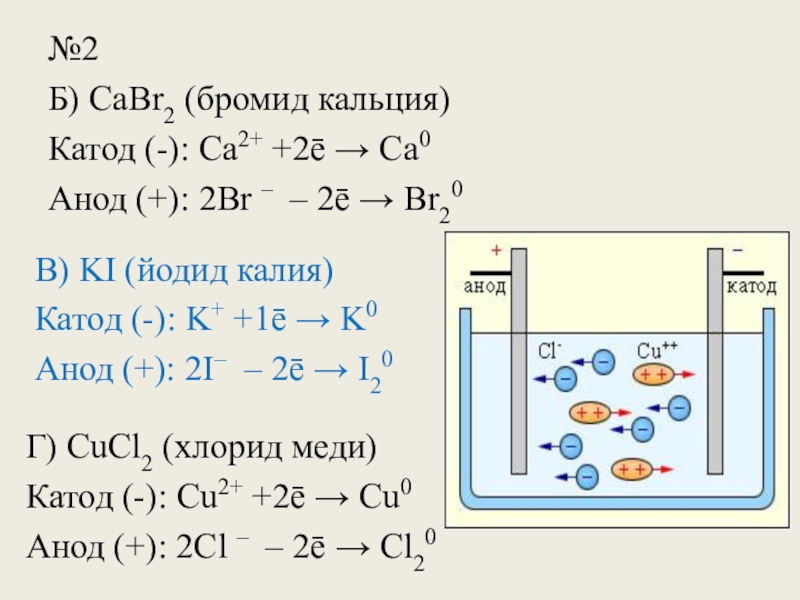
Слайд 14№2
Б) CaBr2 (бромид кальция)
Катод (-): Сa2+ +2ē → Ca0
Анод (+):
В) KI (йодид калия)
Катод (-): K+ +1ē → K0
Анод (+): 2I– – 2ē → I20
Г) CuCl2 (хлорид меди)
Катод (-): Сu2+ +2ē → Cu0
Анод (+): 2Cl – – 2ē → Cl20
Слайд 16На катоде (-)
Металлы находящиеся левее магния из водных растворов, как
На катоде выделяется водород:
А) Кислая среда: 2H+ +2ē → H20
Б) Нейтральная, щелочная среда:
2H2O +2ē → 2OH- + H20
Слайд 17На катоде (-)
Эти металлы из водных растворов восстанавливаются параллельно с
Чем выше концентрация соли, тем больше доля выделившегося металла. Чем более кислая среда, тем более вероятно выделение водорода.
Слайд 18На катоде (-)
Эти металлы выделяются при электролизе растворов в первую
Ag+ + 1ē = Ag0.
Слайд 19На аноде при электролизе водных растворов окисляются все простые анионы, за
2I– – 2e = I2
Фтор нельзя получить электролизом водных растворов, т.к. он реагирует с водой:
F2 + Н2O = 2НF + ½О2
Слайд 20Окисление на аноде сложных ионов
А) В щелочной среде:
4OH- - 4ē =
Б) В кислой и нейтральной средах:
2H2O - 4ē = O20↑+ 4H+
Слайд 21А) KI (йодид калия)
Катод (-): 2H2O + 2ē → 2OH- +
Анод (+): 2I– – 2ē → I20
Б) CuSO4 (сульфат меди)
Катод (-): Сu2+ + 2ē → Cu0
Анод (+): 2H2O - 4ē = O20↑+ 4H+
Б) Na2SO4 (сульфат натрия)
Катод (-): Na+ +1ē → Na0
Анод (+): 2H2O - 4ē = O20↑+ 4H+
Слайд 23Области применения электролиза
Получение хлора и фтора, щелочей, химически чистых водорода и
получение товарных металлов.
В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки.
Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий.
Слайд 24А также…
получение оксидных защитных пленок на металлах (анодирование);
электрохимическая обработка поверхности металлического
электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др. );
очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т. д. ).
Слайд 25Гальванопластика
получение путем электролиза точных, легко отделяемых металлических копий с различных неметаллических
С помощью гальванопластики изготовляют бюсты, статуи и т. д. Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д. ).