с.Батырево, 2019г.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Алюминий. Нахождение в природе. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.
Содержание
- 1. Презентация к уроку Алюминий. Нахождение в природе. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.
- 2. Захарова Надежда Васильевна, преподаватель химии и биологии«Батыревский
- 3. Данный урок разработан для проведения открытого урока
- 4. Я – металл, серебристый и лёгкий, и
- 5. Al «Алюминий – крылатый
- 6. Алюминий –
- 7. Задачи урока: -дать характеристику
- 8. Al 13Алюминий (лат. (лат. Aluminium(лат. Aluminium) 38226,9815Порядковый
- 9. План:Положение алюминия в периодической системе химических
- 10. Слайд 10
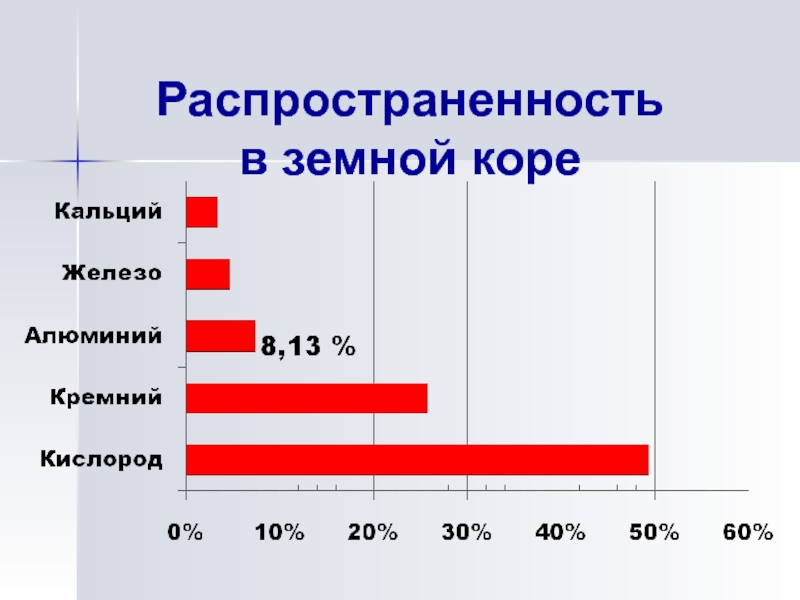
- 11. Распространенность в земной коре
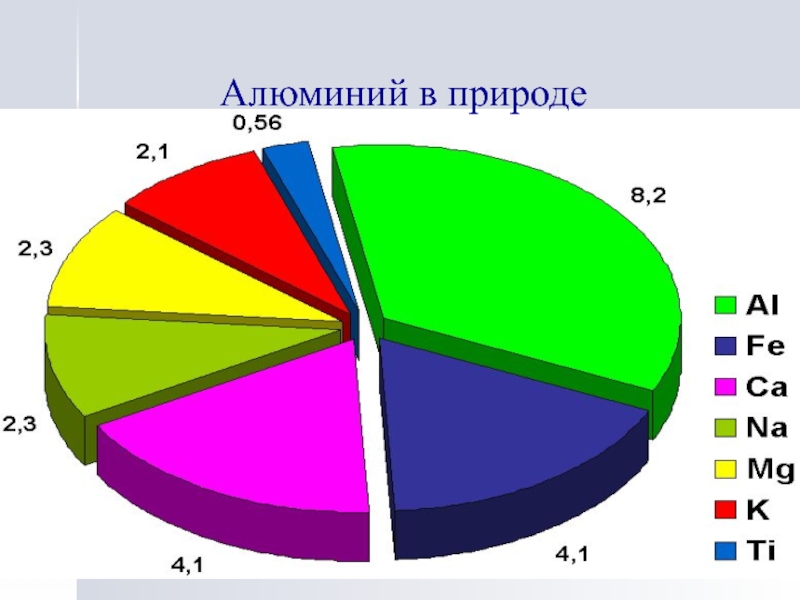
- 12. Алюминий в природе
- 13. Слайд 13
- 14. Слайд 14
- 15. РубинТопазБериллГранатСапфир Замечательные драгоценные камни – соединения алюминия
- 16. Важнейшие минералы алюминия, имеющие промышленное значение Боксит Al2O3⋅H2OКриолит Na3AlF6
- 17. изумрудбериллAl2O3AlO(OH) и гидроксид Al(OH)3
- 18. Корунд - наиболее устойчивая модификация оксида алюминия
- 19. Легенда «Однажды к римскому императору Тиберию пришел незнакомец.
- 20. «Серебро из глины»Немецкий учёный
- 21. ПолучениеПри электролизе расплава происходит разложение оксида алюминия 2Al2О3 = 4Al + 3О2
- 22. План характеристики физических свойств алюминия: Агрегатное состояние.Цвет.Плотность.Температура плавления.Пластичность.Теплопроводность, электропроводность.
- 23. Химические свойства алюминия: Взаимодействует
- 24. Взаимодействует со сложными веществами 2Al+
- 25. Химические свойства оксида алюминия:
- 26. Концентрированная серная и азотная кислоты пассивируют алюминий,
- 27. Применение Al
- 28. Алюминий –металл будущего!!!Алюминий – самый распространенный металл
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Домашнее заданиеПараграф 42 упр.4-7, стр.130Домашняя опытная работа
- 35. Проверочный тест Как изменяются металлические свойства
- 36. Проверочный тест Какой из перечисленных металлов легче всего окисляется на воздухе:1. Na;2. Al;3. Ca;4. Cu
- 37. Проверочный тест Какой из перечисленных металлов не
- 38. Проверочный тестКакое из перечисленных веществ не встречается
- 39. Проверочный тест Какой из перечисленных металлов
- 40. Спасибо за урок! Ребята, вы все МОЛОДЦЫ!!!
Слайд 1
«Алюминий. Нахождение в природе. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.
Слайд 2Захарова Надежда Васильевна, преподаватель химии и биологии
«Батыревский агропромышленный техникум» Минобразования Чувашии
Учитель
Слайд 3Данный урок разработан для проведения открытого урока по химии.
План:
1. Организационный момент.
2.
к раскрытию темы урока.
3. Раскрытие цели и план урока.
4. Ход урока.
5. Обобщение и закрепление.
6. Рефлексия.
7. Домашнее задание.
8. Заключительное слово преподавателя.
Слайд 4
Я – металл, серебристый и лёгкий,
и зовусь «самолётный металл»,
и покрыт
чтоб меня кислород не достал.
Слайд 5Al
«Алюминий – крылатый металл.
Н. Г. Чернышевский
Алюминий
Слайд 7
Задачи урока:
-дать характеристику алюминию как химическому элементу;
- Нахождение в природе
Слайд 8Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
Порядковый номер. Химический элемент III группы
В соединениях проявляет степень окисления
+13Al 1s2 2s2 2p6 3s2 3p1
+3
Слайд 9
План:
Положение алюминия в периодической системе химических элементов Д.И. Менделеева. Строение атома
Распространение и роль алюминия в природе.
Получение.
Физические свойства алюминия.
Химические свойства алюминия.
Важнейшие соединения алюминия.
Алюминий, его соединения и сплавы в жизни человека.
Слайд 10
Положение в периодической системе
IIIА группа
3 период
Электронная формула
1s2 2s2 2p6 3s2 3p1
Валентность III
Степень окисления +3
Ar= 27 Кристаллическая решетка- металлическая
Химическая связь-металлическая
Слайд 19Легенда
«Однажды к римскому императору Тиберию пришел незнакомец. В дар императору он
Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить, чтобы никто не узнал секрет его получения».
Слайд 20
«Серебро из глины»
Немецкий учёный
А.Сент-Клер Девиль.
Впервые получил алюминий промышленным способом (1855г.).
Слайд 22План характеристики
физических свойств алюминия:
Агрегатное состояние.
Цвет.
Плотность.
Температура плавления.
Пластичность.
Теплопроводность, электропроводность.
Слайд 23
Химические свойства алюминия:
Взаимодействует с простыми веществами
4Al+3O2 = 2Al2O3 + Q
2Al +
2Al + 3Cl2 = 2AlCl3
2Al + N2 = 2AlN - при нагревании
4Al + 3С = Al4С3 - при нагревании
Слайд 24
Взаимодействует со сложными веществами
2Al+ 6H2O= 2Al(OH)3 + 3H2
2Al + 3H2 SO4=
2Al + 6NaOH = 2Na[Al(OH)6] +3H2
Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и других 2Al + Cr2O3 = Al2O3 + 2Cr
Слайд 25 Химические свойства оксида алюминия: нерастворимые в воде, амфотереные, взаимодействует с кислотами и
Al2O3 + 6HCl = 2AlCl3 + 3H2O
сплавление
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Слайд 26Концентрированная серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла
Химические свойства
Слайд 28Алюминий –металл будущего!!!
Алюминий – самый распространенный металл земной коры. Его ресурсы
Обладает высокой коррозионной стойкостью и практически не нуждается в специальной защите.
Высокая химическая активность алюминия используется в алюминотермии.
Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве.
Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.
Слайд 34Домашнее задание
Параграф 42 упр.4-7, стр.130
Домашняя опытная работа (для желающих)
Пронаблюдайте изменения, происходящие
алюминиевая фольга + вода;
алюминиевая фольга + нашатырный спирт (NH4OH);
алюминиевая фольга + уксусная кислота (CH3COOH).
Сделайте выводы.
Слайд 35
Проверочный тест
Как изменяются металлические свойства в ряду элементов:
1. не изменяются;
2. ослабевают;
3. усиливаются;
4. изменяются периодически.
Слайд 36Проверочный тест
Какой из перечисленных металлов легче всего окисляется на воздухе:
1. Na;
2.
3. Ca;
4. Cu
Слайд 37Проверочный тест
Какой из перечисленных металлов не реагирует с водой даже
1. Mg;
2. Zn;
3. Fe;
4. Al.
Слайд 38Проверочный тест
Какое из перечисленных веществ не встречается в природе в самородном
1. Al;
2. Cu;
3. Ag;
4. Pt.
Слайд 39Проверочный тест
Какой из перечисленных металлов обладает амфотерными свойствами:
1. Cu;
2.
3. Na;
4. Ca.
Республиканский конкурс методических разработок ЕНД