- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к технокарте лекции Химические реакции
Содержание
- 1. Презентация к технокарте лекции Химические реакции
- 2. Химическая реакция - это процесс превращения исходных
- 3. Изменение качественного состава веществ 1. реакции, идущие
- 4. Изменение качественного состава веществ
- 5. 1а) Реакция аллотропизацииалмаз
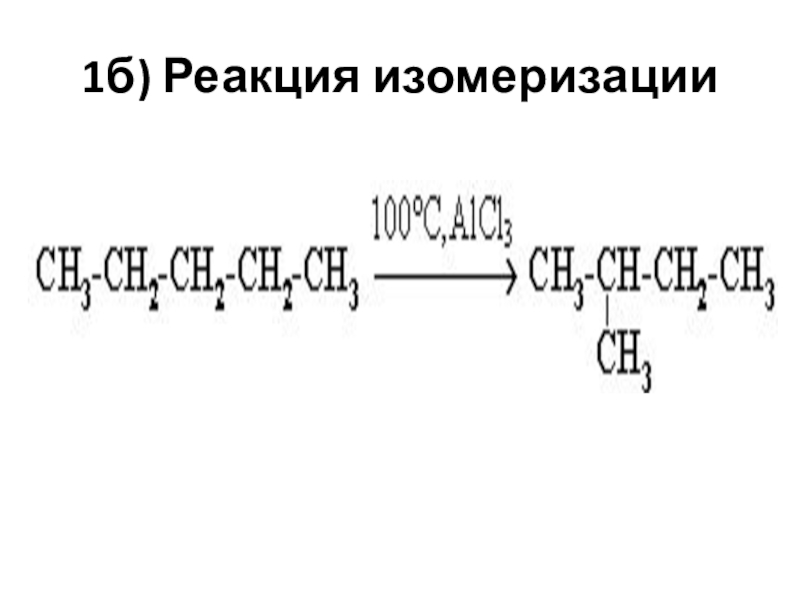
- 6. 1б) Реакция изомеризации
- 7. 1в) Реакция полимеризации n СH2 = СH2 →(- СH2- СH2 -)n
- 8. Изменение качественного состава веществ 2. реакции, идущие с изменением качественного состава веществ 2.12.22.32.42.52.6
- 9. 2. Реакции, идущие с изменением качественного состава
- 10. 2.1. по числу и составу реагирующих и образующихся веществ:а) соединенияб) разложенияв) замещенияг) обмена
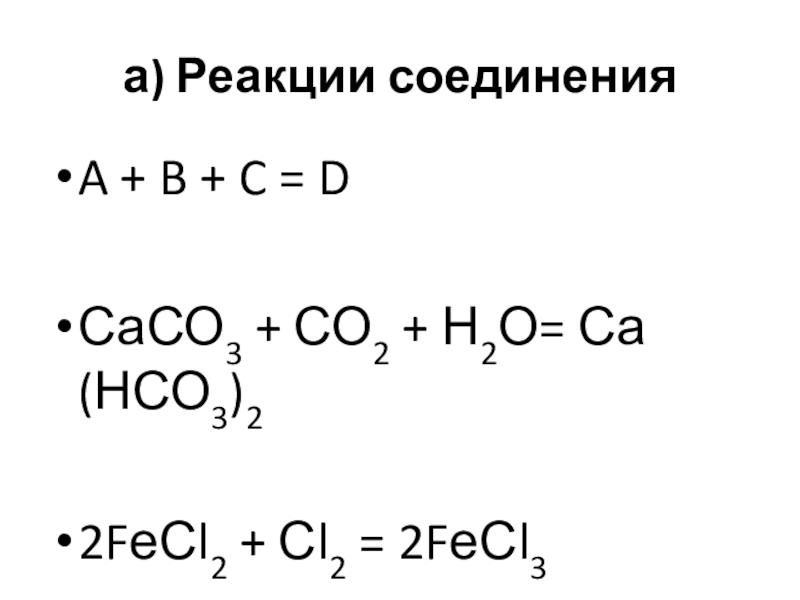
- 11. а) Реакции соединенияA + B + C = DСаСО3 + СО2 + Н2О= Са(НСО3)22FеСl2 + Сl2 = 2FеСl3
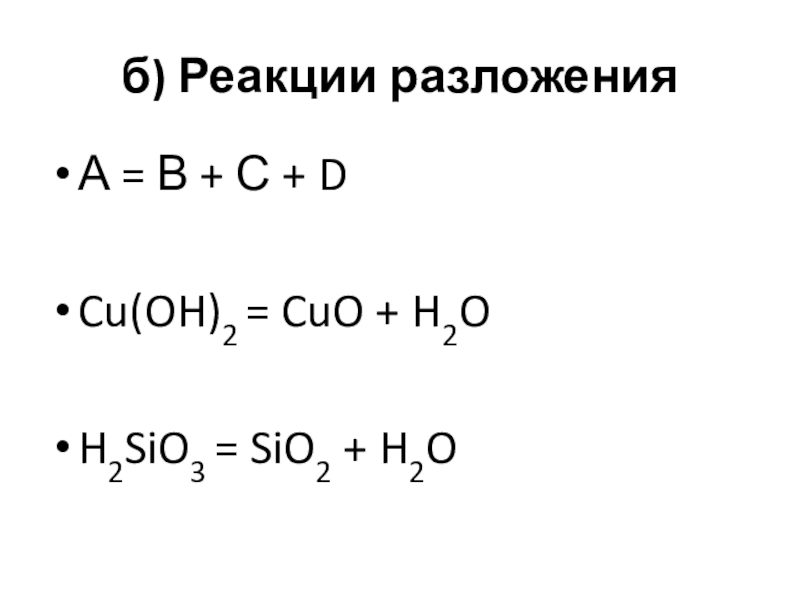
- 12. б) Реакции разложенияА = В + С + DCu(OH)2 = CuO + H2OH2SiO3 = SiO2 + H2O
- 13. в) Реакции замещенияА + ВС = АВ
- 14. г) Реакции обменаАВ + СD = АD
- 15. 2.2. по числу фаза) гетерогенные реакции -
- 16. 2.3. по изменению степеней окисленияа) окислительно-восстановительные
- 17. 2.4. по направлениюа) обратимые: А + В АВ
- 18. 2.5. по тепловому эффектуа) экзотермические Н2
- 19. 2.6. по использованию катализатораа) каталитическиеб) некаталитическиеZnO + Н2SО4 = ZnSО4 + Н2О
- 20. 2КСlО3(т)→ 2КСl (т)+ ЗО2 ↑реакция разложенияреакция гетерогеннаяреакция окислительно-восстановительная2К+1Сl+5О3-2 (т)→ 2К+1Сl-1 (т)+ ЗО20 ↑реакция необратимаяреакция эндотермическаяреакция некаталитическая
- 21. СaО(т) + 2HСl(р-р)→ CaСl2(р-р)+ H2О(г)реакция обменареакция гетерогеннаяреакция
Химическая реакция - это процесс превращения исходных веществ (реагентов) в продукты реакцииКлассификация - распределение на группы по сходным признакам
Слайд 2Химическая реакция - это процесс превращения исходных веществ (реагентов) в продукты
реакции
Классификация - распределение на группы по сходным признакам
Классификация - распределение на группы по сходным признакам
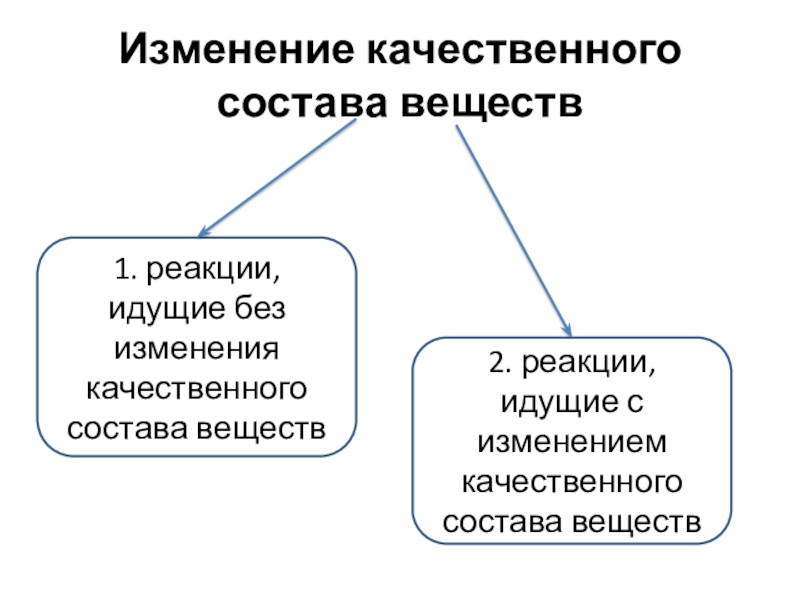
Слайд 3Изменение качественного состава веществ
1. реакции, идущие без изменения качественного состава
веществ
2. реакции, идущие с изменением качественного состава веществ
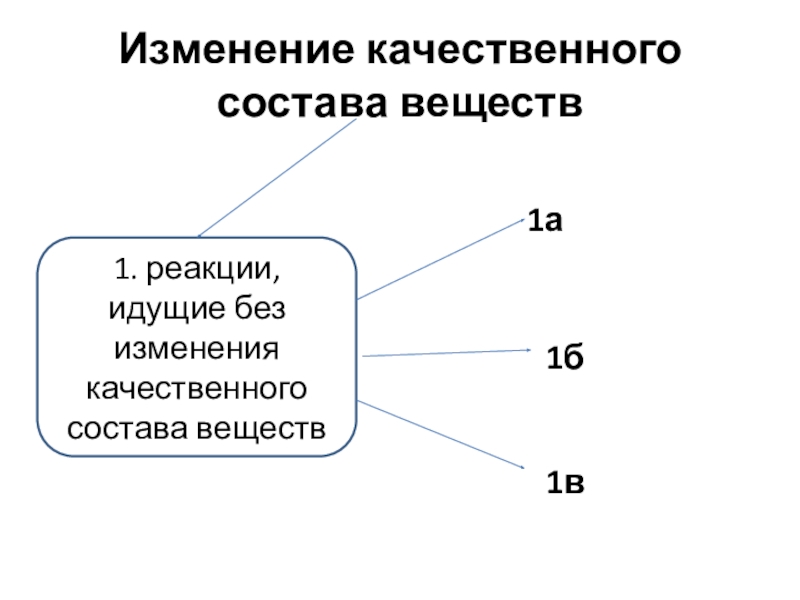
Слайд 4Изменение качественного состава веществ
1. реакции, идущие без изменения качественного состава веществ
1а
1б
1в
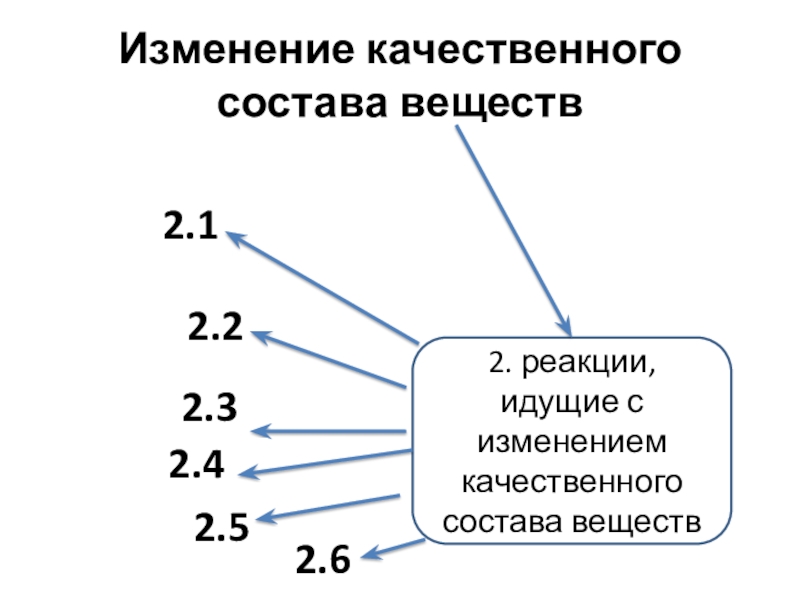
Слайд 8Изменение качественного состава веществ
2. реакции, идущие с изменением качественного состава
веществ
2.1
2.2
2.3
2.4
2.5
2.6
Слайд 92. Реакции, идущие с изменением качественного состава веществ
по числу и
составу реагирующих и образующихся веществ
по числу фаз
по изменению степеней окисления
по направлению
по тепловому эффекту
по использованию катализатора
по числу фаз
по изменению степеней окисления
по направлению
по тепловому эффекту
по использованию катализатора
Слайд 102.1. по числу и составу реагирующих и образующихся веществ:
а) соединения
б) разложения
в)
замещения
г) обмена
г) обмена
Слайд 152.2. по числу фаз
а) гетерогенные реакции - реакции, в которых реагенты
и продукты реакции находятся в разных фазах (агрегатных состояниях)
СO2(г) + СаО(тв) = СаСO3(тв)
б) гомогенные реакции - реакции, в которых реагенты и продукты реакции находятся в одинаковых фазах
3 NаОН + Н3РО4 = Nа3РО4 + 3 Н2О
протекают в газовой фазе и в растворах
СO2(г) + СаО(тв) = СаСO3(тв)
б) гомогенные реакции - реакции, в которых реагенты и продукты реакции находятся в одинаковых фазах
3 NаОН + Н3РО4 = Nа3РО4 + 3 Н2О
протекают в газовой фазе и в растворах
Слайд 162.3. по изменению степеней окисления
а) окислительно-восстановительные
Zn0 +
2H+1Сl→ Zn+2Сl2 + H20↑
б) не окислительно-восстановительные
Zn+2О-2 + 2H+1Сl-1 → Zn+2Сl2-1 + H2+1О-2
б) не окислительно-восстановительные
Zn+2О-2 + 2H+1Сl-1 → Zn+2Сl2-1 + H2+1О-2
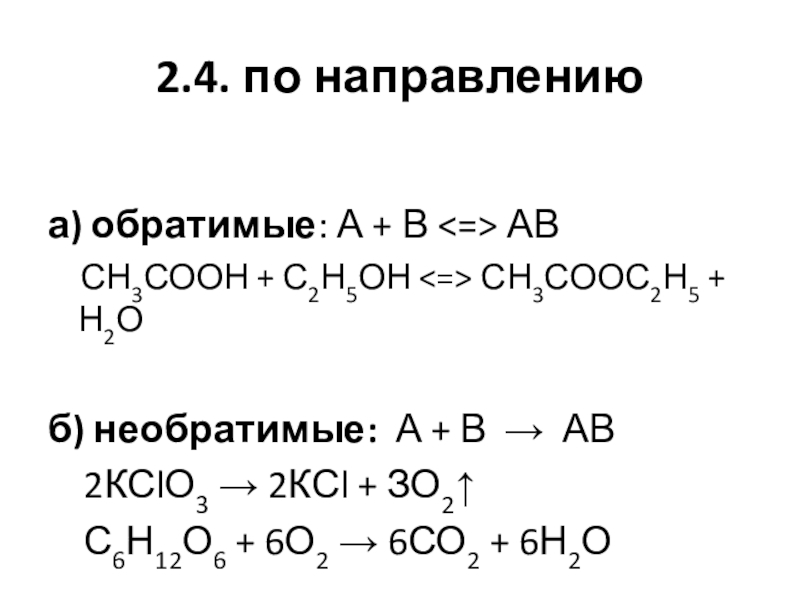
Слайд 172.4. по направлению
а) обратимые: А + В АВ
СН3СООН + С2Н5ОН СН3СООС2Н5 +
Н2О
б) необратимые: А + В → АВ
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2 + 6Н2О
б) необратимые: А + В → АВ
2КСlО3 → 2КСl + ЗО2↑
С6Н12О6 + 6О2 → 6СО2 + 6Н2О
Слайд 182.5. по тепловому эффекту
а) экзотермические
Н2 + Сl2 = 2НСl
+ 184,6 кДж
б) эндотермические
N2 + 02 = 2NO - 180,8 кДж
б) эндотермические
N2 + 02 = 2NO - 180,8 кДж
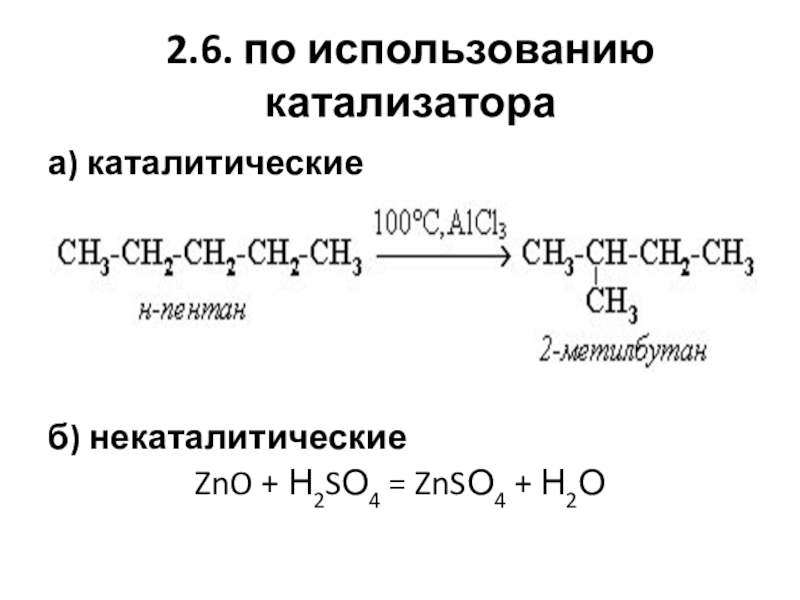
Слайд 192.6. по использованию катализатора
а) каталитические
б) некаталитические
ZnO + Н2SО4 = ZnSО4 + Н2О
Слайд 202КСlО3(т)→ 2КСl (т)+ ЗО2 ↑
реакция разложения
реакция гетерогенная
реакция окислительно-восстановительная
2К+1Сl+5О3-2 (т)→ 2К+1Сl-1 (т)+ ЗО20
↑
реакция необратимая
реакция эндотермическая
реакция некаталитическая
реакция необратимая
реакция эндотермическая
реакция некаталитическая
Слайд 21СaО(т) + 2HСl(р-р)→ CaСl2(р-р)+ H2О(г)
реакция обмена
реакция гетерогенная
реакция неокислительно-восстановительная
Сa+2О-2 + 2H+1Сl-1 →
Ca+2Сl2-1 + H2+1О-2
реакция необратимая
реакция экзотермическая
реакция некаталитическая
реакция необратимая
реакция экзотермическая
реакция некаталитическая