Сколько кислорода (в литрах при
н.у.) можно получить из каждого?
(5 минут)
1 вар. 2KMnO4=K2MnO4+MnO2+O2 ↑
2 вар. 2KClO3=2KCl+3O2 ↑
3 вар. 2KNO3=2KNO2+O2 ↑
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к открытому уроку Сера (9 класс)
Содержание
- 1. Презентация к открытому уроку Сера (9 класс)
- 2. СЕРА S 1s22s22p63s23p4 2ē8ē6ē
- 3. Твердое кристаллическое вещество желтого цвета, нерастворима в
- 4. Строение атома серы
- 5. Химические свойства Окислительные свойства серы (S0 +
- 6. Химические свойства Восстановительные свойства сера проявляет в
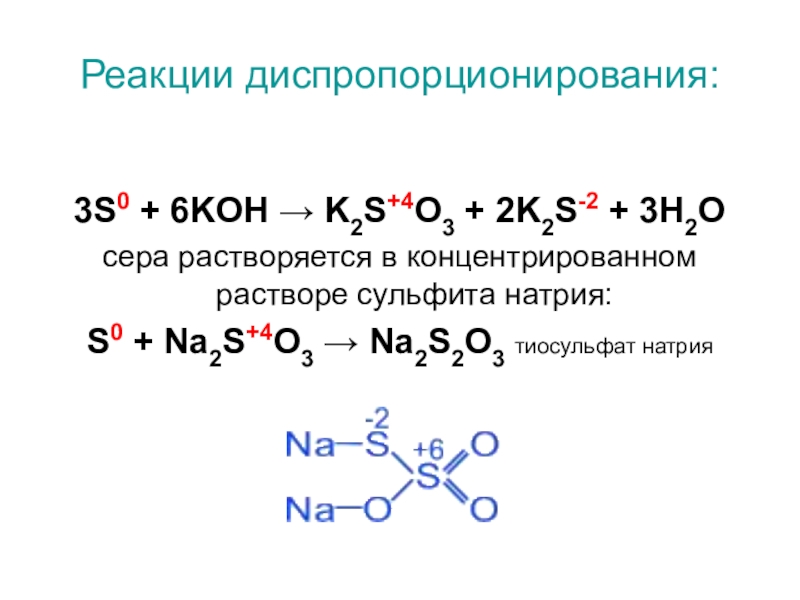
- 7. Реакции диспропорционирования:3S0 + 6KOH → K2S+4O3 +
- 8. Сера в природеСероводород H2SЦинковая обманка ZnSКиноварь HgSСвинцовый блеск PbSПирит FeS2Глауберова соль Na2SO4*10H2OГипс CaSO4*2H2O
- 9. В зернохранилищах для истребления насекомых сжигают серу,
СЕРА S 1s22s22p63s23p4 2ē8ē6ē
Слайд 3Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается
(плавает на поверхности), t°кип = 445°С
Аллотропия
- ромбическая (α - сера) - S8
t°пл. = 113°C; ρ = 2,07 г/см3
Наиболее устойчивая модификация.
- моноклинная (β - сера) - темно-желтые иглы
t°пл. = 119°C; ρ = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
- пластическая - коричневая резиноподобная (аморфная) масса
неустойчива, при затвердевании превращается в ромбическую.
Слайд 5Химические свойства
Окислительные свойства серы (S0 + 2ē → S-2)
Сера реагирует со
щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S –t°→ Al2S3
Zn + S –t°→ ZnS
С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S –t°→ Al2S3
Zn + S –t°→ ZnS
С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Слайд 6Химические свойства
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
S
- 2ē → S+2; S - 4ē → S+4; S - 6ē → S+6
с кислородом:
S + O2 –t°→ S+4O2
2S + 3O2 –t°;Рt→ 2S+6O3
c галогенами (кроме йода):
S + Cl2 → S+2Cl2
c кислотами - окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
с кислородом:
S + O2 –t°→ S+4O2
2S + 3O2 –t°;Рt→ 2S+6O3
c галогенами (кроме йода):
S + Cl2 → S+2Cl2
c кислотами - окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Слайд 7Реакции диспропорционирования:
3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
сера растворяется
в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия
Слайд 8Сера в природе
Сероводород H2S
Цинковая обманка ZnS
Киноварь HgS
Свинцовый блеск PbS
Пирит FeS2
Глауберова соль
Na2SO4*10H2O
Гипс CaSO4*2H2O
Гипс CaSO4*2H2O
Слайд 9В зернохранилищах для истребления насекомых сжигают серу, исходя из нормы 24
г на 1 м3 помещения. Рассчитайте, сколько килограмм оксида серы (IV) должно получиться при газации помещения 100 м3
Напишите уравнения реакций
S → SO2 → SO3 → H2SO4 → CaSO4
Напишите уравнения реакций
S → SO2 → SO3 → H2SO4 → CaSO4