- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к открытому уроку по теме белки
Содержание
- 1. Презентация к открытому уроку по теме белки
- 2. “Химик не такой должен быть, который дальше
- 3. Сформировать представление о строении белков
- 4. Учащиеся должны уметь характеризировать
- 5. 1.Что такое белки?2.Из каких веществ образуются белки?3.Сколько
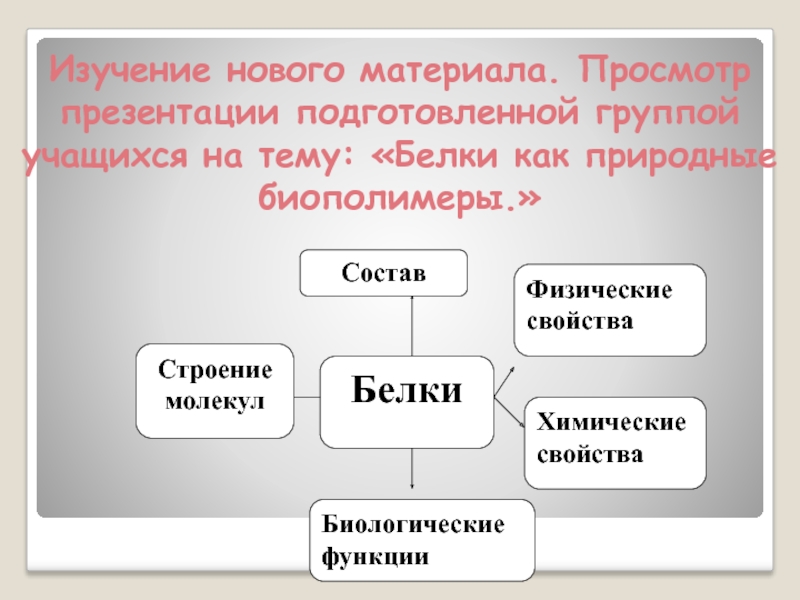
- 6. Изучение нового материала. Просмотр презентации подготовленной группой учащихся на тему: «Белки как природные биополимеры.»
- 7. Цветные реакции на белки.
- 8. БиуретоваяБелок + Cu(OH)2 → фиолетовая окраска →реакция
- 9. 1. В растворах белки обнаруживают очень низкое
- 10. 7. Склонность к денатурации, осаждению8. Способность к
- 11. Белки, как и аминокислоты амфотерны, благодаря наличию
- 12. Денатурация белковВ основе денатурации лежат глубокие внутримолекулярные
- 13. Обратимая(под действием концентрированного раствора NаСl)Необратимая(под действием солей
- 14. Взаимодействие белков с водой, в ходе которого белок утрачивает свою первичную структуру Гидролиз белков
- 15. Первый белок, очищенный от примесей был получен
- 16. Ф.Энгельс “Повсюду, где мы втречаем жизнь,
- 17. В 1934г. Лайнус Полинг
- 18. Это высокомолекулярные природные полимеры, состоящие из α-аминокислот, соединенных между собой пептидными связямиБЕЛКИ (ПРОТЕИНЫ)
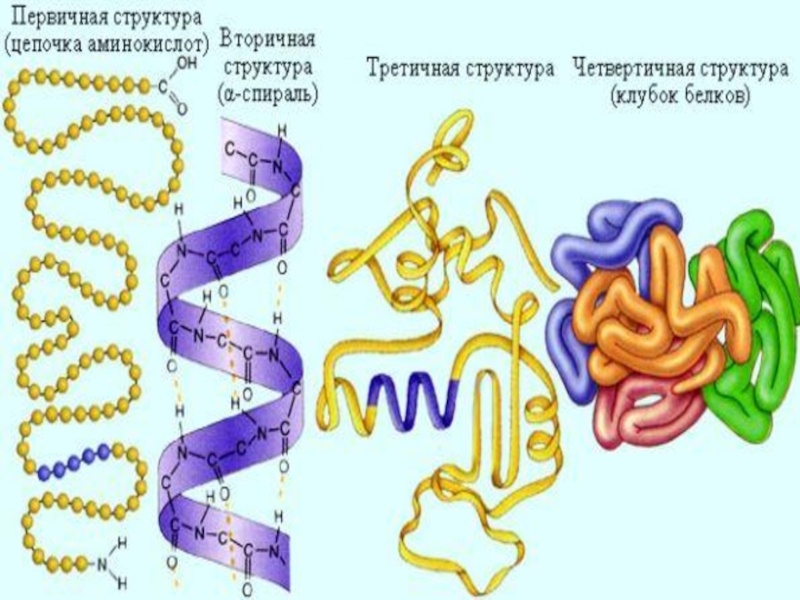
- 19. 4 уровня структурной организации белков:УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВПервичная ВторичнаяТретичнаяЧетвертичная
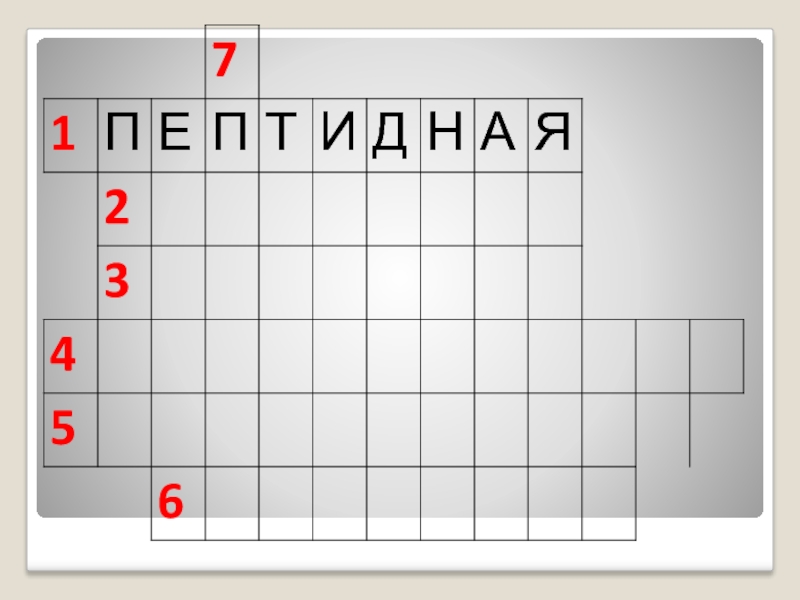
- 20. линейная последовательность аминокислот в полипептидной цепи. Стабилизирована ковалентными пептидными связямиПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ -
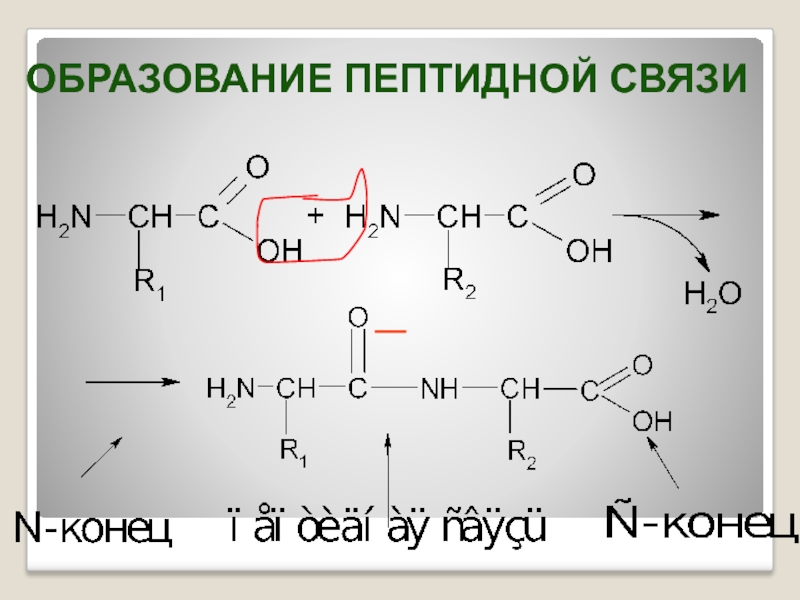
- 21. ОБРАЗОВАНИЕ ПЕПТИДНОЙ СВЯЗИ
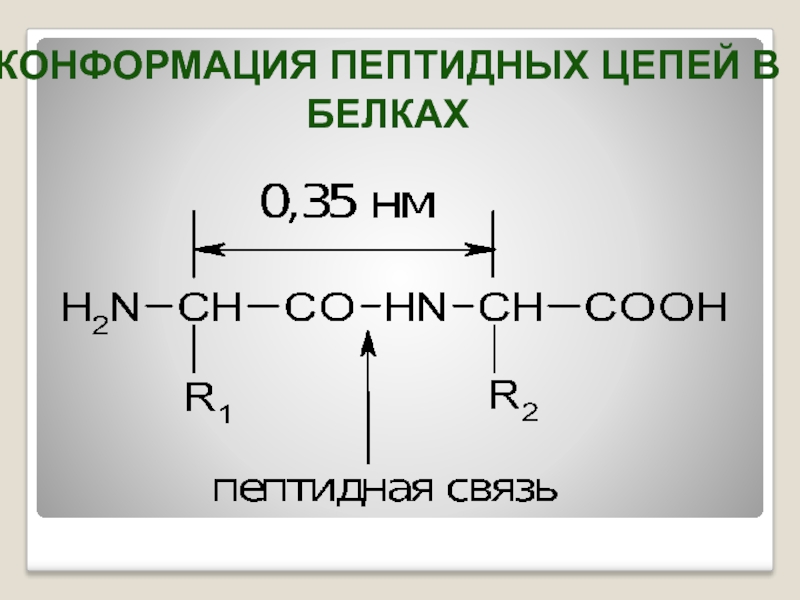
- 22. КОНФОРМАЦИЯ ПЕПТИДНЫХ ЦЕПЕЙ В БЕЛКАХ
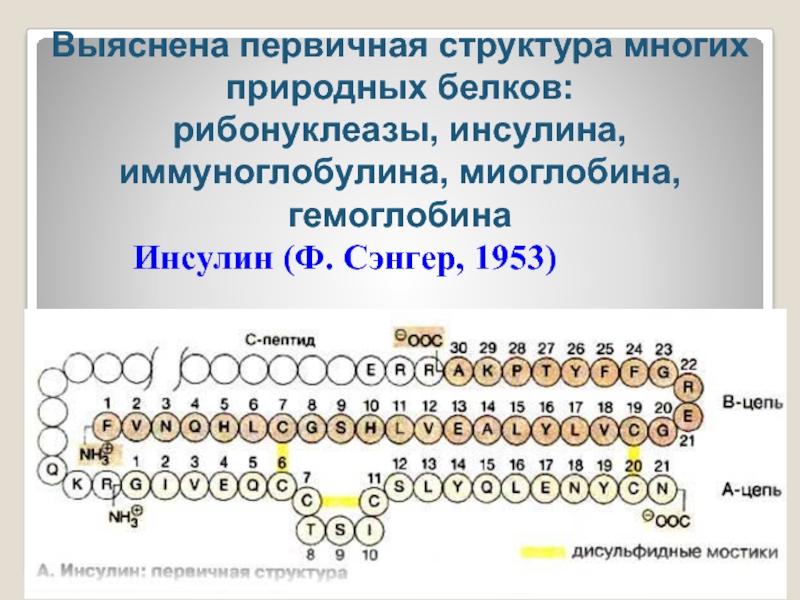
- 23. Инсулин (Ф. Сэнгер, 1953)Выяснена первичная структура многих природных белков: рибонуклеазы, инсулина, иммуноглобулина, миоглобина, гемоглобина
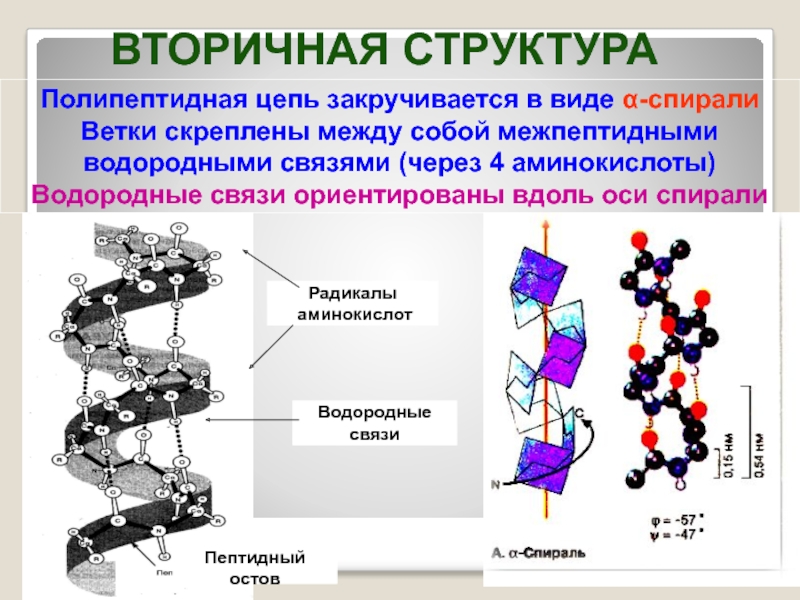
- 24. Полипептидная цепь закручивается в виде α-спирали Ветки
- 25. трехмерная пространственная структура, образующаяся за счет
- 26. – представляет собой олигомерный белок, состоящий
- 27. Слайд 27
- 28. Фибриллярныеферменты, гемоглобин, миоглобинГлобулярные коллаген, миозинПо форме молекул белки делятся на 2 группы:
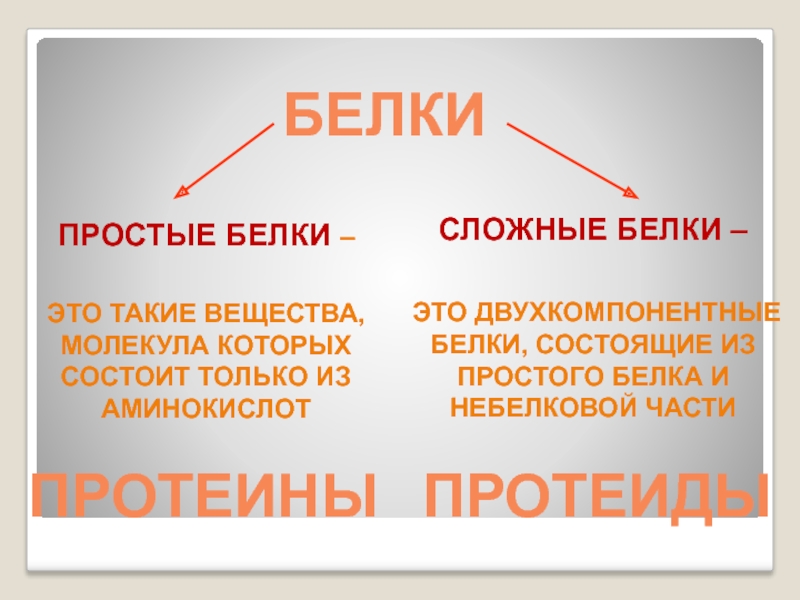
- 29. БЕЛКИСЛОЖНЫЕ БЕЛКИ – ЭТО ДВУХКОМПОНЕНТНЫЕ БЕЛКИ, СОСТОЯЩИЕ
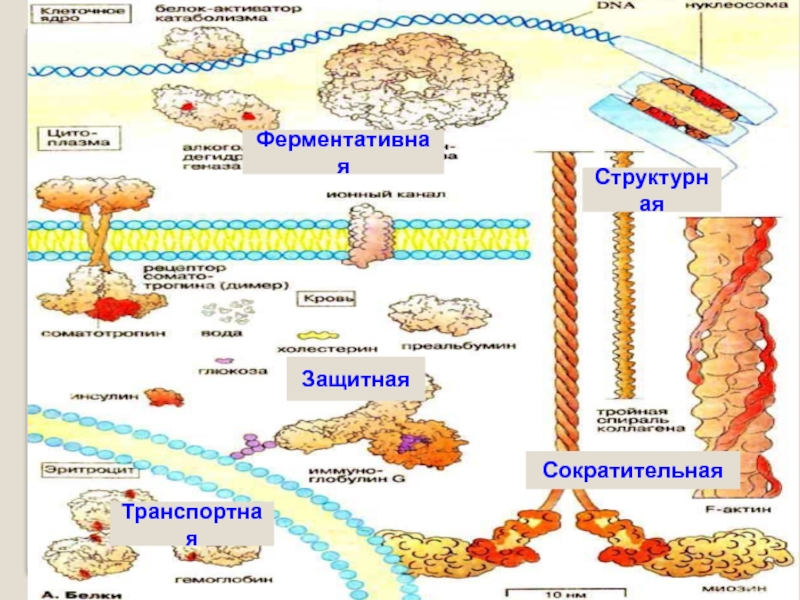
- 30. Биологическое значение белковСтруктурнаяСократительнаяЗащитнаяФерментативнаяТранспортная
- 31. Слайд 31
- 32. 1.Связь, образующая первичную структуру белка?
- 33. Слайд 33
- 34. 2.Белки имеют большую атомною массу, т.к. представляют собой…
- 35. Слайд 35
- 36. 3.Растворимый в воде белок куриного яйца?
- 37. Слайд 37
- 38. 4.Мономер для синтеза белка?
- 39. Слайд 39
- 40. 5.Разрушение молекулы белка до первичной структуры?
- 41. Слайд 41
- 42. 6.Растворимый в воде белок?
- 43. Слайд 43
- 44. 7.Фамилия ученого, получившего Нобелевскую за изучение вторичной структуры белка?
- 45. Слайд 45
- 46. Задача. Определите формулу аминокислоты, если
- 47. Изобрази структурные формулы веществ:1. а: 2-аминопропановая
- 48. Выставление оценокДомашнее задание.1.Параграф учебника(устно)2. Письменно:А) Синтезировать трипептид из написаных аминокислотБ) Написать уравнение реакции гидролиза любого трипептида.
Слайд 2“Химик не такой должен быть, который дальше дыму и пеплу ничего
М.В.Ломоносов
ДЕВИЗ УРОКА:
Слайд 3 Сформировать представление о строении белков как природных биополимерах.
Раскрыть особенности физических и химических свойств белков на примере белка куриного яйца.
Рассмотреть биологическое значение этого класса органических веществ.
Цели и задачи обучения:
Слайд 4 Учащиеся должны уметь характеризировать различные структуры белка, перечислять
С помощью уравнений реакций и схем объяснять химические свойства белков
Раскрывать огромную биологическую роль этого класса органических веществ.
ПЛАНИРУЕМЫЕ РЕЗУЛЬТАТЫ:
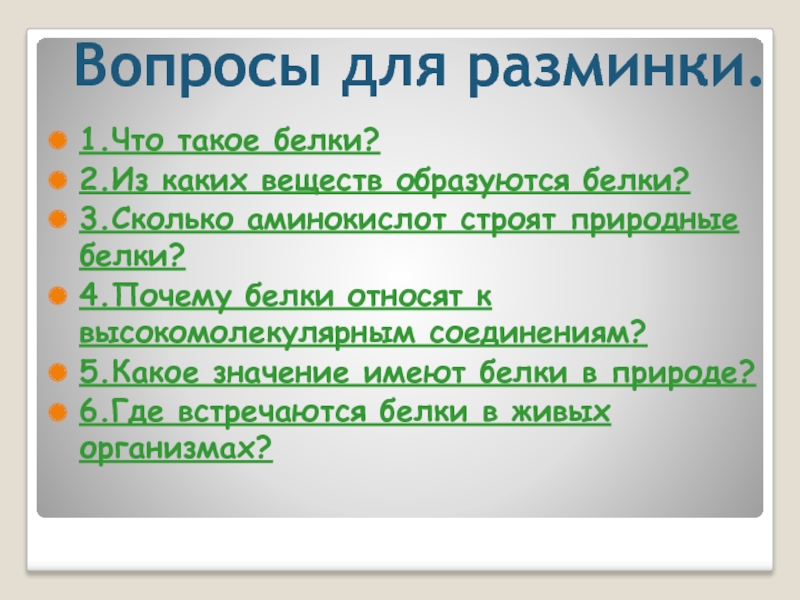
Слайд 51.Что такое белки?
2.Из каких веществ образуются белки?
3.Сколько аминокислот строят природные белки?
4.Почему
5.Какое значение имеют белки в природе?
6.Где встречаются белки в живых организмах?
Вопросы для разминки.
Слайд 6Изучение нового материала. Просмотр презентации подготовленной группой учащихся на тему: «Белки
Слайд 7 Цветные реакции на белки.
Опыты проводят выбранные лаборанты
Опыт№1
Биуретовая реакция.
Оборудование: ящик для практических работ, пробирка с раствором белка, склянка с раствором NaOH, склянка с раствором CuSO4 ,чистая пробирка.
Опыт№2
Ксантопротеиновая реакция.
Оборудование: пробирка с раствором белка, склянка с концентратом HNO3 ,чистая пробирка для анализа, спиртовка.
Результаты оформить в тетради.
Демонстрационные опыты
Слайд 8Биуретовая
Белок + Cu(OH)2 → фиолетовая окраска →
реакция на пептидные связи
Ксантопротеиновая
Белок +
реакция на ароматические циклы
Фоля
Белок + Pb(NO3)2 +NaOH → черный осадок → реакция на серу
Цветные реакции на белки
Слайд 91. В растворах белки обнаруживают очень низкое осмотическое давление
2. Незначительная способность
3. Высокой вязкость
4. Набухание в очень больших пределах с образованием гелей и студней
5. Способность к адсорбции
6. Амфотерность
Белки представляют собой наиболее сложные коллоидные соединения
Слайд 10
7. Склонность к денатурации, осаждению
8. Способность к гидролизу с
расщеплением пептидных
9. Растворы белков обладают способностью к светорассеянию и способностью к поглощению УФ-излучения при 280 нм
Белки представляют собой наиболее сложные коллоидные соединения
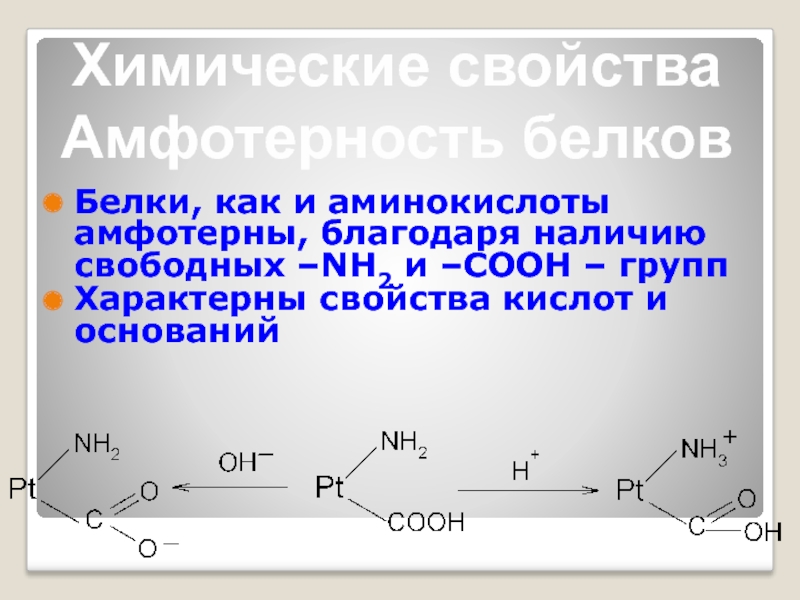
Слайд 11Белки, как и аминокислоты амфотерны, благодаря наличию свободных –NH2 и –СООН
Характерны свойства кислот и оснований
Химические свойства
Амфотерность белков
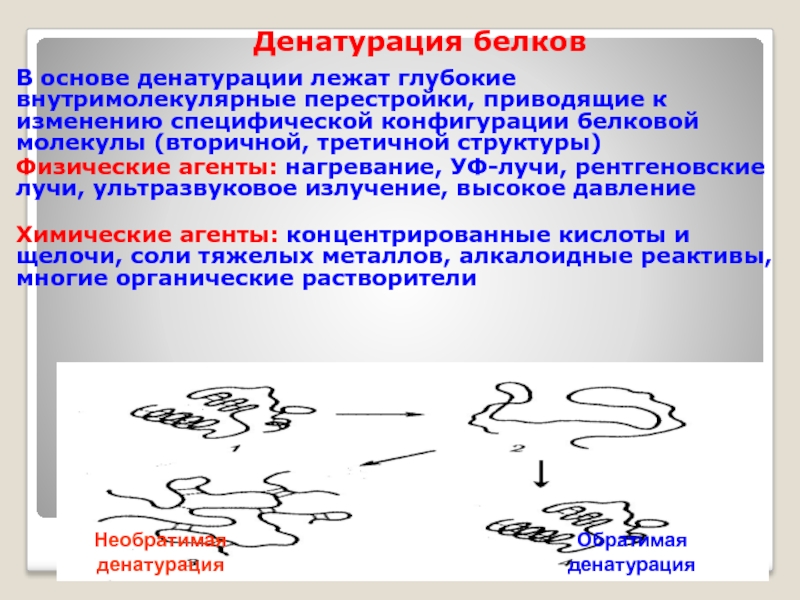
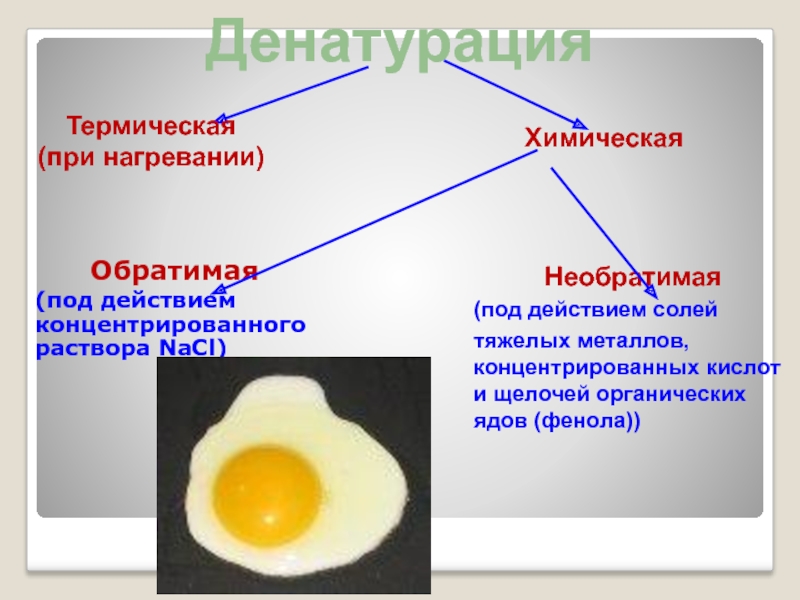
Слайд 12Денатурация белков
В основе денатурации лежат глубокие внутримолекулярные перестройки, приводящие к изменению
Физические агенты: нагревание, УФ-лучи, рентгеновские лучи, ультразвуковое излучение, высокое давление
Химические агенты: концентрированные кислоты и щелочи, соли тяжелых металлов, алкалоидные реактивы, многие органические растворители
Обратимая денатурация
Необратимая денатурация
Слайд 13Обратимая
(под действием концентрированного раствора NаСl)
Необратимая
(под действием солей
тяжелых металлов, концентрированных кислот
Термическая
(при нагревании)
Химическая
Денатурация
Слайд 14Взаимодействие белков с водой, в ходе которого белок утрачивает свою первичную
Гидролиз белков
Слайд 15Первый белок, очищенный от примесей был получен в 1728 г. Я.
Это был белок пшеничного зерна - клейковина
Белки стали называть
протеинами
(от греческого protos – первый)
ИСТОРИЯ ОТКРЫТИЯ БЕЛКА
Слайд 16
Ф.Энгельс
“Повсюду, где мы втречаем жизнь, мы находим, что она
Слайд 17
В 1934г. Лайнус Полинг совместно с А.Е.Мирски сформулировал
В 1936г. он положил начало изучению атомной и молеулярной структуры белков и аминокислот с применением рентгеновской кристаллографии.
Лайнус Полинг
Слайд 18Это высокомолекулярные природные полимеры, состоящие из α-аминокислот, соединенных между собой пептидными
БЕЛКИ (ПРОТЕИНЫ)
Слайд 194 уровня структурной организации белков:
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВ
Первичная
Вторичная
Третичная
Четвертичная
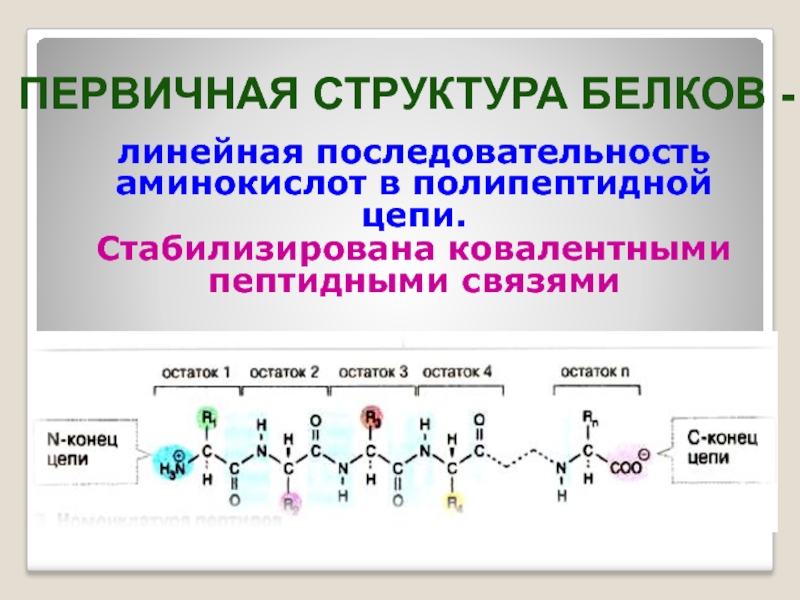
Слайд 20линейная последовательность аминокислот в полипептидной цепи.
Стабилизирована ковалентными пептидными связями
ПЕРВИЧНАЯ СТРУКТУРА
Слайд 23Инсулин (Ф. Сэнгер, 1953)
Выяснена первичная структура многих природных белков:
рибонуклеазы, инсулина, иммуноглобулина,
Слайд 24Полипептидная цепь закручивается в виде α-спирали
Ветки скреплены между собой межпептидными
водородными связями (через 4 аминокислоты)
Водородные связи ориентированы вдоль оси спирали
Пептидный остов
Радикалы
аминокислот
Водородные
связи
ВТОРИЧНАЯ СТРУКТУРА
Слайд 25 трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, которые
Стабилизирована ионными, водородными, гидрофобными связями, дисульфидными связями
ТРЕТИЧНАЯ СТРУКТУРА –
Слайд 26 – представляет собой олигомерный белок, состоящий из нескольких полипептидных цепей
Например, гемоглобин-это сложный белок, состоящий из четырех полипептидных цепей, соединенных четырьмя гемами-небелковыми образованиями.
Стабилизирована ионными, водородными, гидрофобными связями
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
Слайд 28Фибриллярные
ферменты, гемоглобин, миоглобин
Глобулярные
коллаген, миозин
По форме молекул
белки делятся на 2
Слайд 29БЕЛКИ
СЛОЖНЫЕ БЕЛКИ –
ЭТО ДВУХКОМПОНЕНТНЫЕ БЕЛКИ, СОСТОЯЩИЕ ИЗ ПРОСТОГО БЕЛКА И
ПРОСТЫЕ БЕЛКИ –
ЭТО ТАКИЕ ВЕЩЕСТВА, МОЛЕКУЛА КОТОРЫХ СОСТОИТ ТОЛЬКО ИЗ АМИНОКИСЛОТ
ПРОТЕИНЫ
ПРОТЕИДЫ
Слайд 46
Задача.
Определите формулу аминокислоты, если массовые доли углерода, водорода,
Слайд 47Изобрази структурные формулы веществ:
1. а: 2-аминопропановая кислота
2. б: 2-амино-2-метилпропановая кислота
в: 2-аминобутановая кислота
3. г: 2-аминопентановая кислота
д: 2-амино-3,3-диметилпропановая кислота
Проверь себя: