- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к обобщающему уроку
Содержание
- 1. Презентация к обобщающему уроку
- 2. химическая формула простого вещества химический знакОО2относительнаяатомная массаотносительнаяатомная массаотносительнаямолекулярная массаМr (O) =32Аr (O) =16
- 3. Кислород - это самый распространённый элемент на
- 4. ОН всюду и везде:В камне, в воздухе,
- 5. Кислород - газ без цвета, вкуса и
- 6. Джозеф Пристли ( 1733 – 1804 )
- 7. Открытие кислорода присваивается Джозефу Пристли.А история простая…Джозеф
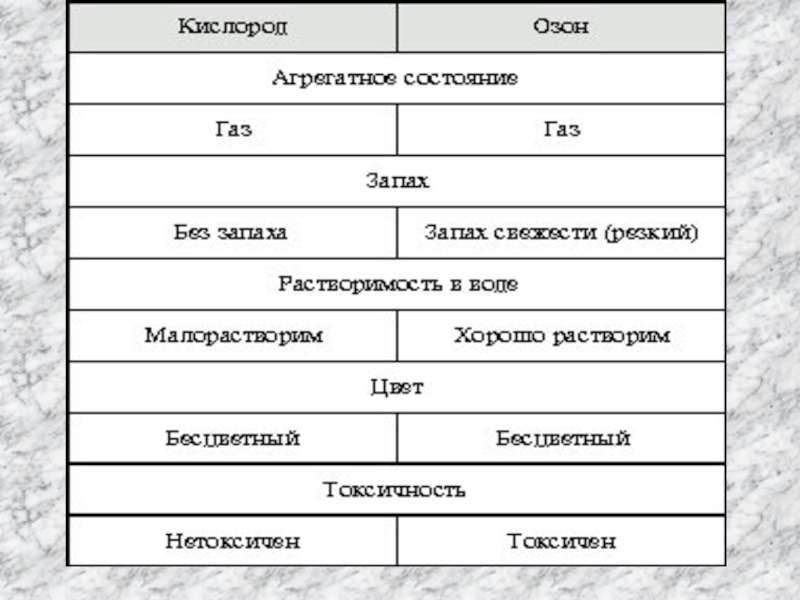
- 8. В природеВ лабораторииФизические свойства: газ голубого цвета,
- 9. Молекула кислородаМолекула озона
- 10. Без аллотропных проявлений Нельзя представить кислород. За
- 11. Слайд 11
- 12. Химические свойстваКислород – обеспечивает протекание в воздушной
- 13. Химические свойства кислорода
- 14. 1- С неметаллами. При нагревании кислород взаимодействует
- 15. Слайд 15
- 16. Получение кислородаВ лаборатории:1. Разложением перманганата калия при
- 17. Слайд 17
- 18. Сравнение процессов горения и медленного окисления
- 19. Кислород очень широко используется в технике, металлургии
- 20. Выберете формулы оксидов:1.HNO3; H2SO4; SО2; CO ;
- 21. 1вариант
- 22. Спасибо за внимание
Слайд 2химическая формула
простого вещества
химический знак
О
О
2
относительная
атомная масса
относительная
атомная масса
относительная
молекулярная масса
Мr (O) =32
Аr
Слайд 3Кислород - это самый распространённый
элемент на Земном шаре
Воздух, которым мы
В морях и океанах содержится 85,8% кислорода
Кислород входит в состав растений (около 40%),
В состав животных (около 20%)
Тело человека примерно на 65% состоит из кислорода
Массовая доля кислорода в земной коре примерно 49%.
Слайд 4ОН всюду и везде:
В камне, в воздухе, в воде
Он и в
И в небес голубизне...
Он всюду и везде:
В камне, в воздухе, в воде
Он и в утренней росе
И в небес голубизне...
Слайд 5Кислород - газ без цвета, вкуса и запаха, мало растворим
При температуре -183C кислород образуется в синеватую жидкость, а при -219C превращается в темно-синие кристаллы.
Температура кипения –183 °С
Температура плавления –219 °C
Относительная плотность по воздуху 1,1
Физические свойства
Слайд 6Джозеф Пристли
( 1733 – 1804 ) Получил кислород из оксида
Карл Шееле
( 1742 – 1786 ) Установил, что воздух
состоит из кислорода и азота ( 1772 г.)
Слайд 7Открытие кислорода
присваивается Джозефу Пристли.
А история простая…
Джозеф Пристли как-то раз
Окись ртути
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нём свеча горит.
Новый газ из колбы вышел –
никому он не знаком.
Этим газом дышат мыши
под стеклянным колпаком,
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части»
Эта мысль весьма нова
Здесь у химика от счастья
Закружилась голова
2HgO 2Hg + O2
Слайд 8В природе
В лаборатории
Физические свойства: газ голубого цвета, с запахом свежести ,
Аллотропное видоизменение
кислорода – озон О3
3О2 = 2О3
Слайд 10Без аллотропных проявлений
Нельзя представить кислород.
За счет незримых построений
Два
Одно нам хорошо известно:
Газообразный кислород,
Которым дышат, скажем честно,
И человек и бегемот.
Из элемента кислорода
(обозначают знаком О)
Еще придумала природа
Одно простое вещество,
Которое зовут озоном.
И в этом есть большой резон:
В грозу запахнет над газоном –
От слова «пахнущий» - озон.
Как по составу различают
Два аллотропных вещества?
03 - озон обозначают,
А кислород - всего О2
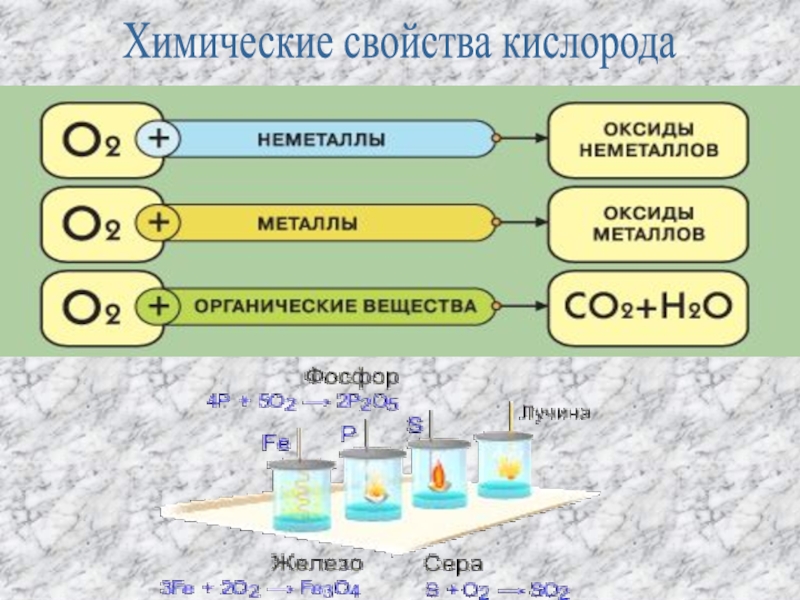
Слайд 12Химические свойства
Кислород – обеспечивает протекание в воздушной среде множества химических процессов.
Наиболее известный из них – горение. (при этом выделяется теплота и свет)
Взаимодействие веществ с кислородом называется реакцией окисления этих веществ
Слайд 141- С неметаллами.
При нагревании кислород взаимодействует с водородом, серой, углеродом,
2Н2 + О2 = 2Н2О С + O2 = СO2
S + O2 = SO2 4Р + 5О2 = 2Р2О5
С галогенами кислород в реакцию не вступает.
2- С металлами.
Очень активно взаимодействуют с кислородом щелочные и щелочноземельные металлы с образованием оксидов и пероксидов:
4К + О2 = 2К2О ( KO2) Ba + O2 = BaO2
С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg + O2 = 2MgO
Некоторые металлы в обычных условиях окисляются лишь с поверхности, так как образующаяся пленка оксида защищает металл. При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления ( ~400C) железные стружки сгорают в кислороде:
3Fe + 2O2 = Fe3O4
3- В кислороде горят также сложные вещества с образованием соответствующих оксидов:
CH4 + 2O2 = CO2 + 2H2O
Слайд 16Получение кислорода
В лаборатории:
1. Разложением перманганата калия при нагревании:
2KMnO4 = K2MnO4 +
Также в аналогичных реакциях разложения используют сурик Pb3O4, оксид ртути HgO, бертолетову соль КСlO3.
2. Разложением пероксида водорода:
2H2O2 = 2H2O + O2
В природе кислород образуется в результате процесса фотосинтеза:
6CO2 + 6H2O = C6H12O6 + 6O2
В промышленности:
1. Сжижением воздуха с помощью холодильных машин, далее, используя различие температур кипения кислорода (-183C) и азота (-196C), выделяют кислород.
2. Чистый кислород получают электролизом воды. Это очень дорогой метод и поэтому мало распространен.
2H2O = 2H2 + O2
Слайд 19Кислород очень широко используется в технике, металлургии ( при выплавке чугуна
Слайд 20
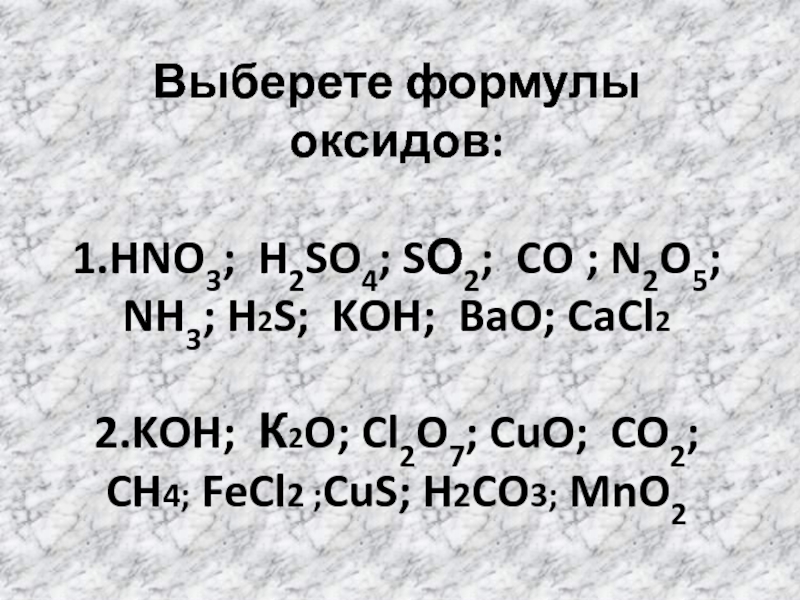
Выберете формулы оксидов:
1.HNO3; H2SO4; SО2; CO ; N2O5; NH3; H2S; KOH;
2.KOH; К2O; Cl2O7; CuO; CO2;
CH4; FeCl2 ;CuS; H2CO3; MnO2
Слайд 21
1вариант
а) Zn +….→ ZnO а) … + O2 → HO
б)… + O2 → AlO б) P + ….→ PVO
Допишите и уравняйте уравнения