- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к лабораторной работе по химии Скорость химических реакций
Содержание
- 1. Презентация к лабораторной работе по химии Скорость химических реакций
- 2. Цель: изучить влияние концентрации реагирующих веществ на
- 3. Экспериментальная часть
- 4. Опыт№1 «Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе»
- 5. Реакция взаимодействия тиосульфата натрия с серной кислотой
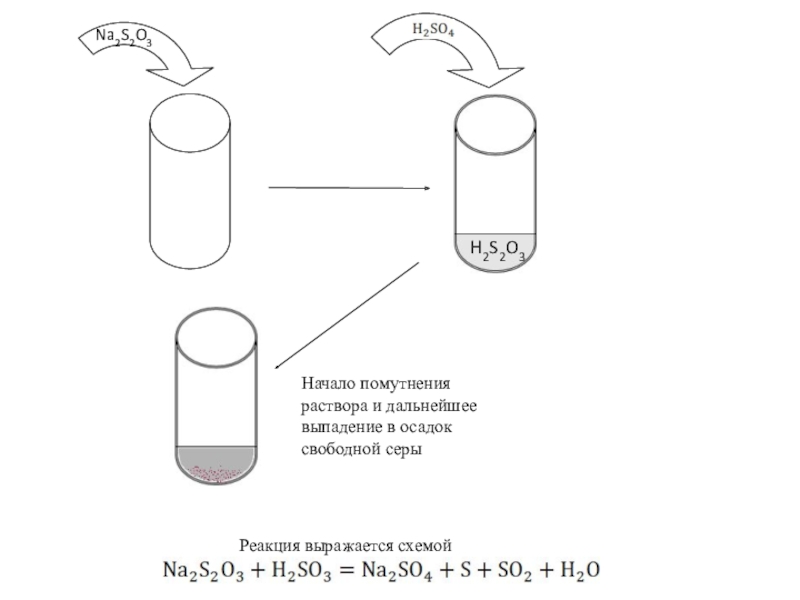
- 6. Na2S2O3 H2S2O3Реакция выражается схемойНачало помутнения раствора и дальнейшее выпадение в осадок свободной серы
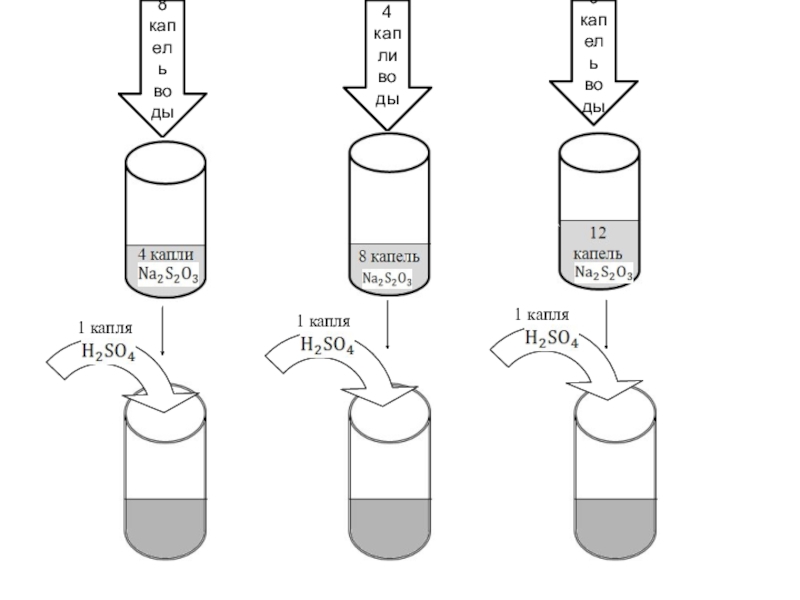
- 7. 8 капель воды4 капли воды0 капель воды1 капля1 капля1 капля
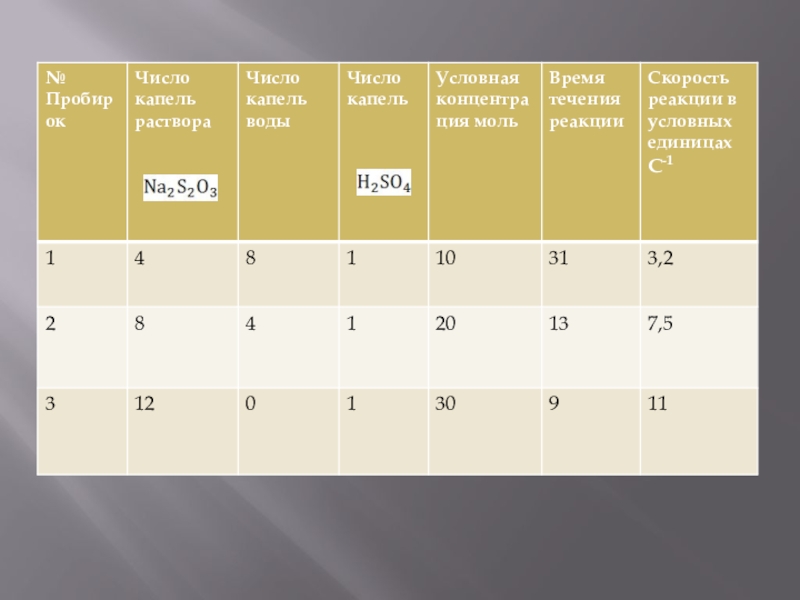
- 8. Слайд 8
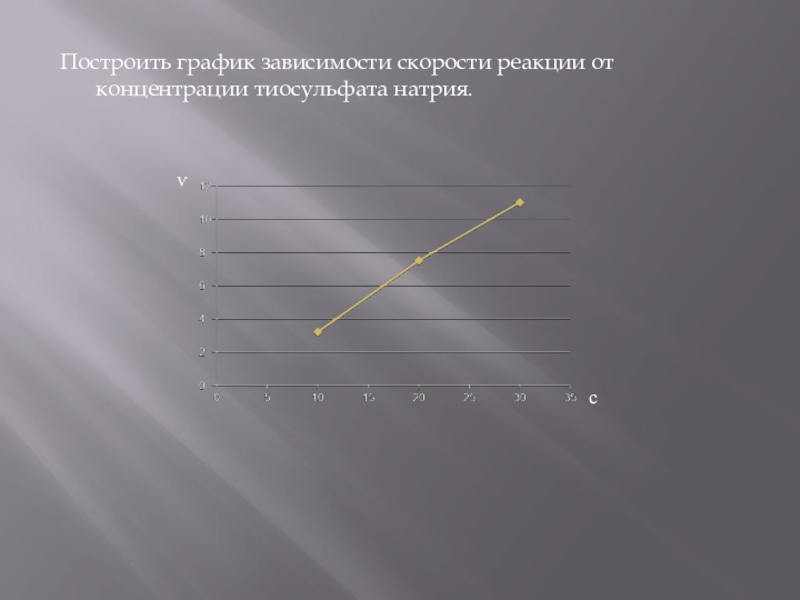
- 9. Построить график зависимости скорости реакции от концентрации тиосульфата натрия. ѵс
- 10. Написать кинетическое уравнение реакции.Сделать вывод о влиянии
- 11. Опыт№2«Смещение химического равновесия путем изменения концентраций исходных и образующихся веществ»
- 12. В пробирку внести по 5 капель разбавленной(0,0025н.)
- 13. FeCl3KCNSKCNSKCNSKCNSKCNSKCNSЭТАЛОН FeCl3 +3KCNS= 3KCl+ Fe(CNS)3FeCl3
- 14. Слайд 14
- 15. Слайд 15
- 16. Написать выражение константы равновесия данного процесса. На
- 17. Контрольные вопросыЧем отличаются гомогенные реакции от гетерогенных?Какие
- 18. ТЕСТ
- 19. 1.Во сколько раз изменится объем выделяющегося водорода
- 20. 5.В какой реакции повышение давления в системе
Цель: изучить влияние концентрации реагирующих веществ на скорость и направление реакции.Задание:Изучить теорию скорости (кинематики )химических реакцийИзучит методику выполнения лабораторной работыПостроить график зависимости скорости реакции от концентрацииСоставить кинетическое уравнение реакцииСделать вывод
Слайд 2Цель: изучить влияние концентрации реагирующих веществ на скорость и направление реакции.
Задание:
Изучить
теорию скорости (кинематики )химических реакций
Изучит методику выполнения лабораторной работы
Построить график зависимости скорости реакции от концентрации
Составить кинетическое уравнение реакции
Сделать вывод
Изучит методику выполнения лабораторной работы
Построить график зависимости скорости реакции от концентрации
Составить кинетическое уравнение реакции
Сделать вывод
Слайд 4Опыт№1
«Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной
системе»
Слайд 5Реакция взаимодействия тиосульфата натрия с серной кислотой протекает по уравнению:
Проделать
качественный опыт. Для этого внести в пробирку 3-5 капель 1н. Раствора тиосульфата натрия и 2-3 капли 2н. Серной кислоты. Отметить начало помутнения раствора и дальнейшее выпадение в осадок свободной серы. После данного и каждого последующего опыта немедленно мыть пробирки.
Приготовить 3 раствора тиосульфата натрия различной концентрации, взяв раствор тиосульфата натрия и воду в объеме указанном в таблице. Содержимое пробирок перемешать стеклянной палочкой
В пробирку 1 добавить одну каплю 2н. Раствора серной кислоты; раствор перемешать, чтобы реакция протекала во всем объеме раствора. По секундомеру или ручным часам измерить время от момента добавления кислоты до появления в растворе первоначального помутнения. Аналогичный опыт проделать во втором и третьем случае. Данные потом занести в таблицу.
Приготовить 3 раствора тиосульфата натрия различной концентрации, взяв раствор тиосульфата натрия и воду в объеме указанном в таблице. Содержимое пробирок перемешать стеклянной палочкой
В пробирку 1 добавить одну каплю 2н. Раствора серной кислоты; раствор перемешать, чтобы реакция протекала во всем объеме раствора. По секундомеру или ручным часам измерить время от момента добавления кислоты до появления в растворе первоначального помутнения. Аналогичный опыт проделать во втором и третьем случае. Данные потом занести в таблицу.
Слайд 6
Na2S2O3
H2S2O3
Реакция выражается схемой
Начало помутнения раствора и дальнейшее выпадение в осадок
свободной серы
Слайд 10Написать кинетическое уравнение реакции.
Сделать вывод о влиянии концентрации реагирующих веществ на
скорость химической реакции в гомогенной системе.
Слайд 11Опыт№2
«Смещение химического равновесия путем изменения концентраций исходных и образующихся веществ»
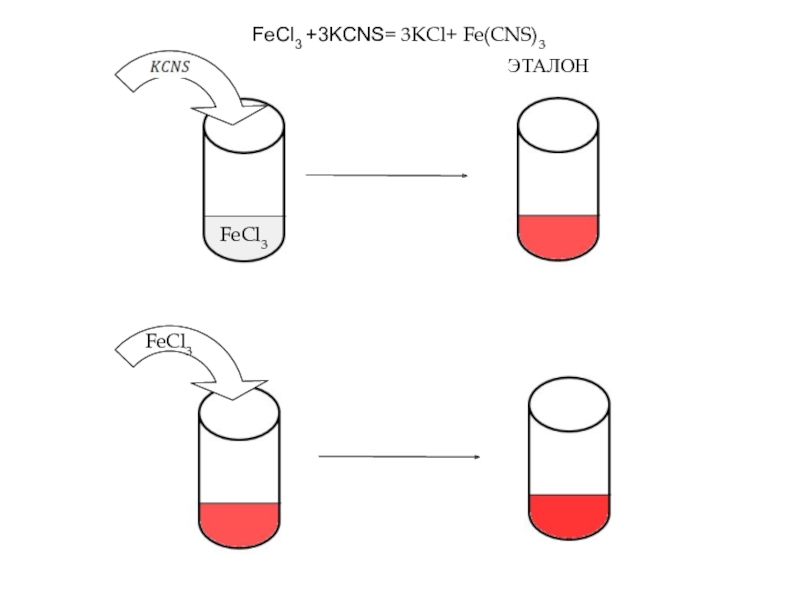
Слайд 12В пробирку внести по 5 капель разбавленной(0,0025н.) растворов
FeCl3 И KCNS.
Растворы в пробирках перемешать стеклянной палочкой. В растворах имеет место обратимая реакция:
FeCl3 +3KCNS= 3KCl+ Fe(CNS)3
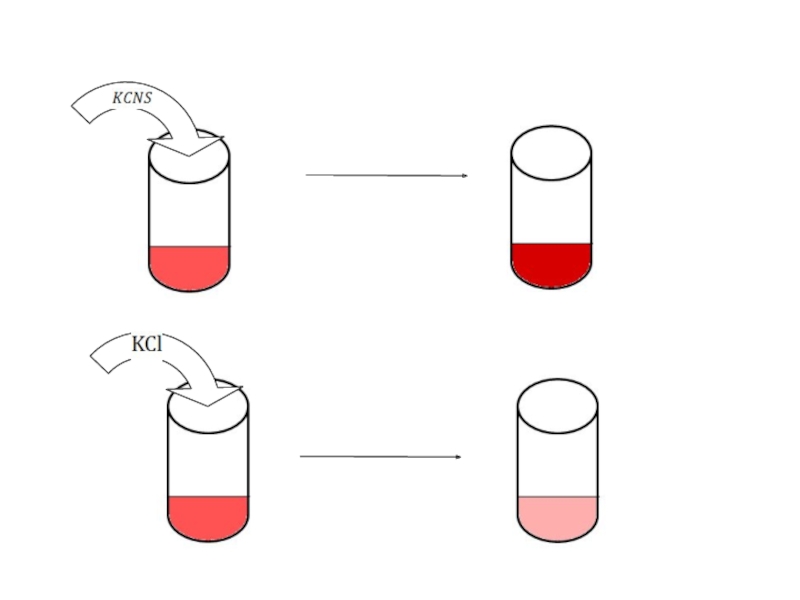
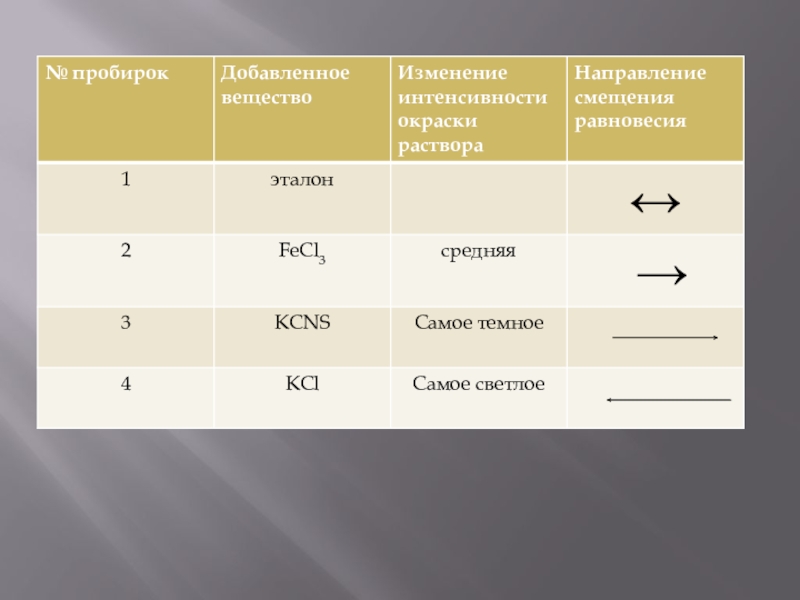
Первую пробирку оставить в качестве эталона. Во вторую и третью пробирки добавить одну каплю насыщенного раствора FeCl3 , в четвертую- половину микро шпателя кристаллического KCl , размешать растворы стеклянной палочкой. Отметить изменения интенсивности окраски раствора в каждой пробирке относительно окраски эталона. Результаты наблюдения занести в таблицу.
FeCl3 +3KCNS= 3KCl+ Fe(CNS)3
Первую пробирку оставить в качестве эталона. Во вторую и третью пробирки добавить одну каплю насыщенного раствора FeCl3 , в четвертую- половину микро шпателя кристаллического KCl , размешать растворы стеклянной палочкой. Отметить изменения интенсивности окраски раствора в каждой пробирке относительно окраски эталона. Результаты наблюдения занести в таблицу.
Слайд 16Написать выражение константы равновесия данного процесса. На основании принципа Ле Шетелье
сделать вывод о влиянии концентрации веществ на химическое равновесие обратимой реакции.
Слайд 17Контрольные вопросы
Чем отличаются гомогенные реакции от гетерогенных?
Какие факторы влияют на скорость
химической реакции?
Как влияет температура на скорость химической реакции?
Что такое химическое равновесие? Какие факторы влияют на ее смещение?
Сформулируйте принцип Ле Шателье.
Как влияет температура на скорость химической реакции?
Что такое химическое равновесие? Какие факторы влияют на ее смещение?
Сформулируйте принцип Ле Шателье.
Слайд 191.Во сколько раз изменится объем выделяющегося водорода в реакции цинка с
соляной кислотой при измельчении кубика цинка массой 1г на 1000 одинаковых кубиков:?
2.Катализатор ускоряет химическую реакцию благодаря?
3. Равновесие реакции Fe3O4+4CO ↔ 3Fe+4CO2-43,7 кДж смещается влево при: ?
4. Какое соотношение представляет собой константу равновесия Кр для химического равновесия, описываемого уравнением реакции:
2NO(r)+O2 (r) ↔ 2CO(r)?
2.Катализатор ускоряет химическую реакцию благодаря?
3. Равновесие реакции Fe3O4+4CO ↔ 3Fe+4CO2-43,7 кДж смещается влево при: ?
4. Какое соотношение представляет собой константу равновесия Кр для химического равновесия, описываемого уравнением реакции:
2NO(r)+O2 (r) ↔ 2CO(r)?
Слайд 205.В какой реакции повышение давления в системе приводит к повышению выхода
продуктов реакции?
6. Какая из реакций, схемы которых приведены ниже, практически не идет до конца:?
7.Выберете не верное утверждение. При протекании химической реакции:?
8.Какой из перечисленных ниже параметров всегда остается неизменным в химической реакции?
9. Из перечисленных ниже явлений химическим является:?
10.Какой из перечисленных процессов является медленным окислением:?
6. Какая из реакций, схемы которых приведены ниже, практически не идет до конца:?
7.Выберете не верное утверждение. При протекании химической реакции:?
8.Какой из перечисленных ниже параметров всегда остается неизменным в химической реакции?
9. Из перечисленных ниже явлений химическим является:?
10.Какой из перечисленных процессов является медленным окислением:?