Основные сведения о строении атома.
Периодический закон Д.И. Менделеева и строение атома
Химическая связь, кристаллические решетки,
свойства веществ в зависимости от строения
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Химия 11 класс ПС, химическая связь и кристаллические решетки
Содержание
- 1. Презентация Химия 11 класс ПС, химическая связь и кристаллические решетки
- 2. Основные сведения о строении атомаАтом – это
- 3. Мир электрона Быть может, эти электроны- Миры,
- 4. Атом Доказательства сложности строения атома1.Открытие рентгеновых лучей(
- 5. «Пудинг с изюмом» Атом уподоблен пудингу
- 6. Планетарная модель Атом состоит из положительно
- 7. Квантовая модель. Первый постулат. Электрон движется вокруг
- 8. Изотопы- это разновидности атомов и
- 9. Слайд 9
- 10. Состояние электронов в атоме Пространство вокруг
- 11. К s -элементам относят элементы
- 12. Периодический закон Д.И. Менделеева и строение атома
- 13. Валентность Валентность- это способность атома присоединять определенное число атомов другого химического элемента(образовывать разные виды связей).
- 14. В пределах одного и того
- 15. Химическая связь Под химической связью понимают
- 16. Ионная связь Ионная – химическая связь, образующаяся
- 17. Химические процессы Процесс восстановления
- 18. Атомы, отдавшие свои электроны, превращаются в положительные
- 19. Классификация ионов 1) По составу различаются:Простые
- 20. Ковалентная связь Ковалентная – химическая связь,
- 21. Электроотрицательность Электроотрицательностью называют способность атомов химических
- 22. КвалификацияПо механизму образования - обменный и донорно-акцепторный;По
- 23. Кристаллические решетки Молекулярная решетка –
- 24. Металлическая связь Металлическая связь – это
- 25. Физические свойства Пластичность ЭлектропроводностьТеплопроводностьМеталлический блеск
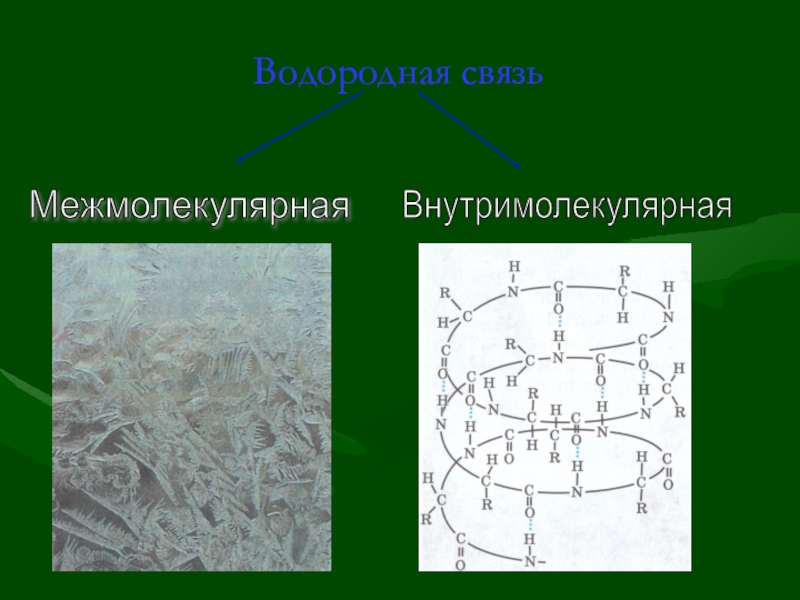
- 26. Водородная связь Водородная связь – это
- 27. Водородная связь Межмолекулярная Внутримолекулярная
- 28. Вывод: Водородная связь –
Слайд 1Выполнила: Алатарцева О.Б., учитель химии, ВКК
МКОУ Грибановская СОШ №2
Пгт Грибановский
Слайд 2Основные сведения о строении атома
Атом – это электронейтральная система взаимодействующих элементарных
Слайд 3Мир электрона
Быть может, эти электроны-
Миры, где пять материков,
Искусства,
И память сорока веков.
Ещё, быть может, каждый атом-
Вселенная, где сто планет;
Там все, что здесь в объёме сжатом,
Но также то, чего здесь нет.
(В. Брюсов)
Слайд 4Атом
Доказательства сложности строения атома
1.Открытие рентгеновых лучей( 1895 г., К. Рентген).
2.Открытие катодных
3.Открытие радиоактивности( 1896 г., А. Беккерель) и ее изучение.
Модели строения атома
1. «Пудинг с изюмом» (1902-1904 гг., В. Кельвин , Дж. Томсон).
2. Планетарная (1907 г., Э. Резерфорд).
3. Квантовая модель (1913 г., Н. Бор).
Слайд 5«Пудинг с изюмом»
Атом уподоблен пудингу сферической формы, имеющий положительный
Слайд 6Планетарная модель
Атом состоит из положительно заряженного ядра и электронов,
Слайд 7Квантовая модель.
Первый постулат. Электрон движется вокруг ядра по строго определенным
Второй постулат. Электрон может переходить из одного состояния в другое.
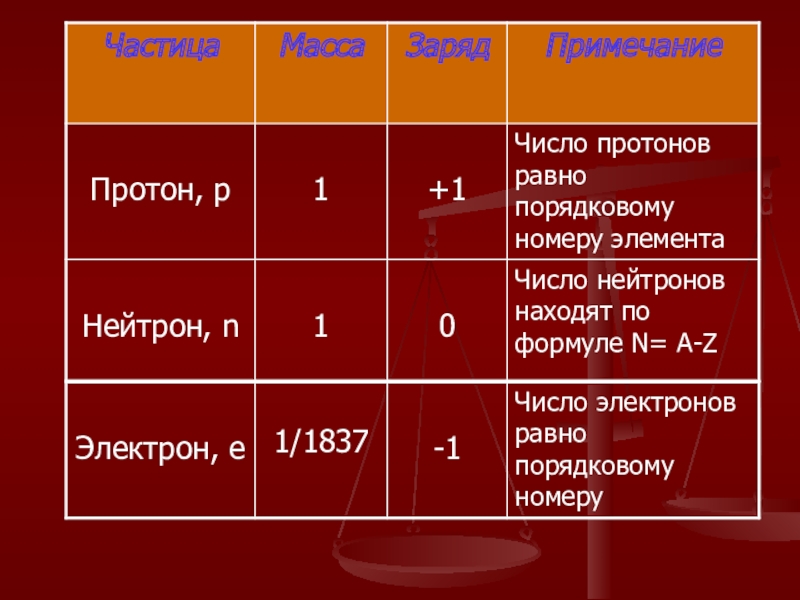
Слайд 8 Изотопы- это разновидности атомов и того же химического элемента,
Химический элемент – это вид атомов с одинаковым положительным зарядом ядра.
Электронным облаком называется пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
Слайд 10Состояние электронов в атоме
Пространство вокруг атомного ядра, в котором
- S-орбиталь
- Р-орбиталь
- d-орбиталь
Слайд 11 К s -элементам относят элементы главных подгрупп I и
К р - элементам относят элементы главных подгрупп III - VIII групп Периодической системы Д.И. Менделеева.
К d - и f -элементам относят химические элементы побочных подгрупп Периодической системы Д.И. Менделеева.
Слайд 12Периодический закон Д.И. Менделеева и строение атома
Свойства химических элементов
Слайд 13Валентность
Валентность- это способность атома присоединять определенное число атомов другого
Слайд 14 В пределах одного и того же периода металлические свойства
В пределах одной и той же
группы(в главной подгруппе)
металлические свойства усиливаются,
а неметаллические ослабевают
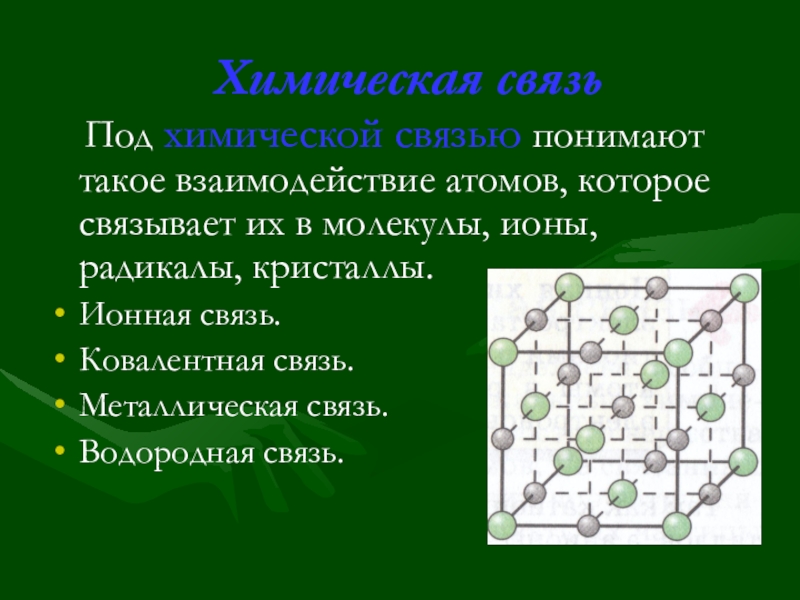
Слайд 15Химическая связь
Под химической связью понимают такое взаимодействие атомов, которое
Ионная связь.
Ковалентная связь.
Металлическая связь.
Водородная связь.
Слайд 16Ионная связь
Ионная – химическая связь, образующаяся между ионами, называется ионной.
Ме + не Ме
Слайд 17Химические процессы
Процесс восстановления в результате которого происходит
Процесс окисления в результате которого происходит отдача своих электронов с внешнего уровня другим атомам.
Слайд 18Атомы, отдавшие свои электроны, превращаются в положительные ионы- катионы.
Атомы, присоединившие чужие
Слайд 19Классификация ионов
1) По составу различаются:
Простые
Na, Cl, Ca OH, SO4 ,NH4
2) По знаку заряда:
Положительные(катионы) Отрицательные(анионы)
Слайд 20Ковалентная связь
Ковалентная – химическая связь, возникающая в результате образования
не Ме + не Ме
Слайд 21Электроотрицательность
Электроотрицательностью называют способность атомов химических элементов притягивать к себе
H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F
Усиление электроотрицательности
Слайд 22Квалификация
По механизму образования - обменный и донорно-акцепторный;
По полярности связи – ковалентные
По кратности – одинарные, двойные и тройные ковалентные связи.
Слайд 23Кристаллические решетки
Молекулярная решетка – это решетка в узлах
Атомная решетка – это решетка в узлах которой находятся атомы с ковалентной полярной и неполярной связью.
Слайд 24Металлическая связь
Металлическая связь – это связь, в кристаллах
Ме + сплав