- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад химия 10 класс Профильный уровень Ведение в органическую химию. Гибридизация электронных орбиталей
Содержание
- 1. Презентация химия 10 класс Профильный уровень Ведение в органическую химию. Гибридизация электронных орбиталей
- 2. Конец XIII века начало IX века
- 3. 1. Развитие и совершенствование органического эксперимента.
- 4. 1854 год Французский ученый Мишель
- 5. 1861 год Русский ученый Бутлеров Александр Михайлович
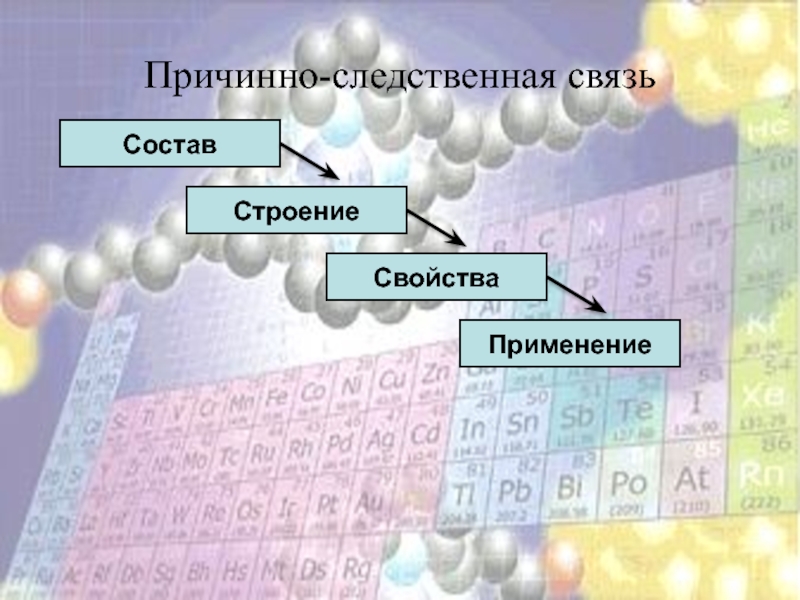
- 6. Причинно-следственная связьПрименение
- 7. Роль органической химииЧисло органических соединений увеличивается в
- 8. 2. Особенности строения органических веществУглерод –
- 9. Каков заряд атома углерода?Число протонов и нейтронов,
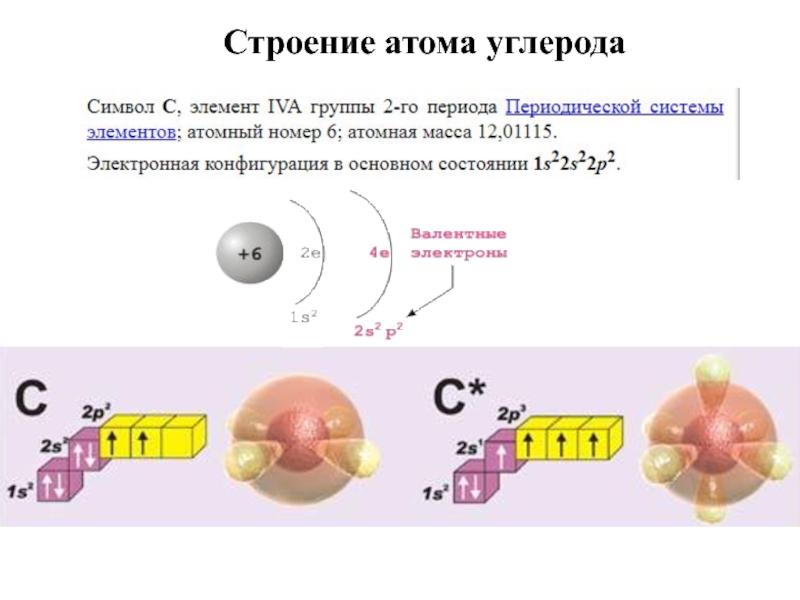
- 10. Строение атома углерода
- 11. Слайд 11
- 12. Слайд 12
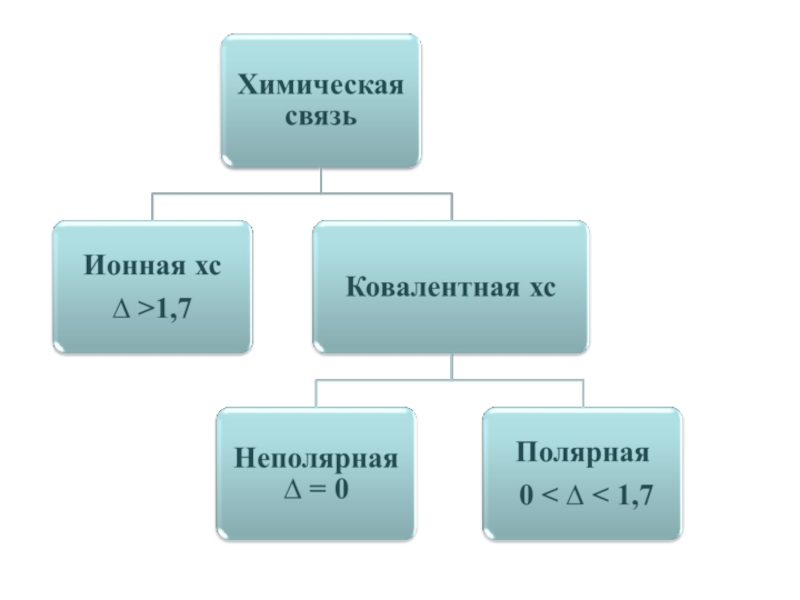
- 13. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- 14. Слайд 14
- 15. Слайд 15
- 16. это связь, возникающая между атомами за счет образования общих электронных пар.Механизм образования:обменный донорно-акцепторныйКовалентная связь
- 17. Характеристики Длина связиЭнергия связиВалентный угол Способ перекрывания электронных орбиталейПолярность связиКратность связиКовалентная связь
- 18. Свойства Насыщаемостьчисло неспаренных электроновчисло неподеленных электронных парчисло
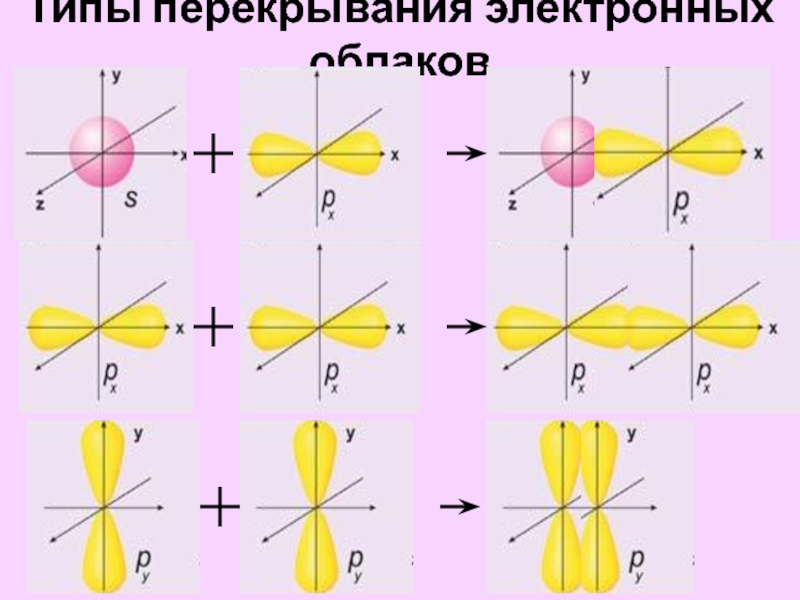
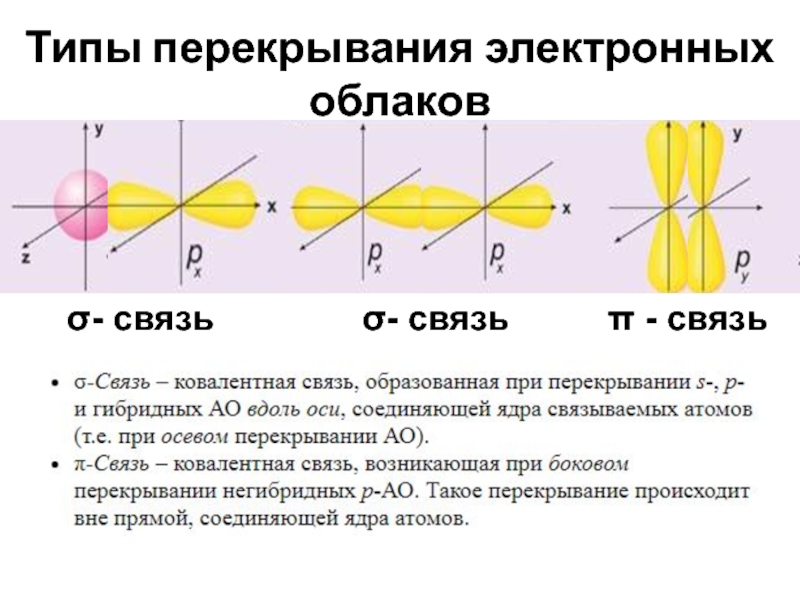
- 19. Типы перекрывания электронных облаков
- 20. σ- связь
- 21. ИС образуется между атомами металлов и
- 22. Написать схему строения : Н
- 23. 4. Длина связи в молекулах:H2
- 24. 4. Валентные возможности атома углерода Гибридизация- это
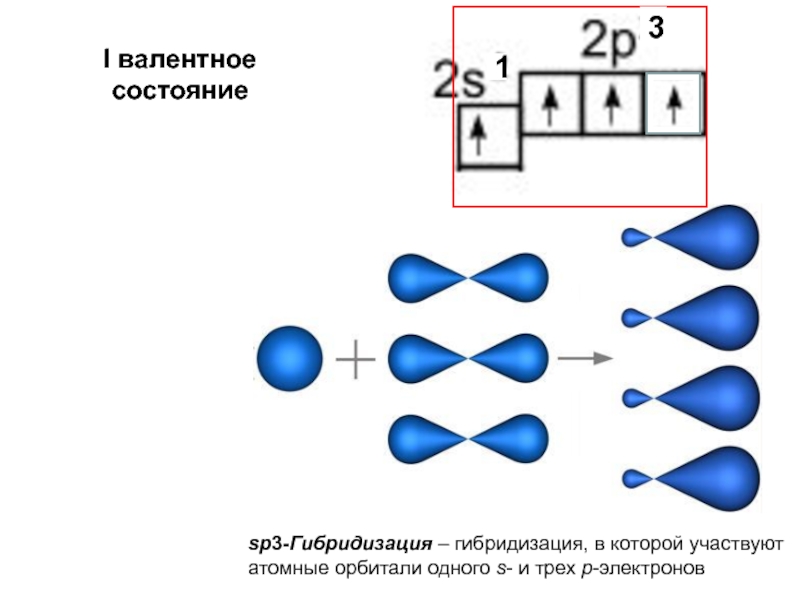
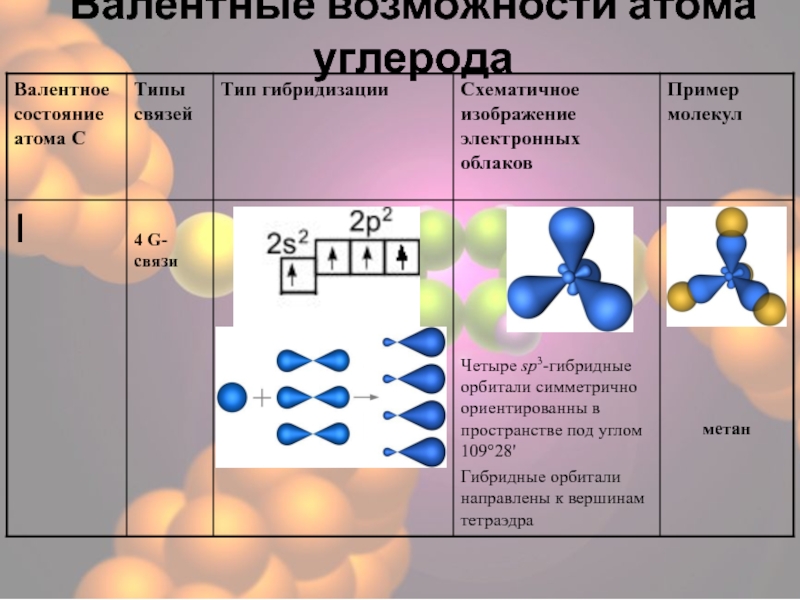
- 25. sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов I валентное состояние31
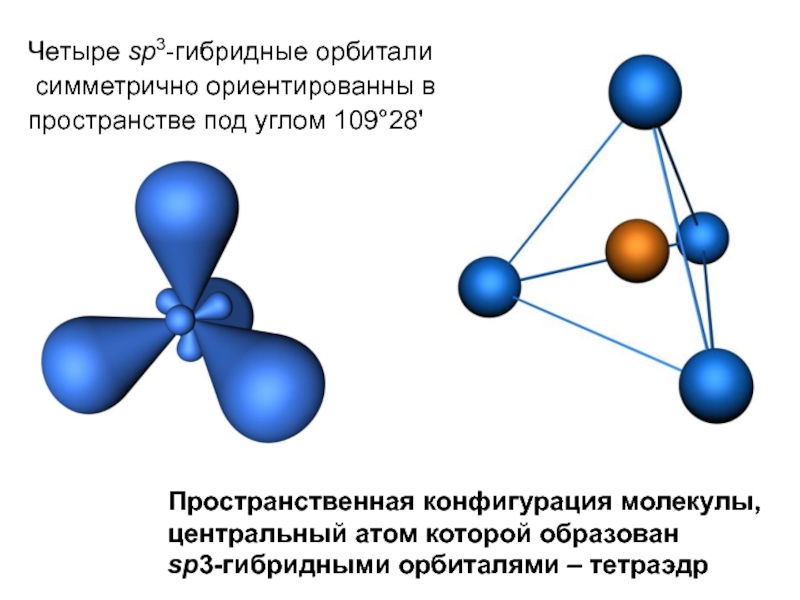
- 26. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве
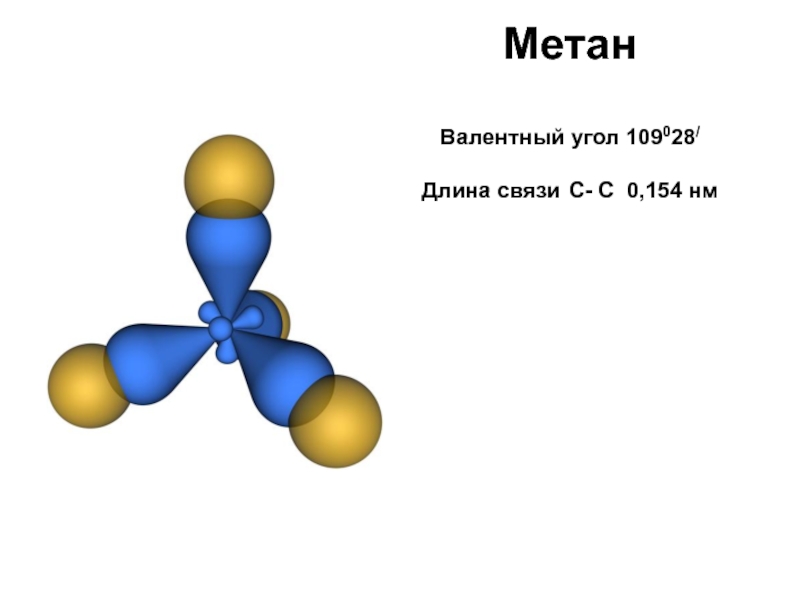
- 27. Метан Валентный угол 109028/ Длина связи С- С 0,154 нм
- 28. Валентные возможности атома углерода
- 29. II валентное состояниеsp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов
- 30. В результате гибридизации образуются
- 31. III валентное состояниеВ процессе гибридизации образуются 2 гибридные
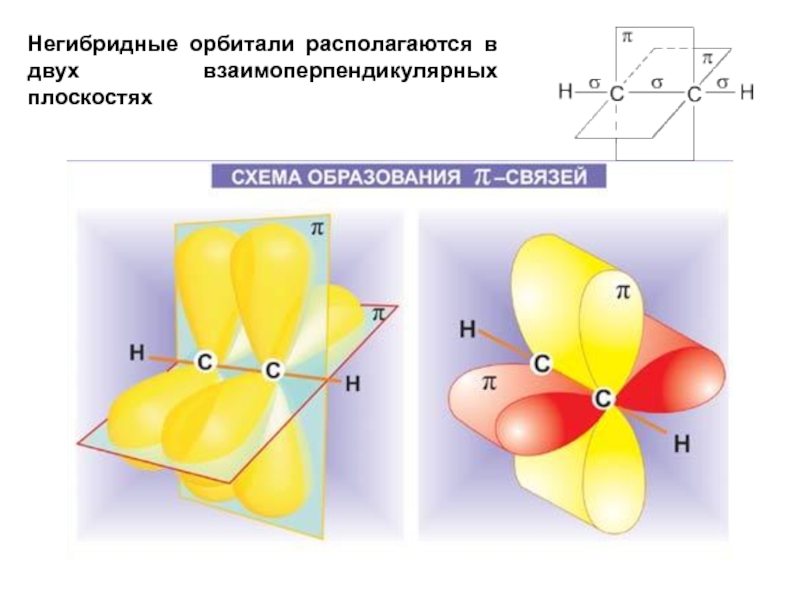
- 32. Негибридные орбитали располагаются в двух взаимоперпендикулярных плоскостях
- 33. Слайд 33
Слайд 2Конец XIII века начало IX века господствует теория «Витализма»
Шведский химик
Йёнс Якоб Берцелиус
Исследования строения и свойств растительных и животных веществ назвал органической химией , а предмет изучения органическими
веществами
Слайд 31. Развитие и совершенствование органического эксперимента. Синтез органических веществ из неорганических
1828 год
Немецкий ученный Фридрих Вёлер синтезировал карбамид (NH2)2CO (мочевину)
при упаривании раствора
цианата аммония NH4NCO - органическое вещество из неорганического.
2NH3 + CO2 → (NH2)2CO + H2O
1845 год
Немецкий ученный
Адольф Кольбе синтезировал уксусную кислоту из углерода - органическое вещество из неорганического.
Слайд 41854 год Французский ученый Мишель Бертло синтезировал жир путем гидротации этилена в
1811 год
Французский ученый
Эжен Шеврель
Установил состав жиров,
нагревая жир с водой в
елочной среде
Слайд 51861 год
Русский ученый
Бутлеров Александр Михайлович
синтезировал один из углеводов
Мишель Бертло: «Химия не
Органическая химия – это наука об углеродах и их производных, об их составе, строении, свойствах, получении и применении.
Слайд 7Роль органической химии
Число органических соединений увеличивается в геометрической прогрессии.
Большинство современных промышленных
Процессы протекающие в живых организмах – это органические процессы. Органическая химия – это химия жизни.
Новые технологии биотехнология и генная инженерия.
Слайд 82. Особенности строения
органических веществ
Углерод – единственный элемент ПСХЭ, атомы которого
Наиболее важные соединения – углеводороды, все остальные производные.
Органические вещества можно расположить в ряды сходные по составу и строению - гомологические ряды.
Для органических веществ характерно явление изомерии.
Слайд 9Каков заряд атома углерода?
Число протонов и нейтронов, в ядре атома углерода?
Сколько
Сколько электронов на внешнем уровне?
Что такое орбиталь?
Какое типы электронных орбиталей бывают?
3. Строение атома углерода
Слайд 13Химическая связь – это такое взаимодействие атомов, которое связывает их в
Слайд 16это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм
обменный
донорно-акцепторный
Ковалентная связь
Слайд 17Характеристики
Длина связи
Энергия связи
Валентный угол
Способ перекрывания электронных орбиталей
Полярность связи
Кратность связи
Ковалентная
Слайд 18Свойства
Насыщаемость
число неспаренных электронов
число неподеленных электронных пар
число вакантных орбиталей на внешнем
2. Направленность
- пространственная конфигурация молекул.
Ковалентная связь
Слайд 21 ИС образуется между атомами металлов и неметаллов, т.е. между атомами
Механизм образования связи.
Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами.
Ионная связь
Слайд 22Написать схему строения :
Н
2. Написать схему строения:
Cl Cl- Cl+5
3. При образовании ковалентных связей атомы
Н и С стремятся завершить внешний уровень
до благородных газов, каких?
Слайд 234. Длина связи в молекулах:
H2
0,074нм 0,142 нм 0,200 нм 0,228 нм
С чем связано возрастание длины связи?
5. Орбитали какого типа перекрываются при образовании связей:
H ─ H , H ─ F , F ─ F , N ≡ N O ═ O
Какие типы связей?
Какие связи полярные, какие нет?
Слайд 244. Валентные возможности атома углерода Гибридизация- это смешение атомных орбиталей разной формы,
Слайд 25sp3-Гибридизация – гибридизация, в которой участвуют
атомные орбитали одного s- и трех
I валентное состояние
3
1
Слайд 26Четыре sp3-гибридные орбитали
симметрично ориентированны в
пространстве под углом 109°28'
Пространственная
центральный атом которой образован
sp3-гибридными орбиталями – тетраэдр
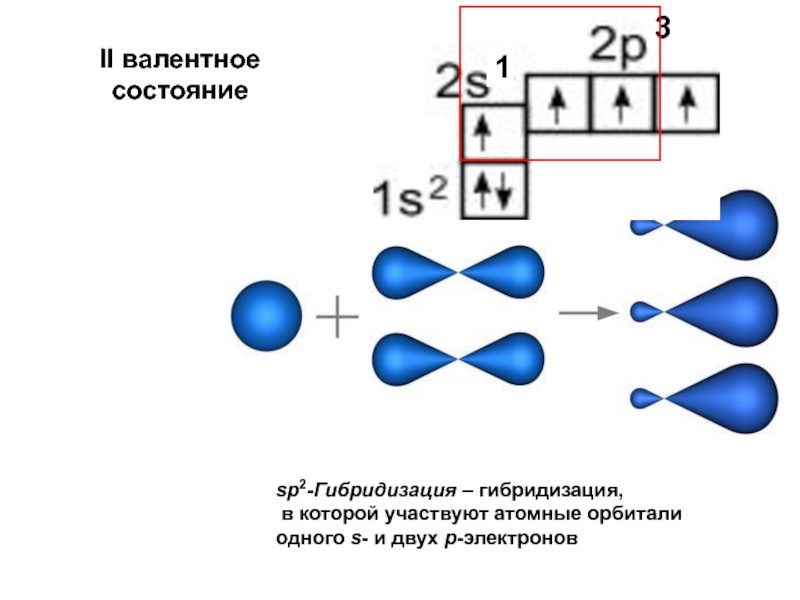
Слайд 29II валентное состояние
sp2-Гибридизация – гибридизация,
в которой участвуют атомные орбитали
одного s-
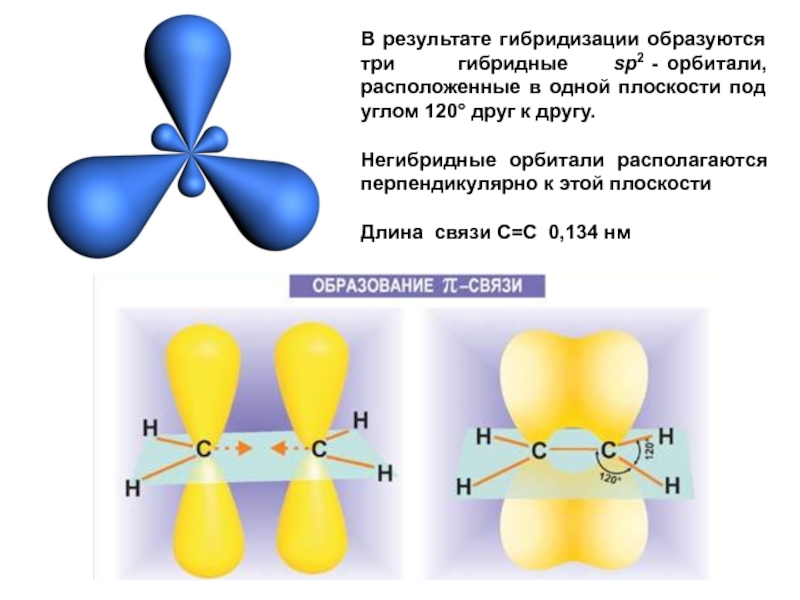
Слайд 30В результате гибридизации образуются три
Негибридные орбитали располагаются перпендикулярно к этой плоскости
Длина связи С=С 0,134 нм
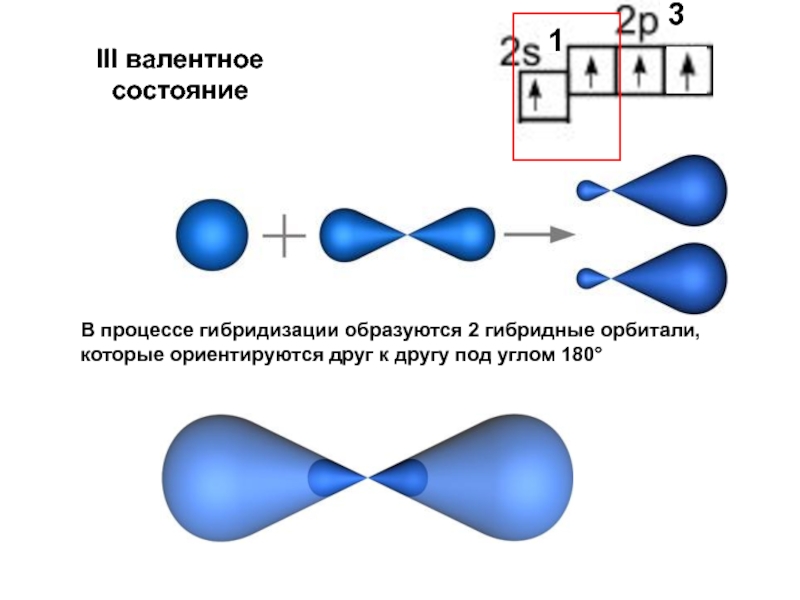
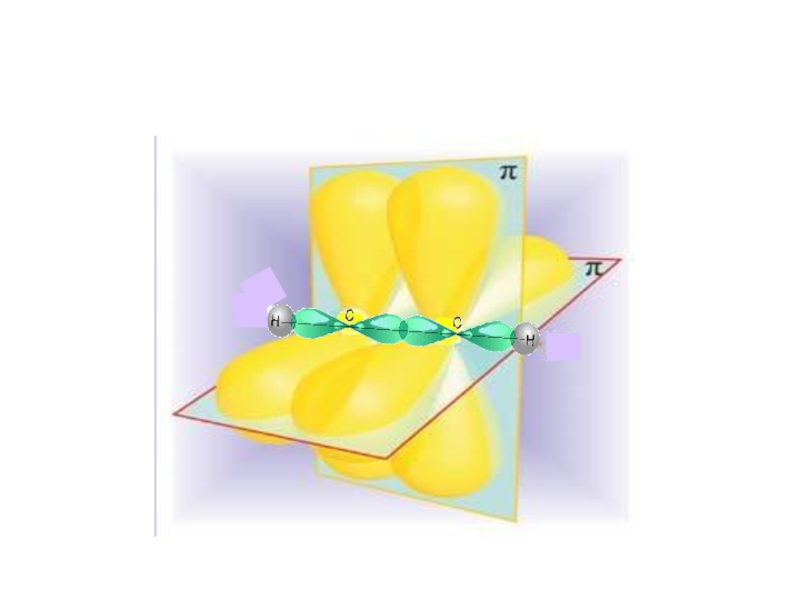
Слайд 31III валентное состояние
В процессе гибридизации образуются 2 гибридные орбитали,
которые ориентируются друг
3
1