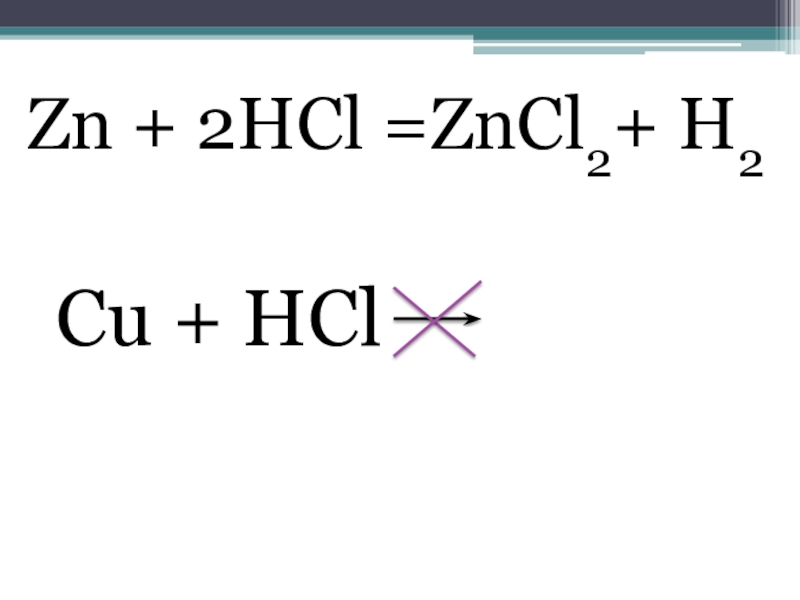- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Химические свойства металлов, 2 часть, 9 класс
Содержание
- 1. Презентация Химические свойства металлов, 2 часть, 9 класс
- 2. Взаимодействие металлов с кислотамиН.Н. Бекетов – ряд
- 3. Пример Zn + HCl Cu + HCl
- 4. Zn + 2HCl =ZnCl2+ H2 Cu + HCl
- 5. Если образующаяся соль нерастворима в воде, значит,
- 6. В случае азотной кислоты любой концентрации и
- 7. Взаимодействие металлов с солями В ЭРН металлов
- 8. Более активны металл способен вытеснить менее активный
- 9. ПримерFe + CuSO4Cu + FeSO4
- 10. Fe + CuSO4= FeSO4+ CuFe0 –
Взаимодействие металлов с кислотамиН.Н. Бекетов – ряд активности металлов или электрохимический ряд напряжений металлов (ЭРН):Слева направо химическая активность атомов металлов уменьшается, т.е. уменьшается восстановительная способность – отдавать электроны правила (с. 214)
Слайд 2Взаимодействие металлов с кислотами
Н.Н. Бекетов – ряд активности металлов или электрохимический
ряд напряжений металлов (ЭРН):
Слева направо химическая активность атомов металлов уменьшается, т.е. уменьшается восстановительная способность – отдавать электроны
правила (с. 214)
Слева направо химическая активность атомов металлов уменьшается, т.е. уменьшается восстановительная способность – отдавать электроны
правила (с. 214)
Слайд 5Если образующаяся соль нерастворима в воде, значит, данная реакция не протекает:
Pb
+ HCl,
Al + H3PO4,
H2S + Mg.
Al + H3PO4,
H2S + Mg.
Слайд 6В случае азотной кислоты любой концентрации и конц. cерной, в качестве
окислителя выступает основной элемент – неметалл (N+5,S+6), а не ионы водорода Н+
Cu + 2H2SO4 = CuSO4 +SO2 + 2H2O
Слайд 7Взаимодействие металлов с солями
В ЭРН металлов слева направо ослабляется способность
атомов металлов отдавать электроны, но способность ионов тех же металлов присоединять электроны (окислительная способность) усиливается в том же направлении
Слайд 8Более активны металл способен вытеснить менее активный из раствора его соли:
Na0/Na+
Au0/Au+
сильный слабый слабый сильный
восст. окислитель восст. окислитель
сильный слабый слабый сильный
восст. окислитель восст. окислитель