- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Фосфор и его соединения
Содержание
- 1. Презентация Фосфор и его соединения
- 2. Фосфор и его соединения.
- 3. порядковый номер?номер периода, группу, подгруппу ?число
- 4. 1669г. Геннинг Бранд открыл новый элемент
- 5. Слайд 5
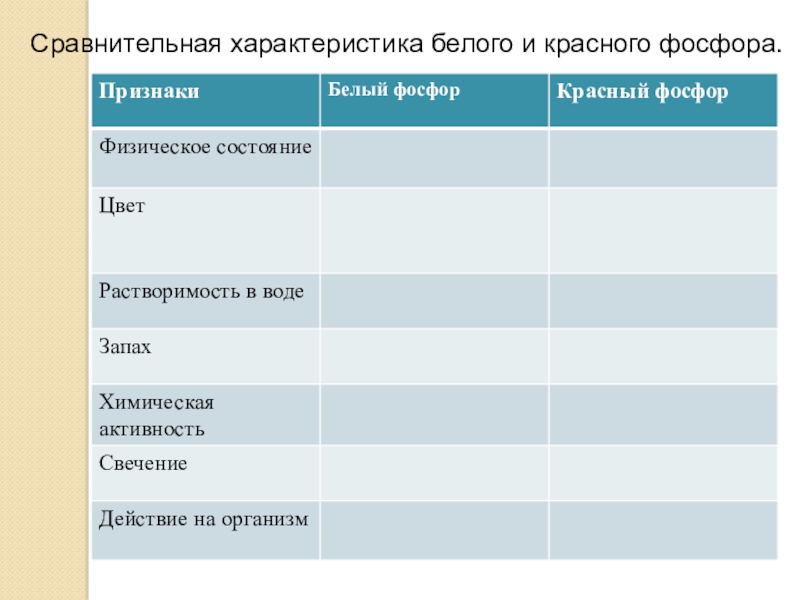
- 6. Сравнительная характеристика белого и красного фосфора.
- 7. Белый фосфорМолекулярное строениеМягкое воскообразное твердое вещество, с низкой температурой плавления.Самовоспламеняется при 44о С
- 8. Красный фосфор Порошок красного цвета, гигроскопичен, не светится.Не ядовит
- 9. Твердое вещество с металлическим блеском,жирное на ощупь, похожее на графит, полупроводник, малоактивен, практически негорюч
- 10. Слайд 10
- 11. Химические свойстваВзаимодействует с металлами 2Р
- 12. Слайд 12
- 13. Горит в кислороде
- 14. Слайд 14
- 15. Глазки видят всё вокруг, Обведу я ими
- 16. Слайд 16
- 17. Белый гигроскопичныйпорошок, хорошорастворяется в воде,является кислотнымоксидом.
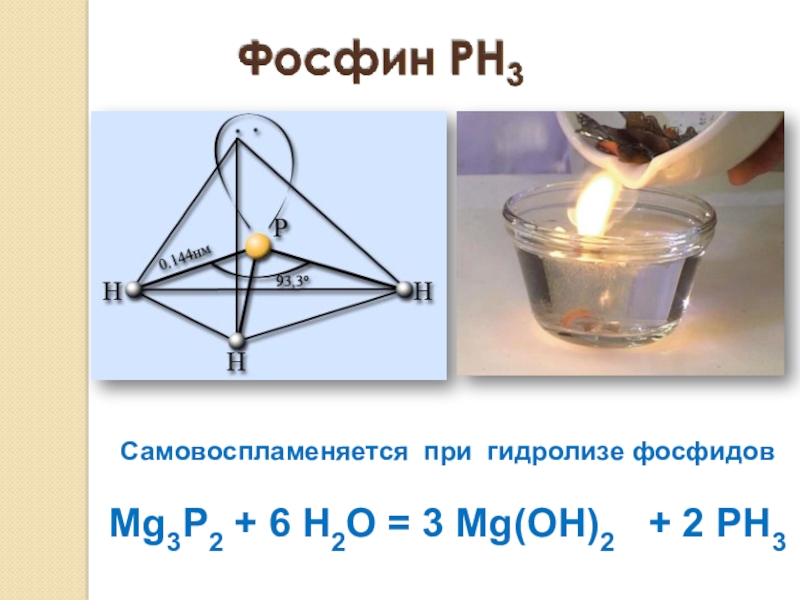
- 18. Самовоспламеняется при гидролизе фосфидовMg3P2 + 6 H2O = 3 Mg(OH)2 + 2 PH3
- 19. Ортофосфорная кислота Н3РО4 Н3РО4
- 20. Соли фосфорной кислотыН3РО4Фосфаты РО43-Са3(РО4)2Все нерастворимы, кроме солей
- 21. Качественная реакция на фосфат-ион РО43- РО43-
- 22. Фосфор и здоровье человека Содержание фосфора
- 23. Продукты, содержащие фосфор
- 24. Применение Производство спичекПроизводство минеральных удобренийПроизводство инсектицидов
- 25. Тест по теме : «Фосфор и его
- 26. ПРОВЕРЬ СЕБЯ !1.- 32.-43.- 44.- 1 5. -1
- 27. 18-21 б – оценка «5» 14-17
- 28. Домашнее задание§ 28 упр. 1-3 Составить сказку, или кроссворд.
- 29. Спасибо за работу
Фосфор и его соединения.
Слайд 3 порядковый номер?
номер периода, группу, подгруппу ?
число электронов, протонов, нейтронов, заряд
ядра?
число энергетических уровней, число внешних электронов?
определите, какой это элемент – металл или неметалл?
возможные степени окисления?
высшая степень окисления?
перечислите химические элементы, входящие в состав V группы главной подгруппы?
сравните пожалуйста свойства атома фосфора и азота?(радиус и окислительные свойства)?
число энергетических уровней, число внешних электронов?
определите, какой это элемент – металл или неметалл?
возможные степени окисления?
высшая степень окисления?
перечислите химические элементы, входящие в состав V группы главной подгруппы?
сравните пожалуйста свойства атома фосфора и азота?(радиус и окислительные свойства)?
Слайд 41669г. Геннинг Бранд
открыл новый элемент – фосфор.
С греческого
«фос»
- свет и «форос»,- несущий. «фосфоры» называют вещества, светящиеся в темноте после предварительного облучения.
Слайд 7Белый фосфор
Молекулярное строение
Мягкое воскообразное
твердое вещество,
с низкой температурой
плавления.
Самовоспламеняется при
44о С
Слайд 9Твердое вещество с металлическим блеском,
жирное на ощупь, похожее на графит,
полупроводник,
малоактивен, практически негорюч
Слайд 11Химические свойства
Взаимодействует с металлами
2Р + 3Са = Са3Р2
(фосфид кальция)
P + 3Na = Na3P (фосфид натрия)
5KClO3 + 6P = 3P2O5 + 5KCl
(с бертолетовой солью)
P + 3Na = Na3P (фосфид натрия)
5KClO3 + 6P = 3P2O5 + 5KCl
(с бертолетовой солью)
Слайд 15Глазки видят всё вокруг, Обведу я ими круг. Нарисую кислород (правой рукой), Покажу я
водород(левой рукой)
А теперь скажу я: «Стоп!» ( глазами моргнуть)
Слайд 19
Ортофосфорная кислота Н3РО4
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со щелочами: NaOH,
КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) со щелочными металлами реагирует !
Некоторые реакции с металлами протекают в очень разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) со щелочными металлами реагирует !
Некоторые реакции с металлами протекают в очень разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
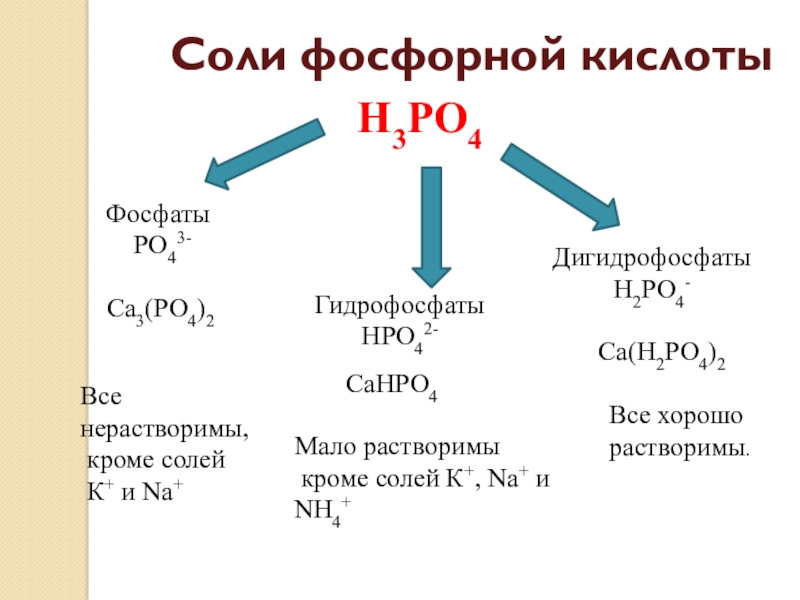
Слайд 20Соли фосфорной кислоты
Н3РО4
Фосфаты
РО43-
Са3(РО4)2
Все нерастворимы,
кроме солей
К+ и Na+
Гидрофосфаты
НРО42-
СаНРО4
Мало растворимы
кроме солей К+, Na+ и NH4+
Дигидрофосфаты
Н2РО4-
Са(Н2РО4)2
Все хорошо
растворимы.
Слайд 21Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+
= Ag3РО4 ↓
(желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
(желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
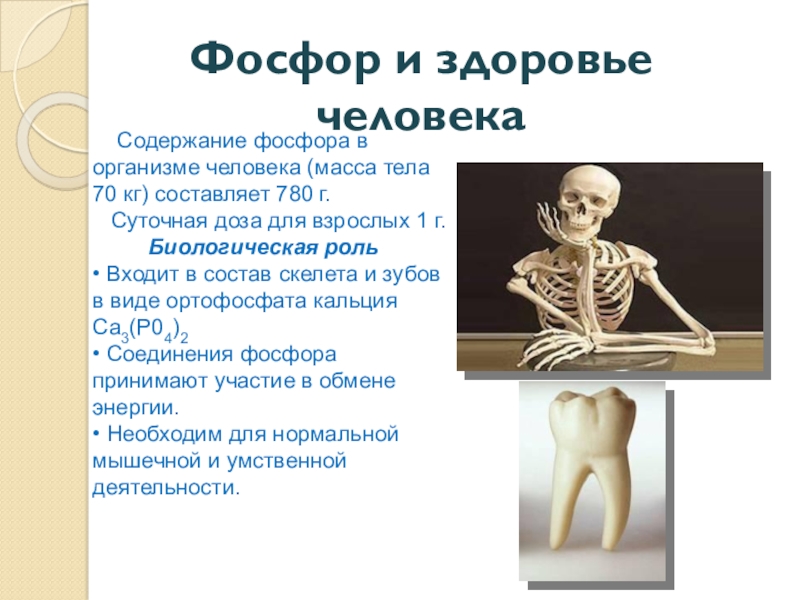
Слайд 22Фосфор и здоровье человека
Содержание фосфора в организме человека (масса
тела 70 кг) составляет 780 г.
Суточная доза для взрослых 1 г. Биологическая роль • Входит в состав скелета и зубов в виде ортофосфата кальция Са3(Р04)2 • Соединения фосфора принимают участие в обмене энергии. • Необходим для нормальной мышечной и умственной деятельности.
Суточная доза для взрослых 1 г. Биологическая роль • Входит в состав скелета и зубов в виде ортофосфата кальция Са3(Р04)2 • Соединения фосфора принимают участие в обмене энергии. • Необходим для нормальной мышечной и умственной деятельности.
Слайд 25Тест по теме : «Фосфор и его соединения».
Один правильный ответ.
Распределение электронов
по энергетическим уровням в атоме фосфора:
1) 2,8,3; 2) 2,5;
3) 2,8,5; 4) 2,8,8,5.
Высшая степень окисления фосфора равна: 1) +1; 2) +2; 3) +3; 4) +5.
Общая формула, соответствующая высшему оксиду фосфора: 1) R2O 2) RO; 3) R2O3 4) R2O5
Вещество Са3 Р2 называется: 1) фосфид кальция 2) фосфат кальция 3) фторид кальция 4) фосфин
Высшая степень окисления фосфора равна: 1) +1; 2) +2; 3) +3; 4) +5.
Общая формула, соответствующая высшему оксиду фосфора: 1) R2O 2) RO; 3) R2O3 4) R2O5
Вещество Са3 Р2 называется: 1) фосфид кальция 2) фосфат кальция 3) фторид кальция 4) фосфин
Слайд 2718-21 б – оценка «5» 14-17 б – оценка «4» 10-13 б –
оценка «3»
менее 9 б – вам надо подтянуться
Подсчитайте общее количество
баллов