- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад физические и химические свойства серы
Содержание
- 1. Презентация физические и химические свойства серы
- 2. Физические свойства Твердое кристаллическое вещество желтого цвета, нерастворима
- 3. Строение атома серы Основное состояние1s22s22p63s23p4
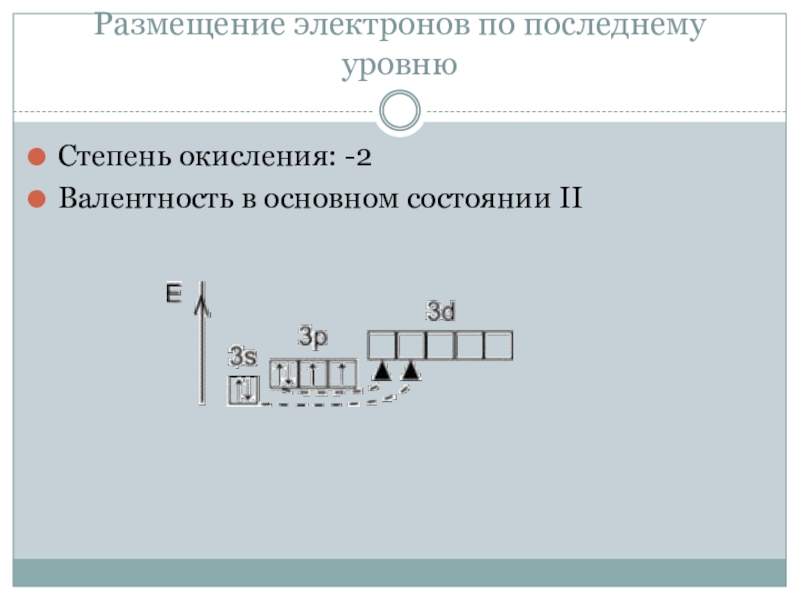
- 4. Размещение электронов по последнему уровнюСтепень окисления: -2Валентность в основном состоянии II
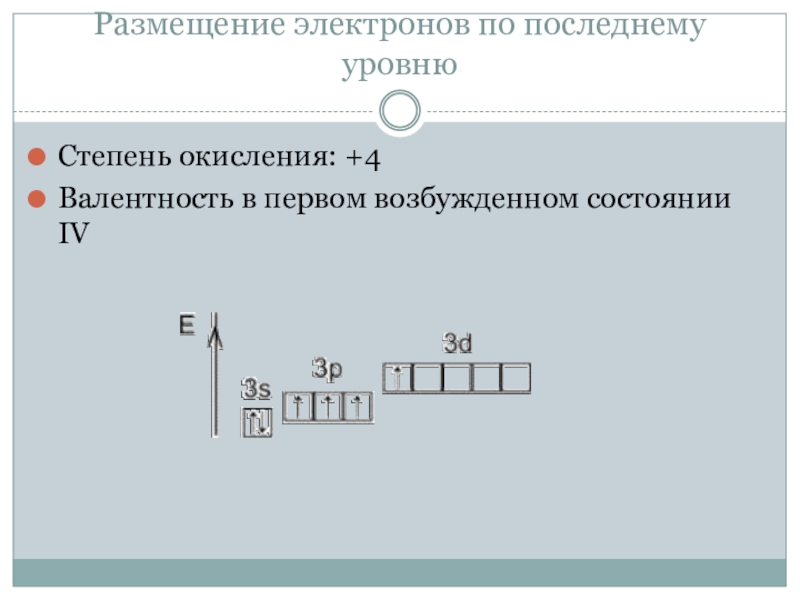
- 5. Размещение электронов по последнему уровнюСтепень окисления: +4Валентность в первом возбужденном состоянии IV
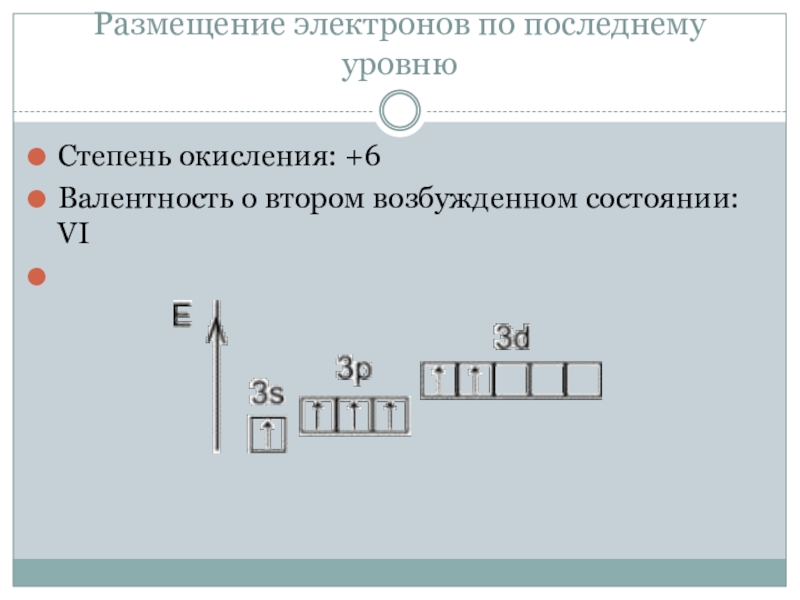
- 6. Размещение электронов по последнему уровнюСтепень окисления: +6Валентность о втором возбужденном состоянии: VI
- 7. Химические свойства Сера - окислитель
- 8. Сера-окислитель 3.Взаимодействие серы с некоторыми неметаллами:H2 + S → H2S 2P + 3S→ P2S3C + 2S → CS2
- 9. Химические свойства Сера - восстановитель: S - 4ē → S+4;
- 10. Применение серыПолучение эбонита, производство спичек, пороха, в
- 11. СПАСИБО ЗА ВНИМАНИЕ
Физические свойства Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С. Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело
Слайд 2Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не
смачивается (плавает на поверхности), t°кип = 445°С.
Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Слайд 4Размещение электронов по последнему уровню
Степень окисления: -2
Валентность в основном состоянии II
Слайд 5Размещение электронов по последнему уровню
Степень окисления: +4
Валентность в первом возбужденном состоянии
IV
Слайд 6Размещение электронов по последнему уровню
Степень окисления: +6
Валентность о втором возбужденном состоянии:
VI
Слайд 7Химические свойства
Сера - окислитель S0 + 2ē→ S-2
Взаимодействие с
ртутью ( так же со всеми щелочными и щелочноземельными металлами, медью, серебром) без нагревания:
2Na + S → Na2S
S + Hg = HgS
2. Взаимодействие серы c остальными металлами (кроме Au) при повышенной t°:
2Al + 3S t→ Al2S3
Zn + S t°→ ZnS Cu + S t→ CuS
2Na + S → Na2S
S + Hg = HgS
2. Взаимодействие серы c остальными металлами (кроме Au) при повышенной t°:
2Al + 3S t→ Al2S3
Zn + S t°→ ZnS Cu + S t→ CuS
Слайд 8Сера-окислитель
3.Взаимодействие серы с некоторыми неметаллами:
H2 + S → H2S
2P + 3S→ P2S3
C + 2S → CS2
Слайд 9Химические свойства
Сера - восстановитель: S - 4ē → S+4;
S - 6ē →S+6
1. Взаимодействие серы c кислородом:
S + O2 t°→ S+4O2
2S + 3O2 t°;pt→ 2S+6O3
2. Взаимодействие серы c галогенами (кроме йода):
S + Cl2 → S+2Cl2
1. Взаимодействие серы c кислородом:
S + O2 t°→ S+4O2
2S + 3O2 t°;pt→ 2S+6O3
2. Взаимодействие серы c галогенами (кроме йода):
S + Cl2 → S+2Cl2
Слайд 10Применение серы
Получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского
хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.