- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад для учащихся 8х классов на тему Кислоты
Содержание
- 1. Презентация для учащихся 8х классов на тему Кислоты
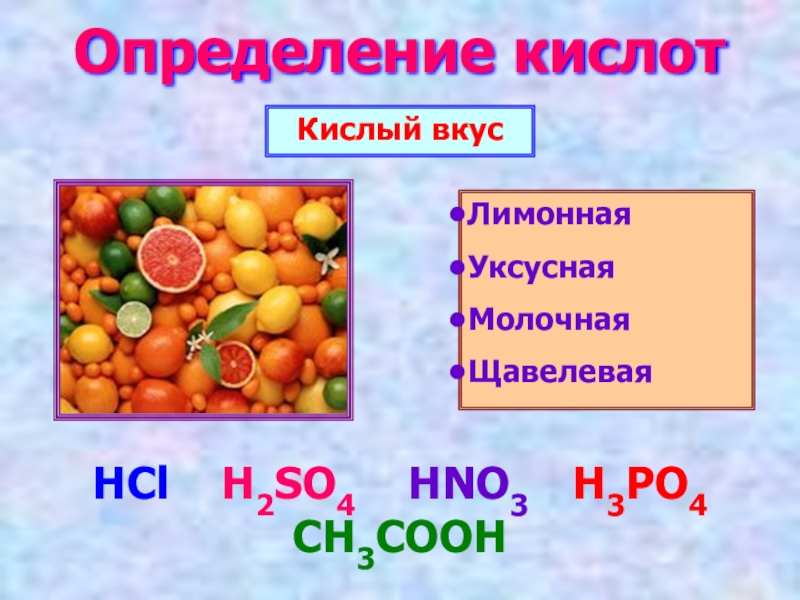
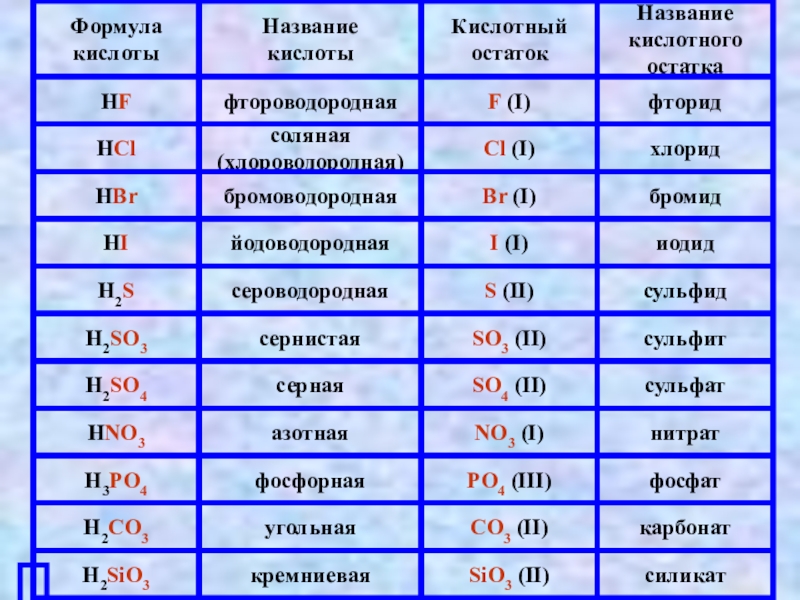
- 2. Определение кислотКислый вкусЛимонная УксуснаяМолочная Щавелевая HCl H2SO4 HNO3 H3PO4 CH3COOH
- 3. HCl → H+ + Cl-HNO3 →
- 4. Сильные и слабые кислотыСильные кислотыСлабые кислотыМолекулы полностью
- 5. Классификация кислотЧисло атомов водородаОдноосновные Многоосновные HClHNO3CH3COOHH2SO4H3PO4H2CO3Число атомов НЗаряд кислотного остатка
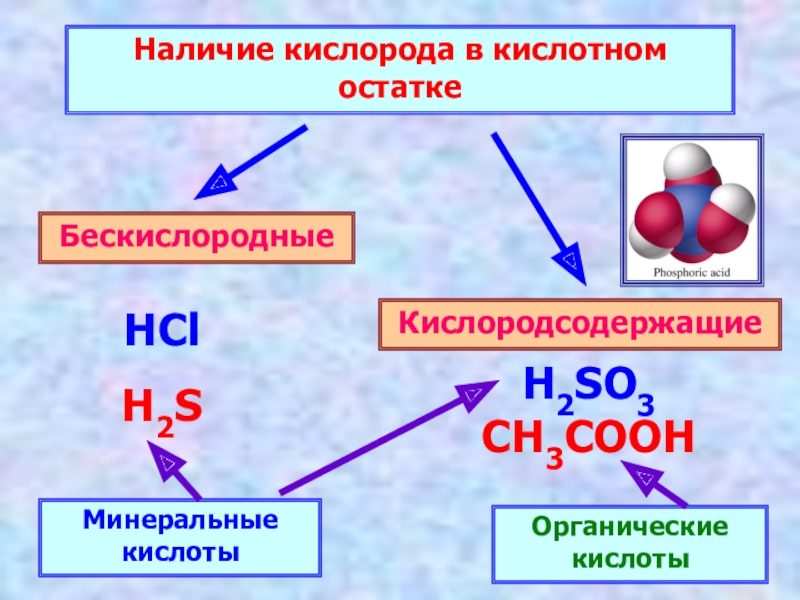
- 6. Наличие кислорода в кислотном остаткеБескислородныеКислородсодержащие HClH2SH2SO3CH3COOHМинеральные кислотыОрганические кислоты
- 7. Слайд 7
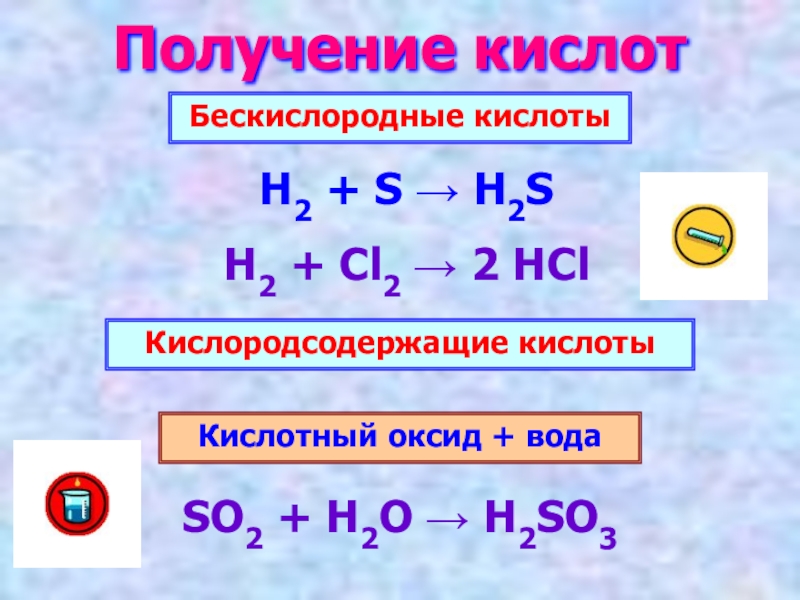
- 8. Получение кислот Бескислородные кислотыКислородсодержащие кислотыH2 + S
- 9. песокH2O
- 10. Физические свойства кислотКислый вкусПлотность больше плотности водыРазъедающее действиеВода, раствор питьевой соды
- 11. Сначала вода, потом кислота – иначе случится большая беда!
- 12. Химические свойства кислот Кислоты изменяют окраску индикаторовЛакмус
- 13. Кислоты реагируют с металлами, стоящими в ряду
- 14. Кислоты реагируют с окcидами металловMgO + H2SO4
Слайд 2Определение кислот
Кислый вкус
Лимонная
Уксусная
Молочная
Щавелевая
HCl H2SO4 HNO3
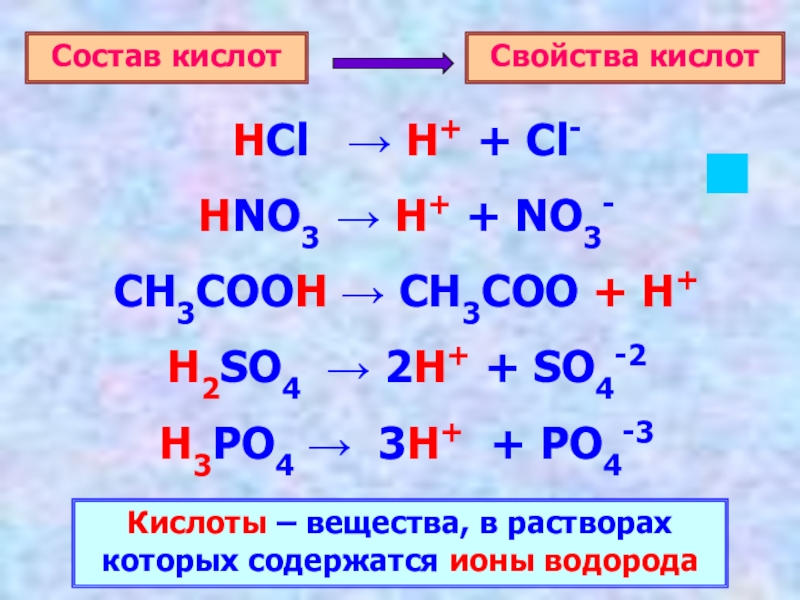
Слайд 3
HCl → H+ + Cl-
HNO3 → H+ + NO3-
CH3COOH →
H2SO4 → 2H+ + SO4-2
H3PO4 → 3H+ + PO4-3
Кислоты – вещества, в растворах которых содержатся ионы водорода
Свойства кислот
Состав кислот
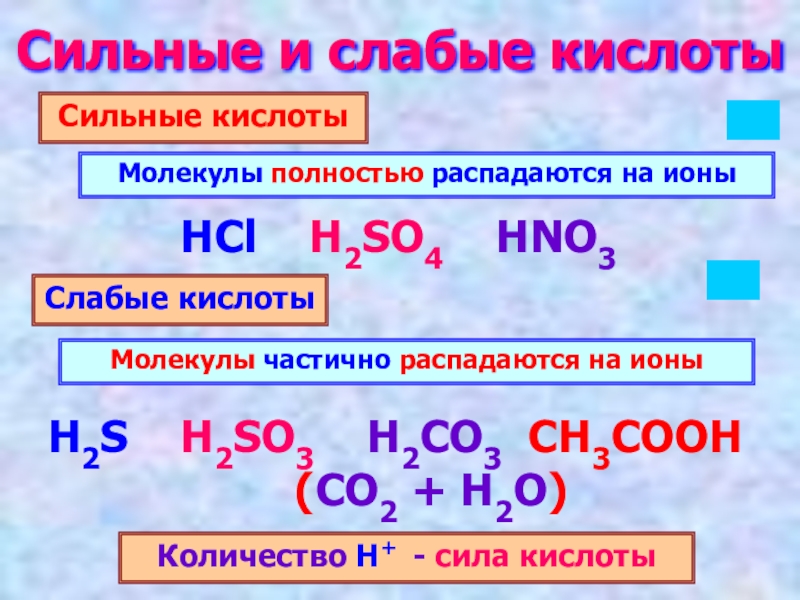
Слайд 4Сильные и слабые кислоты
Сильные кислоты
Слабые кислоты
Молекулы полностью распадаются на ионы
Молекулы частично
Количество Н+ - сила кислоты
HCl H2SO4 HNO3
H2S H2SO3 H2CO3 CH3COOH
(CO2 + H2O)
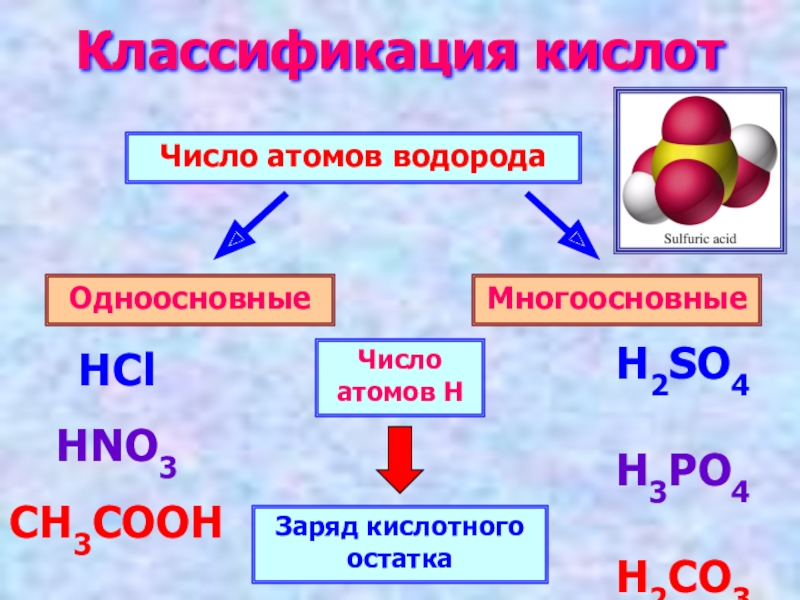
Слайд 5Классификация кислот
Число атомов водорода
Одноосновные
Многоосновные
HCl
HNO3
CH3COOH
H2SO4
H3PO4
H2CO3
Число атомов Н
Заряд кислотного остатка
Слайд 6Наличие кислорода в кислотном остатке
Бескислородные
Кислородсодержащие
HCl
H2S
H2SO3
CH3COOH
Минеральные кислоты
Органические кислоты
Слайд 8Получение кислот
Бескислородные кислоты
Кислородсодержащие кислоты
H2 + S → H2S
H2 + Cl2 →
Кислотный оксид + вода
SO2 + H2O → H2SO3
Слайд 10Физические свойства кислот
Кислый вкус
Плотность больше плотности воды
Разъедающее действие
Вода, раствор питьевой соды
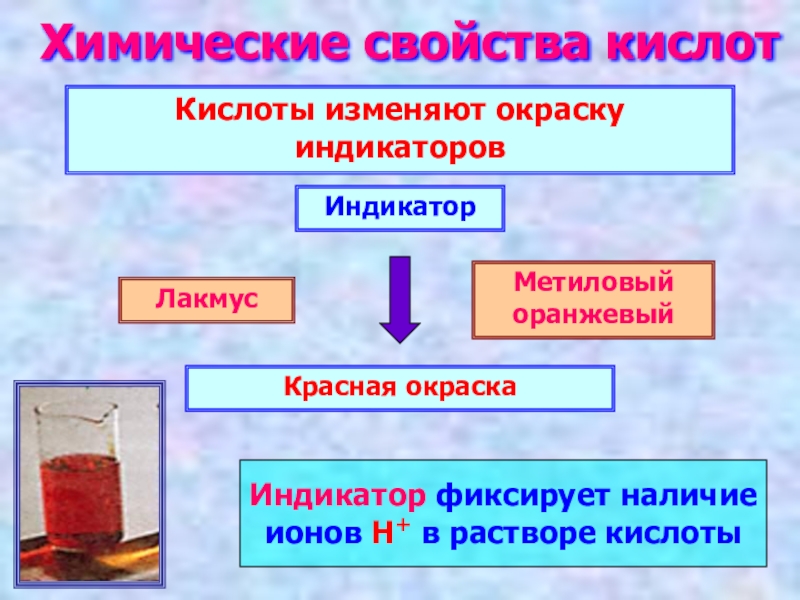
Слайд 12Химические свойства кислот
Кислоты изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Красная окраска
Индикатор
Индикатор фиксирует наличие
Слайд 13Кислоты реагируют с металлами, стоящими в ряду активности до водорода
Zn +
Zn0 – 2e → Zn+2
H+1 + 1e → H0
Восстановитель, окисляется
Окислитель, восстанавливается
Взаимодействие металла с кислотой является окислительно-восстановительной реакцией
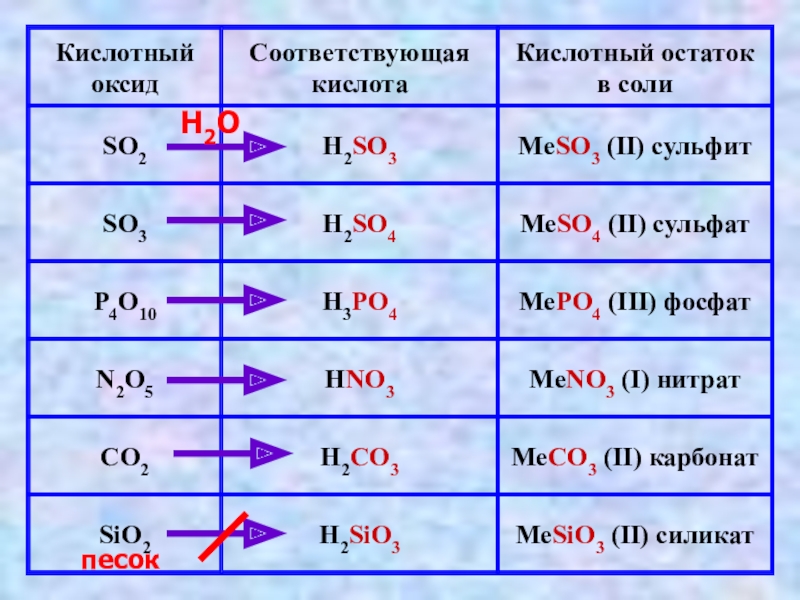
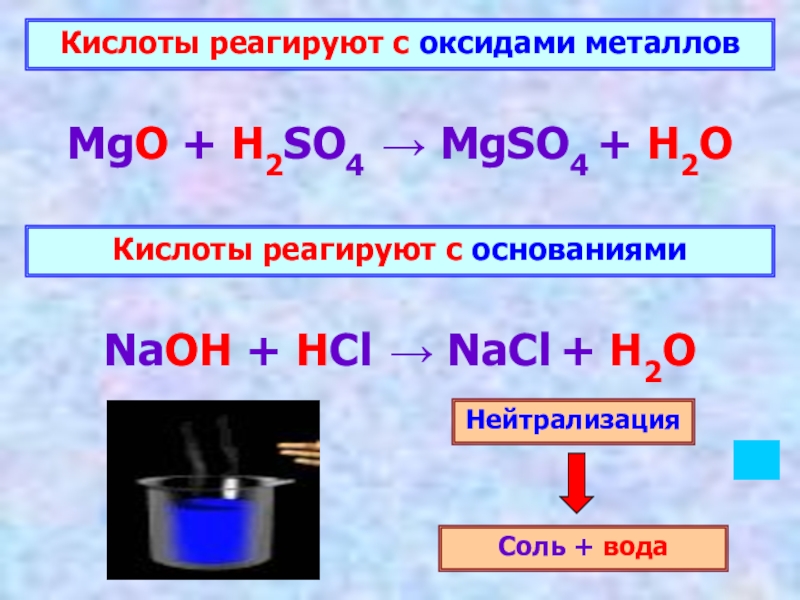
Слайд 14Кислоты реагируют с окcидами металлов
MgO + H2SO4 → MgSO4 + H2O
Кислоты
NaOH + HCl → NaCl + H2O
Нейтрализация
Соль + вода