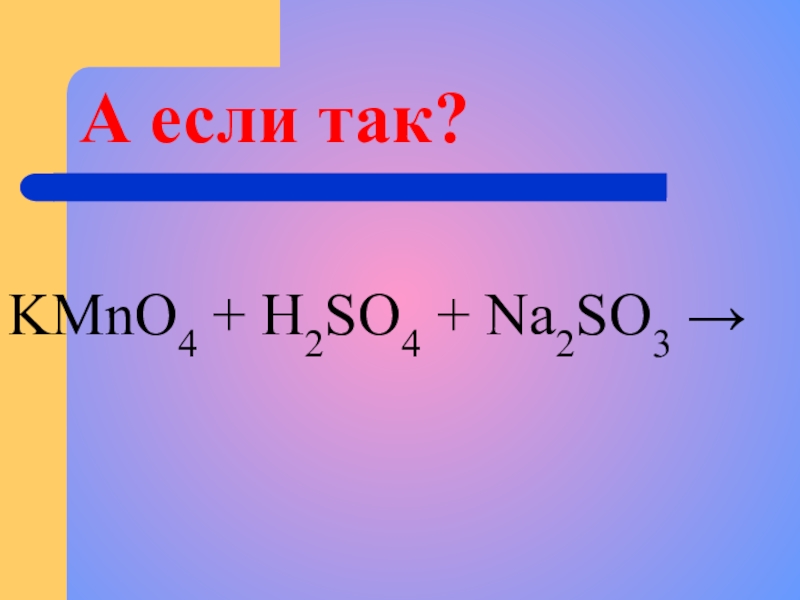- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад для подготовки задания №20 ОГЭ по химии
Содержание
- 1. Презентация для подготовки задания №20 ОГЭ по химии
- 2. Окислительно-восстановительными называются реакции, в ходе которых хотя бы один элемент изменил свою степень окисления.
- 3. Атомы, молекулы или ионы, отдающие
- 4. Рассчитать степени окисления H2S
- 5. ВосстановителиHCl (конц.)НBr (конц.), KBr (тв.)HI (конц.),
- 6. ОкислителиF2
- 7. Тренажер1. H2S + Br2 + H2O →2.
- 8. Тренажер6. H2O2 + H2S →7. KMnO4 +
- 9. Американский химик Роланд Стаут придумал тест
- 10. А если так?KMnO4 + H2SO4 + Na2SO3 →
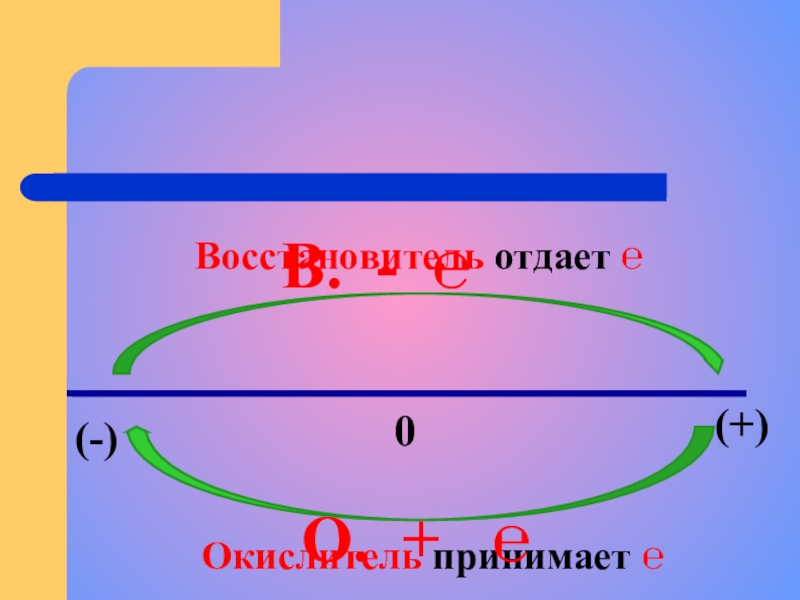
- 11. (-)(+)0Восстановитель отдает ℮Окислитель принимает ℮В. - ℮О. + ℮
- 12. Внимание!Индекс в молекулах простых веществ переносится в
- 13. СПАСИБО ЗА ЗАНЯТИЕ!ЖЕЛАЮ УСПЕХА!
Слайд 2Окислительно-восстановительными называются реакции, в ходе которых хотя бы один элемент изменил
Слайд 3 Атомы, молекулы или ионы, отдающие электроны, называются восстановителями.
Во
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
В ходе реакции они восстанавливаются.
Слайд 4Рассчитать степени окисления
H2S SO3
HNO3 H2SO4 H2СO3
КOH Ca(OH)2 Al(OH)3
Na3PO4 KMnO4 K2Cr2O7
-2 +6 +1 -1 +5
+5 +6 +4
+1 +2 +3
+1 +5 +1 +7 +6
Слайд 5Восстановители
HCl (конц.)
НBr (конц.), KBr (тв.)
HI (конц.), КI (тв.)
H2S , FeS
NH3
металлы
-1
-1
-1 -1
-2 -2
-3
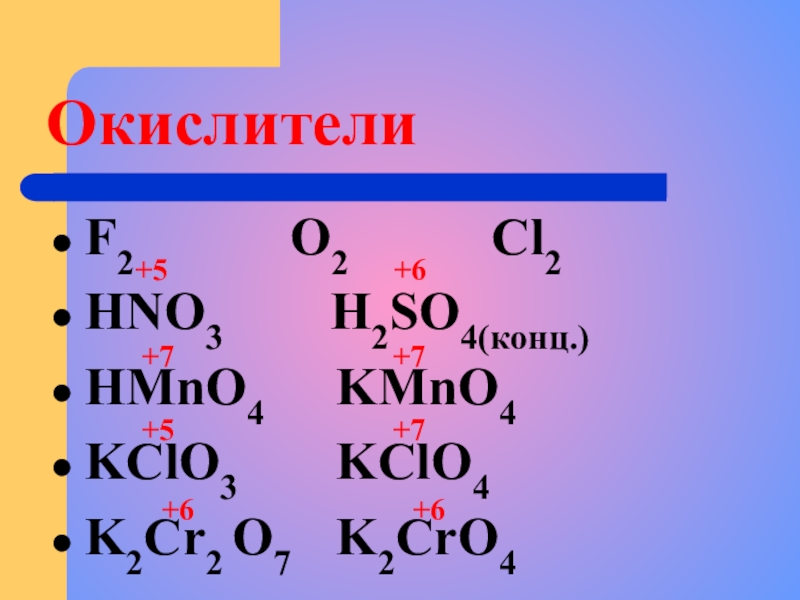
Слайд 6Окислители
F2 O2
HNO3 H2SO4(конц.)
НMnO4 KMnO4
KClO3 KClO4
K2Cr2 O7 K2CrO4
+5 +6
+7 +7
+5 +7
+6 +6
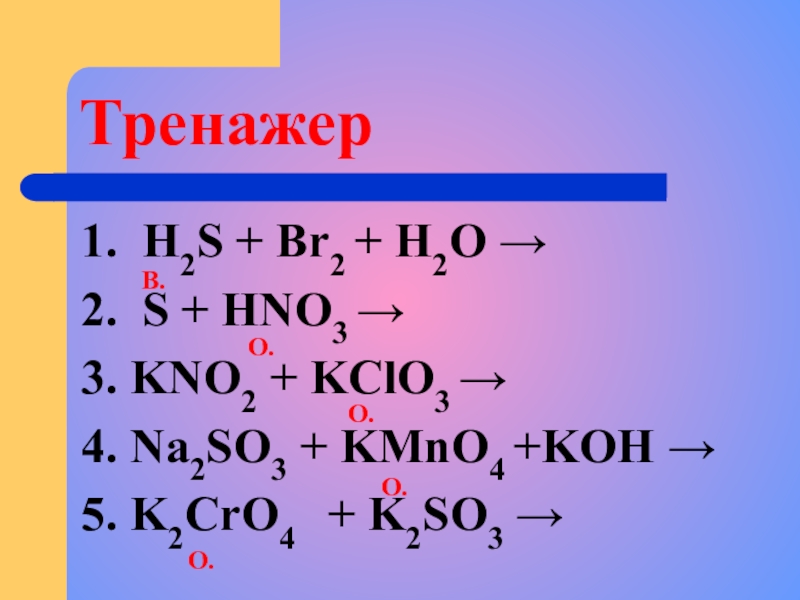
Слайд 7Тренажер
1. H2S + Br2 + H2O →
2. S + HNO3 →
3.
4. Na2SO3 + KMnO4 +KOH →
5. K2CrO4 + K2SO3 →
В.
О.
О.
О.
О.
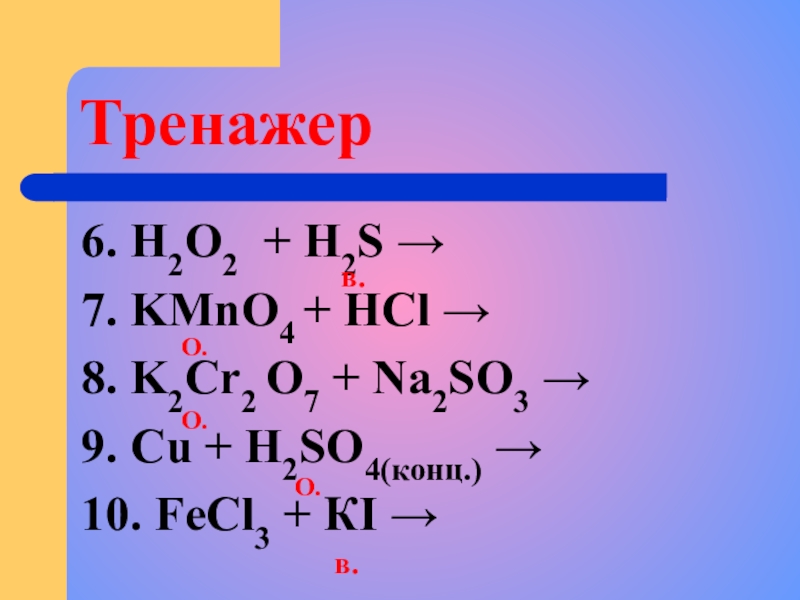
Слайд 8Тренажер
6. H2O2 + H2S →
7. KMnO4 + HCl →
8. K2Cr2 O7
9. Cu + H2SO4(конц.) →
10. FeCl3 + КI →
О.
О.
О.
в.
в.
Слайд 9
Американский химик Роланд Стаут придумал тест на умение определять коэффициенты
10[Cr(CO(NH2)2)6]4[Cr(CN)6]3 + 1176 KMnO4 +
1399 H2SO4 = 35 K2Cr2O7 + 660 KNO3 +
420 CO2 + 223 K2SO4 + 1176 MnSO4 + 1879 H2O
Слайд 12Внимание!
Индекс в молекулах простых веществ переносится в электронный баланс, индексы из
Баланс:
в. 2 Br - - 2 ℮ → Br2
о. О2 + 2*2 ℮ → 2O -2
H2 N2 O2 F2 Cl2 Br2 I2