- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад для подготовки к ЕГЭ по химии Химические связи
Содержание
- 1. Презентация для подготовки к ЕГЭ по химии Химические связи
- 2. Молекула – наименьшая частица вещества, обладающая его
- 3. Вещество – это совокупность атомов и молекул.
- 4. Простых веществ известно около 400.Многие элементы образуют
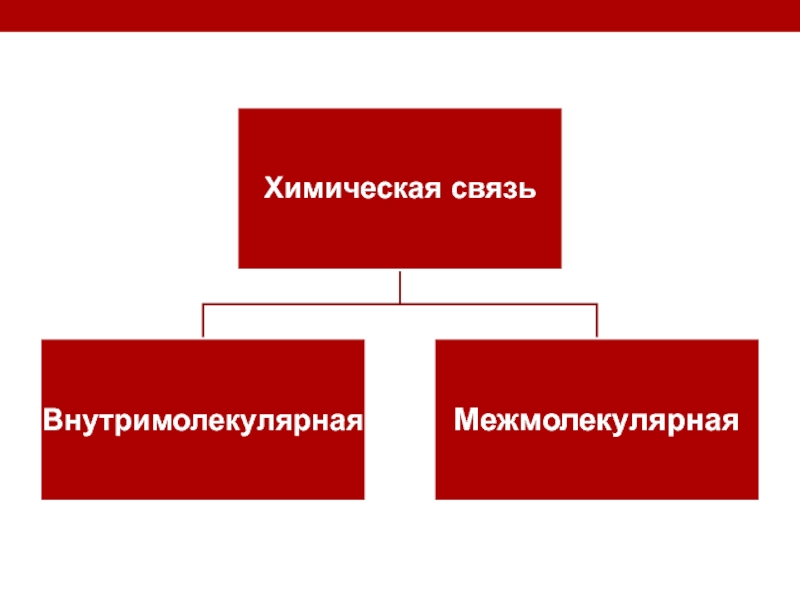
- 5. Химическая связь- взаимодействие двух атомов, осуществляемое путем
- 6. Слайд 6
- 7. Межмолекулярные химические связиВодородные ПептидныеДисульфидныеВан-дер-ваальсовы
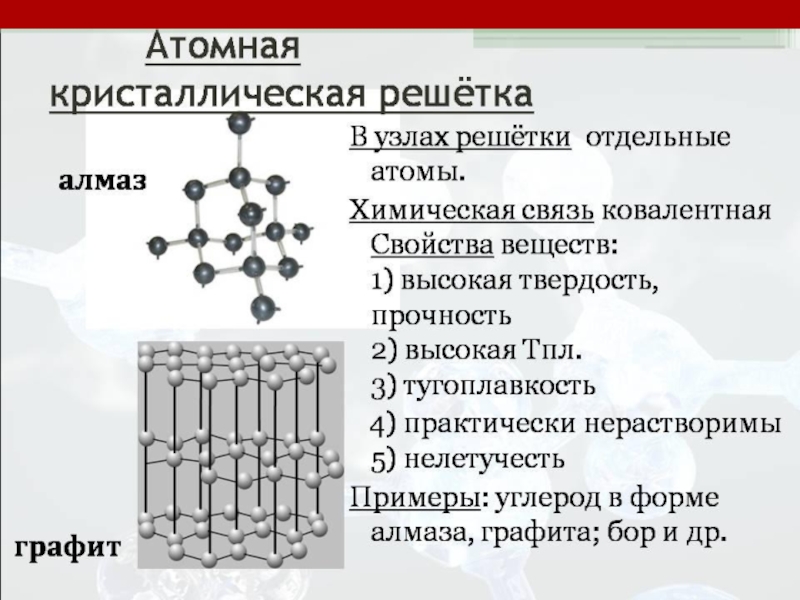
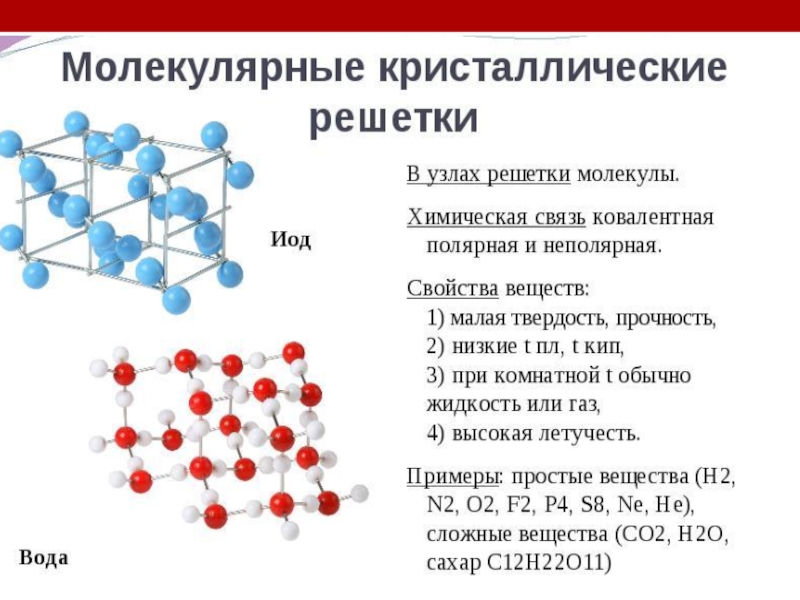
- 8. Внутримолекулярные химические связиКовалентная связь (полярная и неполярная;
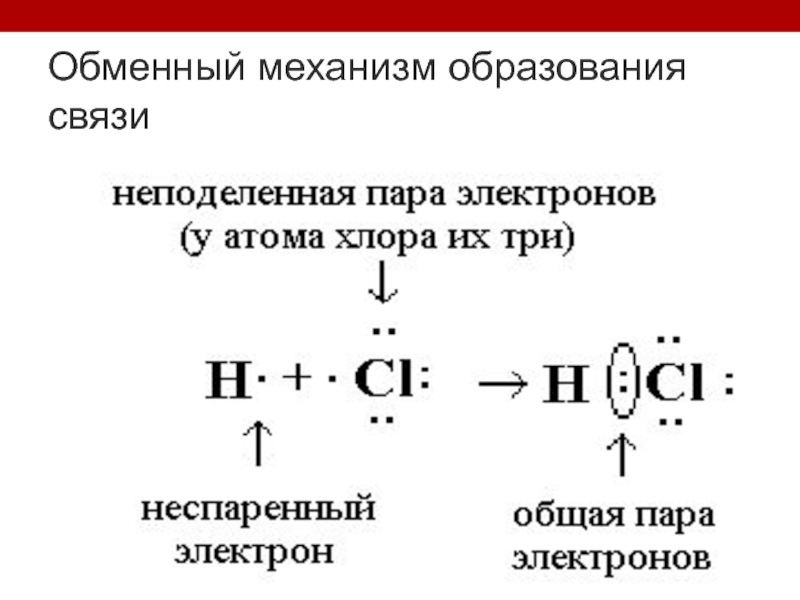
- 9. Обменный механизм образования связи
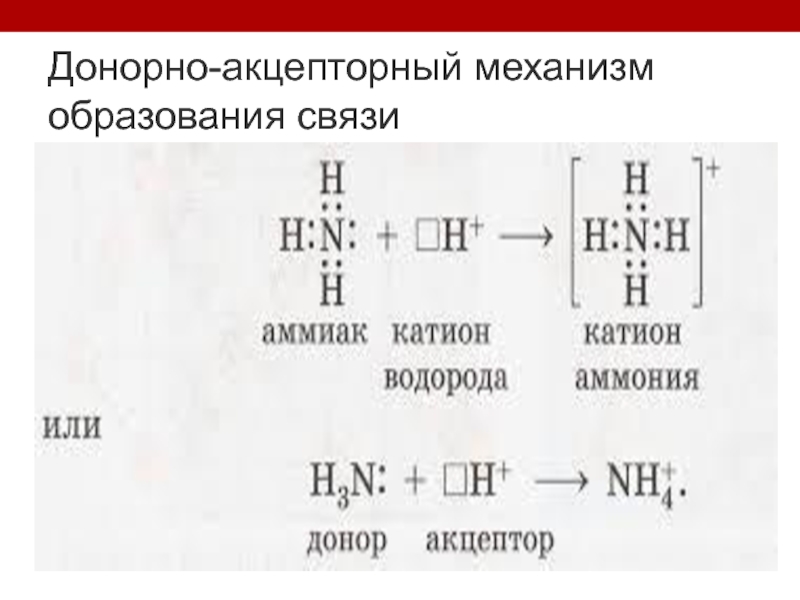
- 10. Донорно-акцепторный механизм образования связи
- 11. Характеристики ковалентной связиПолярность – связь полярная или
- 12. 2. Электроотрицательность (ЭО) атома – способность притягивать
- 13. 3. Порядок (кратность) связи- число электронных пар
- 14. Валентность атома – число химических связей, образованных
- 15. Правила определения степеней окисленияСтепень окисления элемента в
- 16. Степень окисления водорода равна +1, если в
- 17. Ионная связь образуется между металлом и неметаллом,
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
Молекула – наименьшая частица вещества, обладающая его химическими свойствамиМолекула – это совокупность атомов, образующих определенную структуру с помощью химических связей.
Слайд 2Молекула – наименьшая частица вещества, обладающая его химическими свойствами
Молекула – это
совокупность атомов, образующих определенную структуру с помощью химических связей.
Слайд 4Простых веществ известно около 400.
Многие элементы образуют несколько простых веществ, различающихся
составом или строением – этот явление называется аллотропия.
Слайд 5Химическая связь- взаимодействие двух атомов, осуществляемое путем обмена электронов
Правило октета: при
образовании химической связи каждый атом стремится приобрести электронную конфигурацию инертного газа (восемь валентных электронов), отдавая или принимая электроны.
Слайд 8Внутримолекулярные химические связи
Ковалентная связь (полярная и неполярная; обменная и донорно-акцепторная)- образована
атомами неметаллов друг с другом
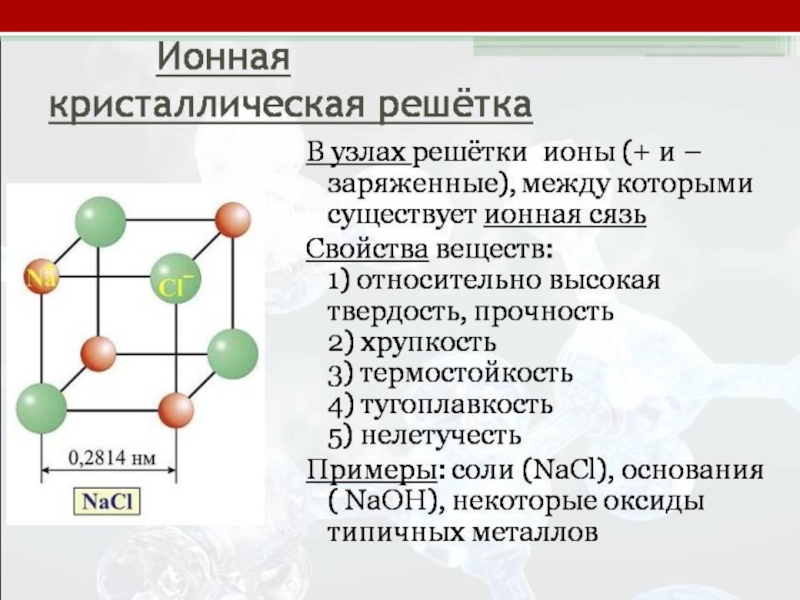
Ионная – образована атомом неметалла и атомом металла
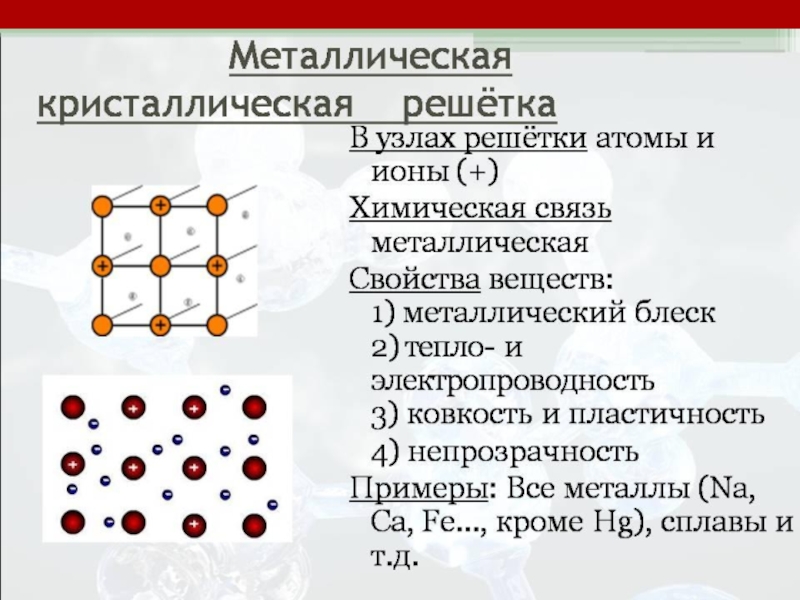
Металлическая
Ионная – образована атомом неметалла и атомом металла
Металлическая
Слайд 11Характеристики ковалентной связи
Полярность – связь полярная или неполярная:
Ковалентную связь, образованную одинаковыми
атомами называют – неполярной (Н2, О2, О3 )
Ковалентную связь, образованную разными атомами – полярной (Н2О, СО2, SО3 )
Ковалентную связь, образованную разными атомами – полярной (Н2О, СО2, SО3 )
Слайд 122. Электроотрицательность (ЭО) атома – способность притягивать к себе валентные электроны
других атомов.
Чем больше разность ЭО, тем белее полярная связь.
Чем больше разность ЭО, тем белее полярная связь.
Слайд 133. Порядок (кратность) связи- число электронных пар участвующих в образовании связи,
обычно это от 1-3
4. Энергия связи, чем больше кратность связи, тем она прочнее
5.Валентный угол между линиями, соединяющими химически связанные атомы, он колеблется от 600 до 1800
4. Энергия связи, чем больше кратность связи, тем она прочнее
5.Валентный угол между линиями, соединяющими химически связанные атомы, он колеблется от 600 до 1800
Слайд 14Валентность атома – число химических связей, образованных данным атомом с другими
атомами в молекуле. Всегда положительное число от 1 до 8
Степень окисления атома – это формальный заряд, который имеет атом в молекуле при условии, что ковалентные связи имеют ионный характер. Степень окисления – это целая величина; она может быть положительной, отрицательной и нулевой.
Степень окисления атома – это формальный заряд, который имеет атом в молекуле при условии, что ковалентные связи имеют ионный характер. Степень окисления – это целая величина; она может быть положительной, отрицательной и нулевой.
Слайд 15Правила определения степеней окисления
Степень окисления элемента в простых веществах равна 0.
Фтор
– самый электроотрицательный элемент, он может только принимать электроны, с.о. всегда равна -1
Кислород – самый электроотрицательный после фтора, степень окисления кислорода во всех соединениях, кроме F2O и перекисных соединений , равна -2
Кислород – самый электроотрицательный после фтора, степень окисления кислорода во всех соединениях, кроме F2O и перекисных соединений , равна -2
Слайд 16Степень окисления водорода равна +1, если в соединении есть хотя бы
один неметалл; -1 в соединениях с металлами (гидридах).
Степень окисления металлов всегда положительна. Максимальная положительная степень окисления равна номеру группы (исключения - Cu+2, Au+2 ). Минимальная степень окисления равна: а) 0 для металлов б) номер группы минус восемь для неметаллов
Сумма степеней окисления атомов в молекуле (ионе) равна 0 (заряду иона)
Степень окисления металлов всегда положительна. Максимальная положительная степень окисления равна номеру группы (исключения - Cu+2, Au+2 ). Минимальная степень окисления равна: а) 0 для металлов б) номер группы минус восемь для неметаллов
Сумма степеней окисления атомов в молекуле (ионе) равна 0 (заряду иона)
Слайд 17Ионная связь образуется между металлом и неметаллом, предельный случай ковалентной полярной
связи
Металлическая связь – это связь между положительными ионами в кристаллах металлов, осуществляется за счет числа общих электронов («электронного газа»)
Водородная связь – это межмолекулярная связь
Металлическая связь – это связь между положительными ионами в кристаллах металлов, осуществляется за счет числа общих электронов («электронного газа»)
Водородная связь – это межмолекулярная связь