- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Азот. Строение атома
Содержание
- 1. Презентация Азот. Строение атома
- 2. Азот:положение в П.С.Э., строение атома, нахождение в природе, получение и свойства. Применение азота.
- 3. ЦЕЛИ :Сформировать представление о строении атома и
- 4. ПЛАН УРОКАИстория открытияНахождение в природеСтроение и свойства атома и молекулыФизические и химические свойстваПолучение и применение
- 5. ДЕВИЗ УРОКА : «Нет жизни без азота,
- 6. ИСТОРИЯ ОТКРЫТИЯ1772г. К.Шееле и Г.Кавендиш получили азотД.Резерфорд
- 7. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии (смотри таблицу)
- 8. N2
- 9. Вот, что писали знаменитые учёные об Азоте:Ф.
- 10. Постановка проблемы: Азот – «безжизненный» элемент
- 11. СТРОЕНИЕ И СВОЙСТВА АТОМА ? период, ?
- 12. СТРОЕНИЕ И СВОЙСТВА АТОМА 2 период, 5
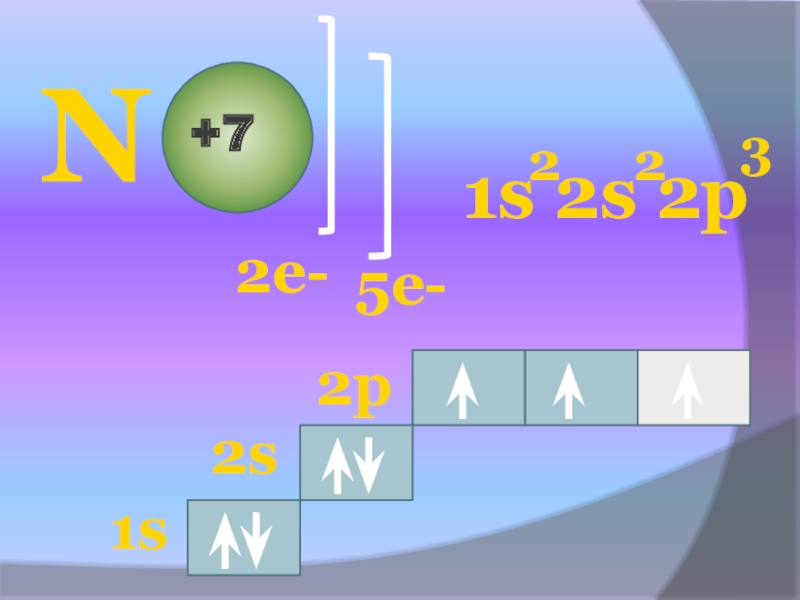
- 13. N+72е-5е-1s 2s 2p2231s2s2p
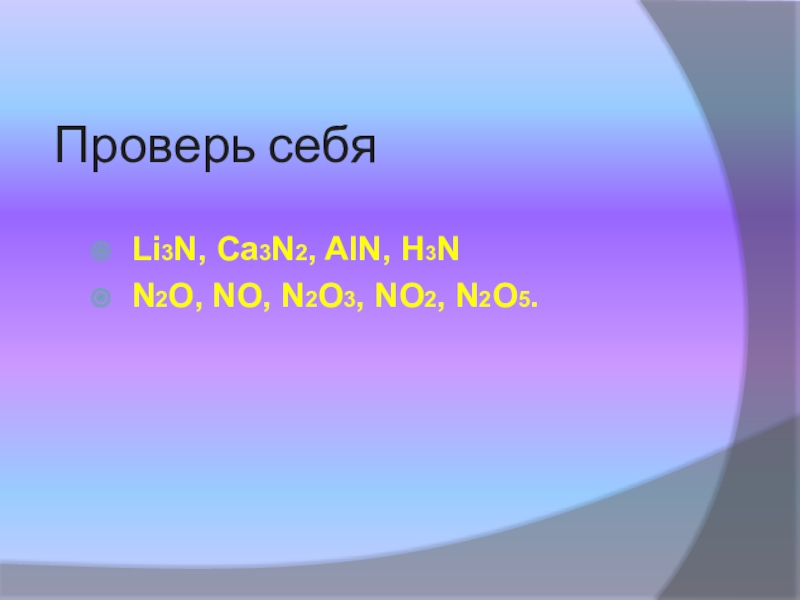
- 14. Проверь себяLi3N, Ca3N2, AlN, H3NN2O, NO, N2O3, NO2, N2O5.
- 15. Возможные степени окисления 0+1+2+3+4+5-3N2N2O3NO2N2O5NH3NON2O
- 16. Цель урока: На примере сведений
- 17. План изучения азота:Строение молекулыФизические свойстваХимические свойстваСпособы полученияПрименение азота и его значение
- 18. СТРОЕНИЕ МОЛЕКУЛЫ N N
- 19. N2молекулярная формулаNNэлектронная формуластруктурная формулаКовалентнаянеполярная связь
- 20. ФИЗИЧЕСКИЕ СВОЙСТВА.Газ без цвета, запаха и вкусаПлохо растворим в водеНемного легче воздухаTºпл.= -210ºСTºкип.= -196ºС
- 21. азот - простое вещество, В, Ц, З,
- 22. ХИМИЧЕСКИЕ СВОЙСТВА Задание: дать полную характеристику
- 23. ПРОВЕРЬ СЕБЯN2+3H2 ═ 2NH3 +QОбратимаяСоединения
- 24. получениев лабораториив промышленностиNH4NO2 → N2 + 2H2tВыделение из сжиженного воздуха
- 25. Слайд 25
- 26. Вопросы для самоконтроляГаз без
- 27. ПРОВЕРЬ СЕБЯO2 1, 2, 4, 5,
- 28. Домашнее заданиеПараграф №23 , выполнить задания 1,3
Слайд 2
Азот:
положение в П.С.Э.,
строение атома, нахождение
в природе, получение и свойства.
Слайд 3ЦЕЛИ :
Сформировать представление о строении атома и молекулы азота.
Рассмотреть физические и
Показать значение азота как биогенного элемента.
Слайд 4ПЛАН УРОКА
История открытия
Нахождение в природе
Строение и свойства атома и молекулы
Физические и
Получение и применение
Слайд 5ДЕВИЗ УРОКА :
«Нет жизни без азота,
ибо он является непременной составной
Д.Н.Прянишников
Слайд 6ИСТОРИЯ ОТКРЫТИЯ
1772г. К.Шееле и Г.Кавендиш получили азот
Д.Резерфорд описал получение и свойства
1787г.
Многочисленные названия: нечистый гас, удушливый гас, септон, испорченный воздух, огорюченный воздух, селитрород, гнилотвор, смертельный гас, нитроген и др.
Слайд 7НАХОЖДЕНИЕ В ПРИРОДЕ: 1)в свободном состоянии в атмосфере (78%), 2)в связанном состоянии
Слайд 9
Вот, что писали знаменитые учёные об Азоте:
Ф. Энгельс – «Жизнь есть
тел на Земле»
Д. Резерфорд – «Удушливый воздух»
К. Шееле – «Дурной возух»
А. Лавуазье – «Безжизненный воздух»
Д.И. Прянишников – «Нет жизни без азота, ибо он является
важнейшей составляющей частью
белковой молекулы».
Слайд 10Постановка проблемы:
Азот – «безжизненный» элемент
жизни на Земле?
Слайд 11СТРОЕНИЕ И СВОЙСТВА АТОМА
? период, ? группа,
? подгруппа
Содержит на
? ?
?
N0 + 3e- N-3
* Составьте формулы соединений N с Li, Са, Al.
?
N0 –1,2,3,4,5e- N+1,N+2,N+3,N+4,N+5
* Составьте формулы оксидов
3
1
2
4
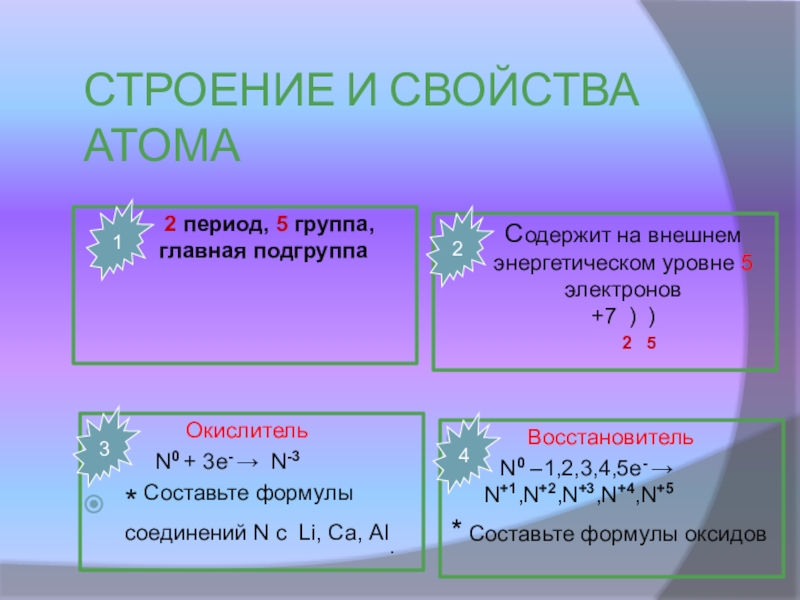
Слайд 12СТРОЕНИЕ И СВОЙСТВА АТОМА
2 период, 5 группа, главная подгруппа
Содержит на
2 5
Окислитель
N0 + 3e- N-3
* Составьте формулы соединений N с Li, Са, Al.
Восстановитель
N0 –1,2,3,4,5e- N+1,N+2,N+3,N+4,N+5
* Составьте формулы оксидов
3
1
2
4
Слайд 16Цель урока:
На примере сведений об азоте, привести аргументы
Азот – «безжизненный».
2. Азот – главный элемент жизни на Земле.
Слайд 17План изучения азота:
Строение молекулы
Физические свойства
Химические свойства
Способы получения
Применение азота и его значение
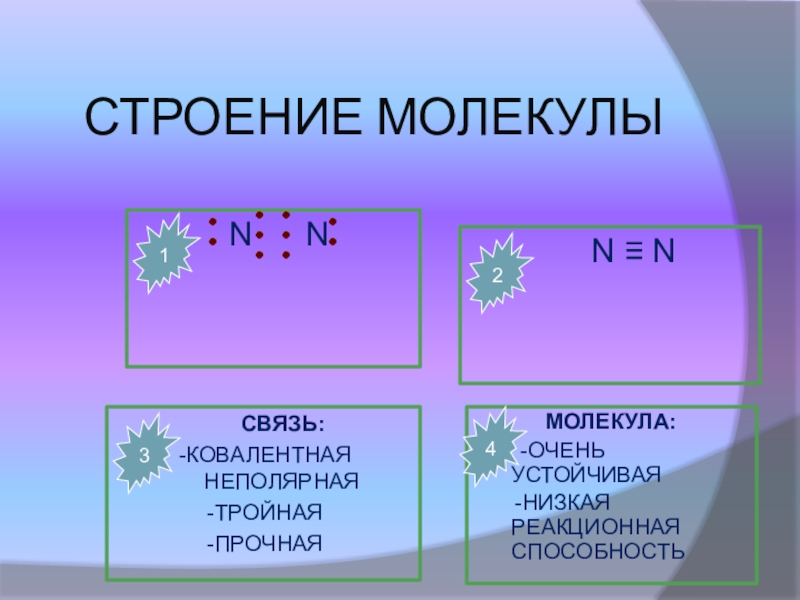
Слайд 18СТРОЕНИЕ МОЛЕКУЛЫ
N N
СВЯЗЬ:
-КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ
-ТРОЙНАЯ
-ПРОЧНАЯ
МОЛЕКУЛА:
-ОЧЕНЬ УСТОЙЧИВАЯ
-НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
1
3
4
2
Слайд 20ФИЗИЧЕСКИЕ СВОЙСТВА.
Газ без цвета, запаха и вкуса
Плохо растворим в воде
Немного легче
Tºпл.= -210ºС
Tºкип.= -196ºС
Слайд 22ХИМИЧЕСКИЕ СВОЙСТВА Задание: дать полную характеристику реакциям *; при каких условиях
Окислительные N20 2N-3
При нагревании с другими металлами(Ca, Al, Fe)
При комнатной tº только с Li
*При высокой tº, р, kat (Fe, оксиды Al, K) с H2
Восстановительные N20 2N+2
*При tº электрической дуги (3000 - 4000ºС) с О2
Слайд 23ПРОВЕРЬ СЕБЯ
N2+3H2 ═ 2NH3 +Q
Обратимая
Соединения
Экзотермическая
Гомогенная
Каталитическая
с N2 и
tº уменьшить
р увеличить
N2+O2 ═ 2NO –Q
Обратимая
Соединения
Эндотермическая
Гомогенная
Некаталитическая
с N2 и O2 увеличить
tº увеличить
р не влияет
Слайд 25 Применение
Получение аммиака
Создание инертной
Создание низких температур
Насыщение поверхности стали для повышения прочности
Жидкий азот в медицине
Синтез аммиака
Производство удобрений
Синтез азотной кислоты
Создание инертной среды
N2
Слайд 26 Вопросы для самоконтроля
Газ без цвета , вкуса и
Молекула двухатомна
Содержание в воздухе 78 %
В лаборатории получают разложением KMnO4 и H2O2
В промышленности – из жидкого воздуха
Химически малоактивен
Взаимодействует почти со всеми простыми веществами
С ним связаны процессы дыхания и фотосинтеза
Является составной частью белков
Участвует в круговороте веществ в природе
Слайд 27ПРОВЕРЬ СЕБЯ
O2 1, 2, 4, 5, 7, 8, 10.
N2 1, 2, 3, 5, 6, 9, 10. « 5 »
1-2 ошибки « 4 »
3-4 ошибки « 3 »
5 ошибок и более « 2 »
На примере сведений об азоте, приведите
аргументы в пользу двух точек зрения:
1. Азот – «безжизненный»
2. Азот – главный элемент жизни на Земле.