- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Азот и его свойства
Содержание
- 1. Презентация Азот и его свойства
- 2. ЦЕЛИ УРОКА:Сформировать представление о строении атома и
- 3. Нахождение в природе.Вне пределов Земли азот обнаружен
- 4. История открытия.1772г. К.Шееле и Г.Кавендиш получили азот.Д.Резерфорд
- 5. Распространение в природеАзот в связанном
- 6. Строение - свойства Внешняя электронная
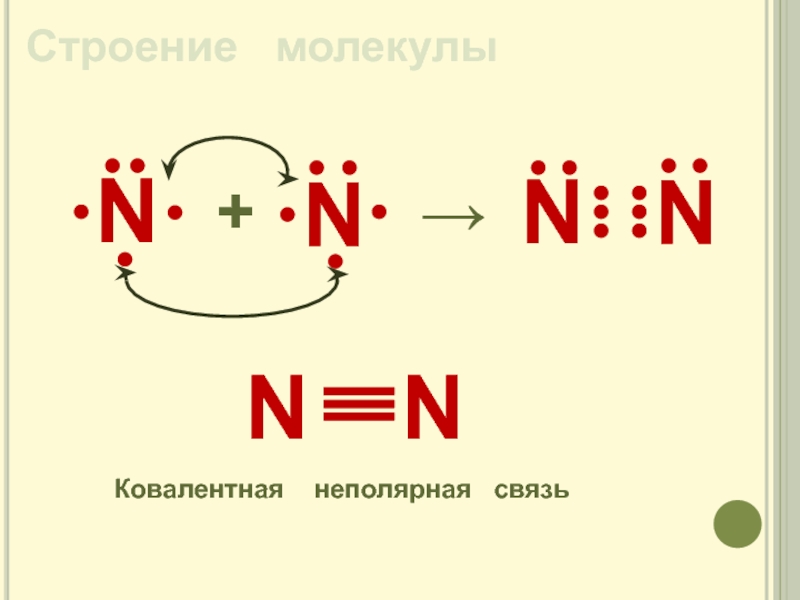
- 7. Строение молекулыN+→NКовалентная неполярная связь
- 8. Физические свойстваБесцветный газ, без запаха, плохо растворимый в водеТпл = -210 0СТкип = -195,8 0С
- 9. Химические свойства1. Взаимодействие с
- 10. Химические свойства2. Взаимодействие с
- 11. Получение Разделение жидкого воздуха на кислород и
- 12. Получение в лаборатории1. Разложение нитрита
- 13. Применение азотаЖидкий азот применяется как хладагент и для криотерапии.Промышленные применения
- 14. Ответы:Вариант 1.
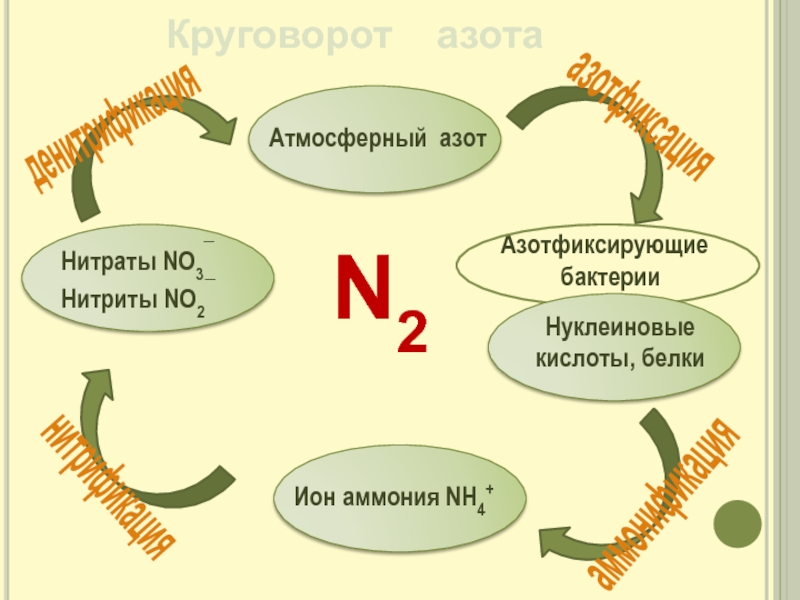
- 15. Круговорот азотаазотфиксацияденитрификацияаммонификациянитрификацияN2
- 16. Важной областью применения азота является его использование
- 17. СПАСИБО ЗА ВНИМАНИЕ!
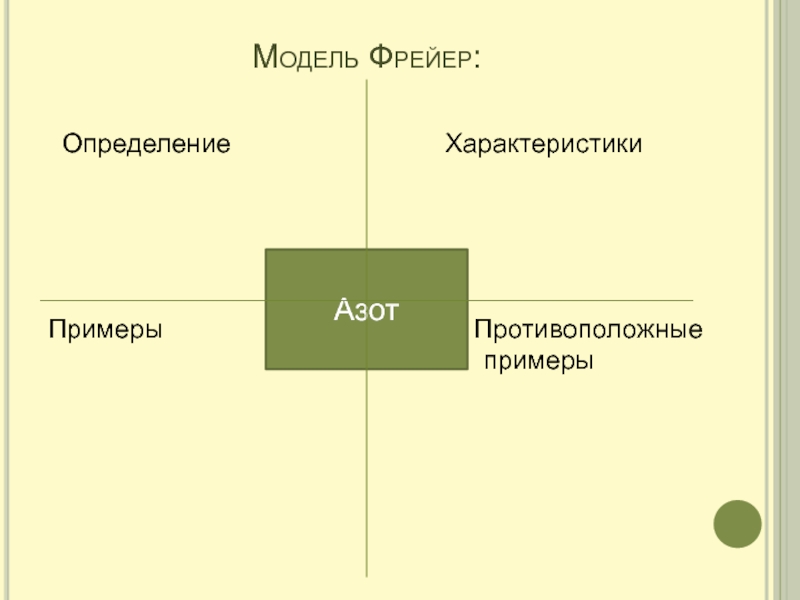
- 18. Модель Фрейер: Определение
ЦЕЛИ УРОКА:Сформировать представление о строении атома и молекулы азота.Рассмотреть физические и химические свойства азота в свете ОВР.Показать значение азота как биогенного элемента.
Слайд 2ЦЕЛИ УРОКА:
Сформировать представление о строении атома и молекулы азота.
Рассмотреть физические и
химические свойства азота в свете ОВР.
Показать значение азота как биогенного элемента.
Показать значение азота как биогенного элемента.
Слайд 3Нахождение в природе.
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне,
межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87×1015 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)×1015 т (причём в гумусе — порядка 6×1010т), а в мантии Земли — 1,3×1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87×1015 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)×1015 т (причём в гумусе — порядка 6×1010т), а в мантии Земли — 1,3×1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.
Слайд 4История открытия.
1772г. К.Шееле и Г.Кавендиш получили азот.
Д.Резерфорд описал получение и свойства.
1787г.
Лавуазье предложил название азот – «безжизненный» (а – отсутствие, зоо – жизнь)
Многочисленные названия: нечистый газ, удушливый газ, септон, испорченный воздух, огорюченный воздух, селитрород, гнилотвор, смертельный газ, нитроген и др.
Многочисленные названия: нечистый газ, удушливый газ, септон, испорченный воздух, огорюченный воздух, селитрород, гнилотвор, смертельный газ, нитроген и др.
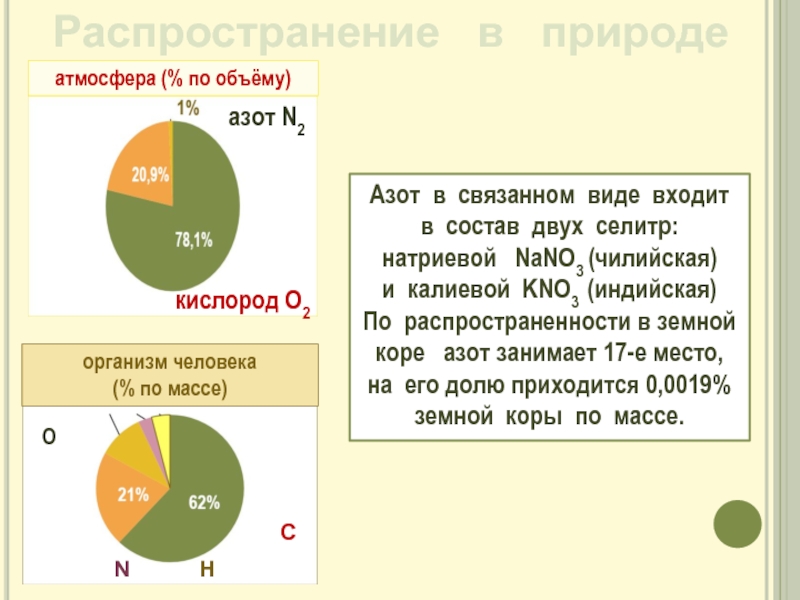
Слайд 5Распространение в природе
Азот в связанном виде входит
в состав двух селитр: натриевой NaNO3 (чилийская) и калиевой KNO3 (индийская)
По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0,0019% земной коры по массе.
По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0,0019% земной коры по массе.
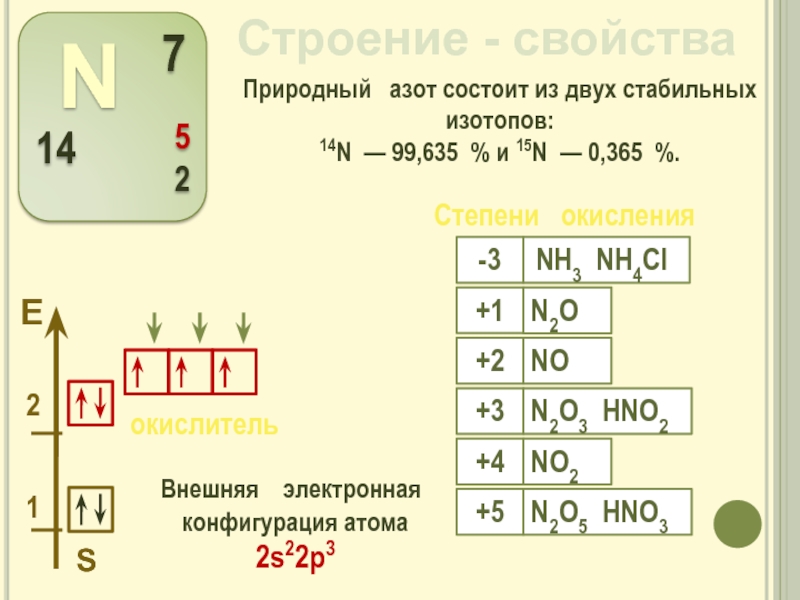
Слайд 6Строение - свойства
Внешняя электронная конфигурация атома
2s22р3
S
Природный азот состоит из двух стабильных изотопов:
14N — 99,635 % и 15N — 0,365 %.
Степени окисления
Слайд 8Физические свойства
Бесцветный газ, без запаха, плохо растворимый в воде
Тпл =
-210 0С
Ткип = -195,8 0С
Ткип = -195,8 0С
Слайд 9Химические свойства
1. Взаимодействие с металлами
6 Li + N2 2 Li3N (нитрид лития)
2 Al + N2 2 AlN (нитрид алюминия)
2 Al + N2 2 AlN (нитрид алюминия)
Слайд 10Химические свойства
2. Взаимодействие с кислородом
N2 + О2 2 NO
Температура электрической дуги 3000 - 4000 0С
(или в атмосфере при грозовых разрядах)
Температура электрической дуги 3000 - 4000 0С
(или в атмосфере при грозовых разрядах)
3. Взаимодействие с водородом
N2 + 3 Н2 2 NН3
t
t, р
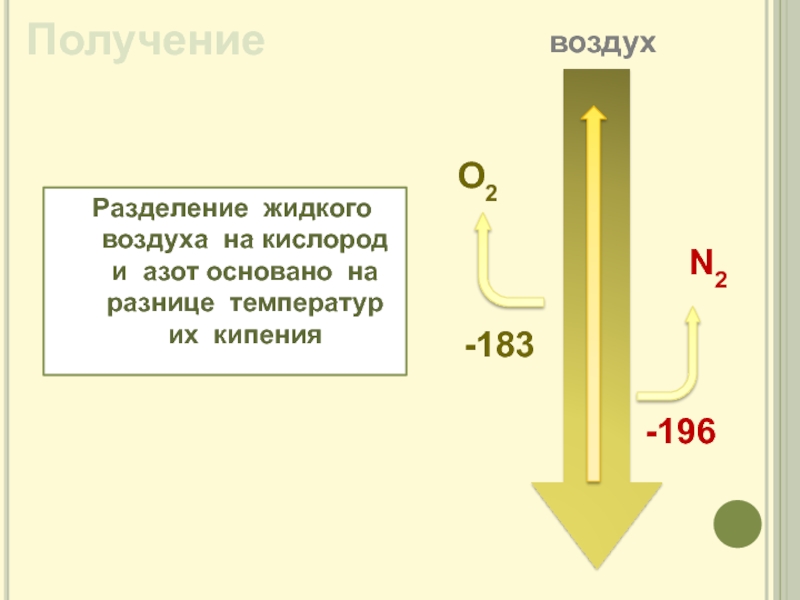
Слайд 11Получение
Разделение жидкого воздуха на кислород и азот основано на разнице
температур их кипения
O2
N2
-196
-183
воздух
Слайд 13Применение азота
Жидкий азот применяется как хладагент и для криотерапии.
Промышленные применения газообразного азота обусловлены его
инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода.
Слайд 16Важной областью применения азота является его использование для дальнейшего синтеза самых
разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среде в мягкой таре.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среде в мягкой таре.