- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад 8кл.по химии. Решение задач.Расчеты по химическим формулам
Содержание
- 1. Презентация 8кл.по химии. Решение задач.Расчеты по химическим формулам
- 2. Задачи урока:1. Продолжить формирование понятий: количество вещества,
- 3. Что это?
- 4. Эпиграф:О, физика – наука из наук!Все впереди!Как
- 5. 1. Что такое количество вещества? 2.
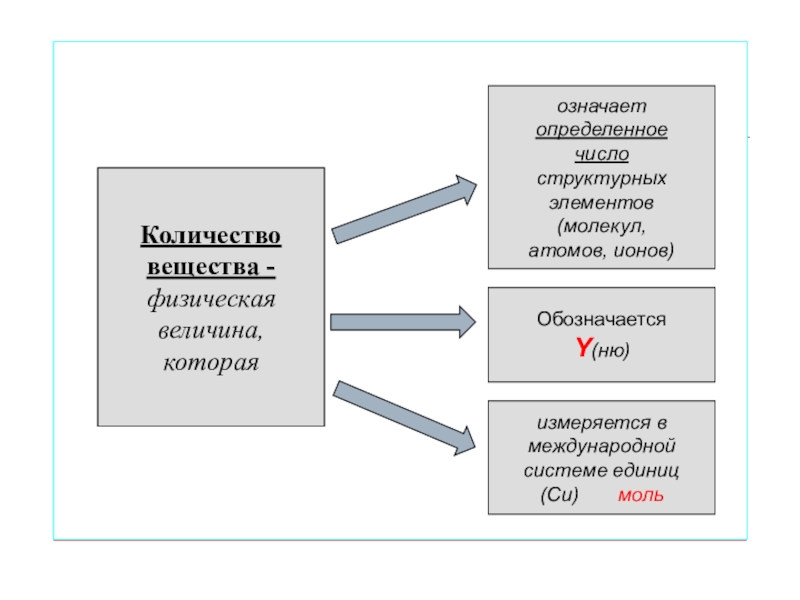
- 6. Количество вещества -физическаявеличина,которая означает Обозначается измеряется в международной системе единиц(Си)
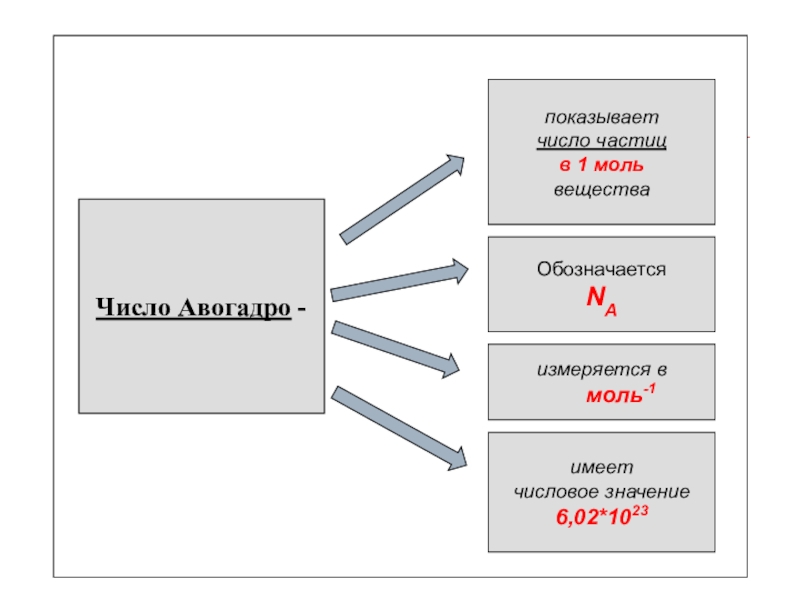
- 7. Число Авогадро - показывает Обозначается измеряется в имеет числовое значение
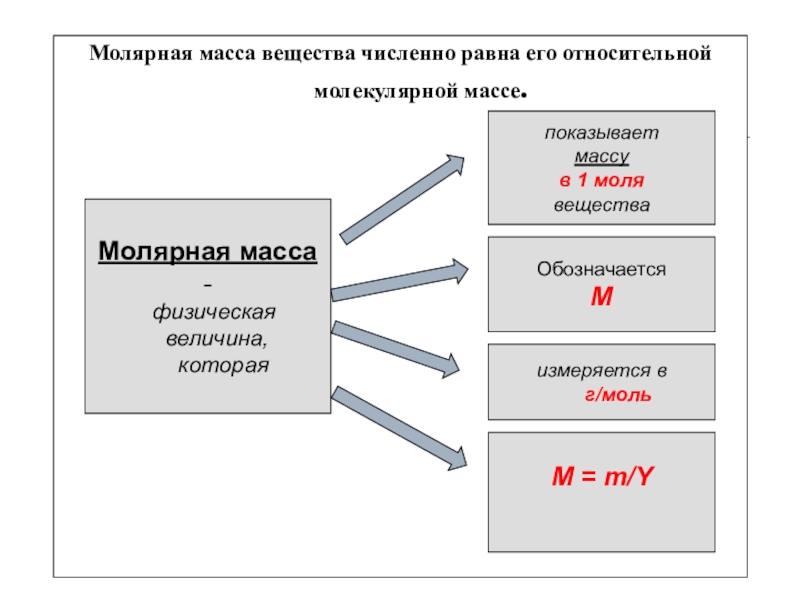
- 8. Молярная масса вещества численно равна
- 9. Количество вещества -физическаявеличина,которая означает определенноечислоструктурныхэлементов(молекул,атомов, ионов)ОбозначаетсяY(ню)измеряется в международной системе единиц(Си) моль
- 10. Число Авогадро - показываетчисло частицв
- 11. Молярная масса вещества численно равна
- 12. Самостоятельное решение расчетных задач.
- 13. ответМAl2(SO4)3= 27*2+32*3+16*4*3=342г/моль – это будет 1моль,
- 14. Практическое исследованиеЗадание №1. Каждый день мы употребляем
- 15. Карта исследования по теме: «Количество вещества.
- 16. Слайд 16
- 17. Вывод: Зная массу
- 18. Практикум по решению задачI. Вычисление молярной массыM
- 19. III. Вычисление количества вещества по его массе
Задачи урока:1. Продолжить формирование понятий: количество вещества, моль, молярная масса, число Авогадро, .2. Выявить их взаимосвязь, пользоваться ими при решении экспериментальных задач.3. Вспомнить правила определения массы вещества .4. Закрепить навыки решения задач по данной теме.
Слайд 2Задачи урока:
1. Продолжить формирование понятий: количество вещества, моль, молярная масса, число
Авогадро, .
2. Выявить их взаимосвязь, пользоваться ими при решении экспериментальных задач.
3. Вспомнить правила определения массы вещества .
4. Закрепить навыки решения задач по данной теме.
2. Выявить их взаимосвязь, пользоваться ими при решении экспериментальных задач.
3. Вспомнить правила определения массы вещества .
4. Закрепить навыки решения задач по данной теме.
Слайд 4Эпиграф:
О, физика – наука из наук!
Все впереди!
Как мало за плечами!
Пусть химия
нам будет вместо рук.
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
(отрывок из поэмы М. Алигер
“Ленинские горы”)
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
(отрывок из поэмы М. Алигер
“Ленинские горы”)
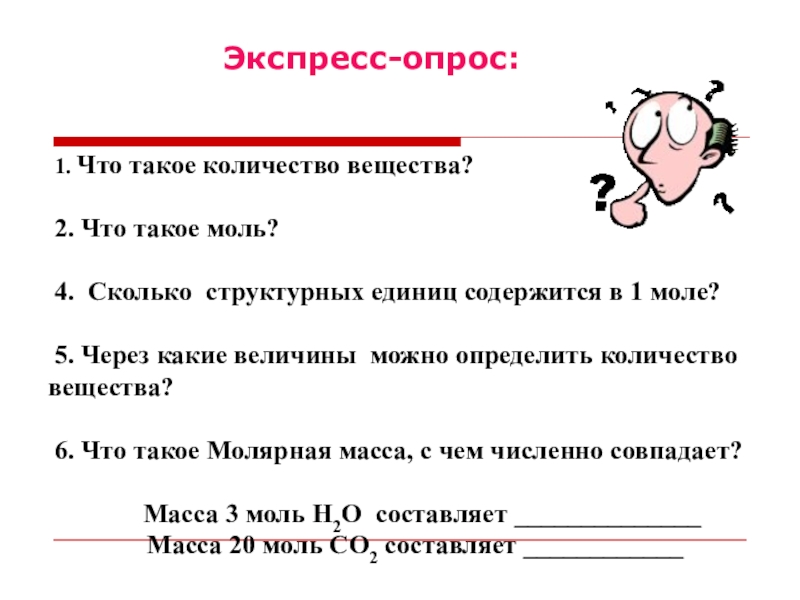
Слайд 5 1. Что такое количество вещества?
2. Что такое моль?
4.
Сколько структурных единиц содержится в 1 моле?
5. Через какие величины можно определить количество вещества?
6. Что такое Молярная масса, с чем численно совпадает?
Масса 3 моль H2O составляет ______________
Масса 20 моль СО2 составляет ____________
5. Через какие величины можно определить количество вещества?
6. Что такое Молярная масса, с чем численно совпадает?
Масса 3 моль H2O составляет ______________
Масса 20 моль СО2 составляет ____________
Экспресс-опрос:
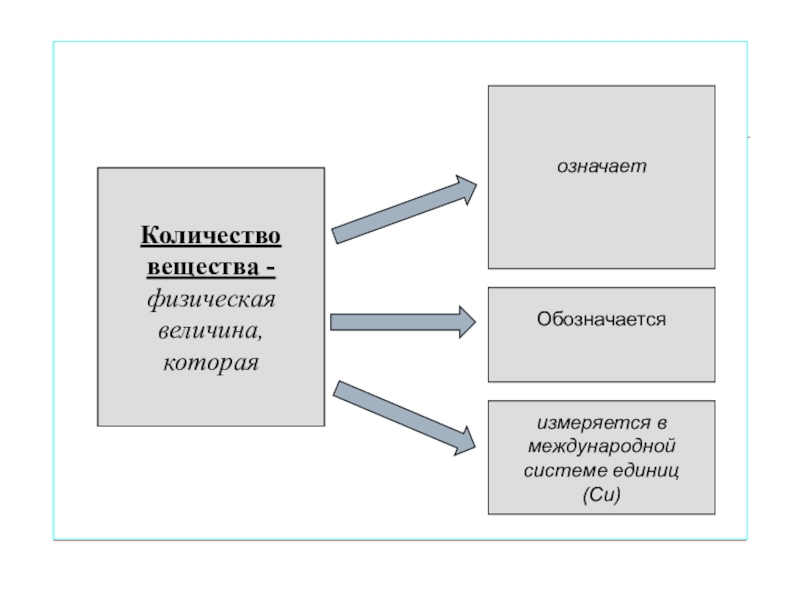
Слайд 6
Количество
вещества -
физическая
величина,
которая
означает
Обозначается
измеряется в
международной
системе единиц
(Си)
Слайд 8
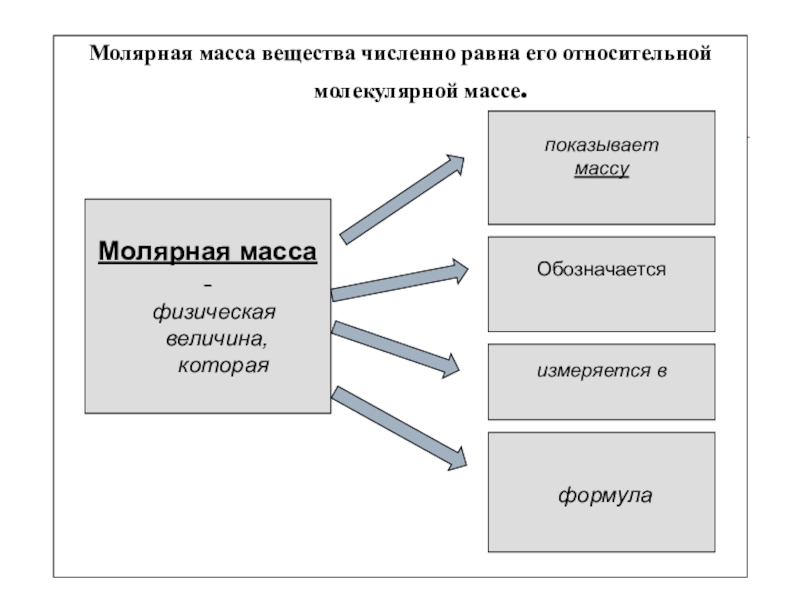
Молярная масса вещества численно равна его относительной молекулярной массе.
Молярная
масса -
физическая
величина,
которая
физическая
величина,
которая
показывает
массу
Обозначается
измеряется в
формула
Слайд 9
Количество
вещества -
физическая
величина,
которая
означает
определенное
число
структурных
элементов
(молекул,
атомов, ионов)
Обозначается
Y(ню)
измеряется в
международной
системе
единиц
(Си) моль
(Си) моль
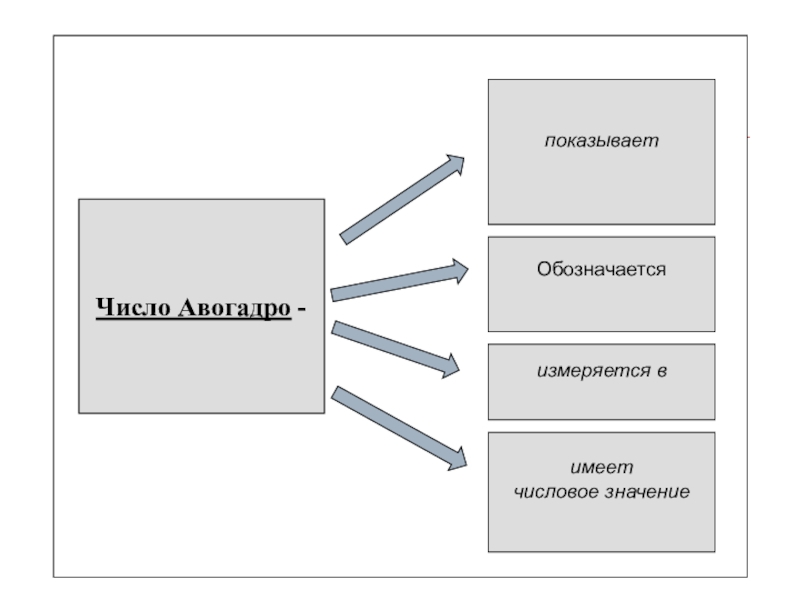
Слайд 10
Число Авогадро -
показывает
число частиц
в 1 моль
вещества
Обозначается
NA
измеряется в
моль-1
имеет
числовое значение
6,02*1023
Слайд 11
Молярная масса вещества численно равна его относительной молекулярной массе.
Молярная
масса -
физическая
величина,
которая
физическая
величина,
которая
показывает
массу
в 1 моля
вещества
Обозначается
М
измеряется в
г/моль
М = т/Y
Слайд 13ответ
МAl2(SO4)3= 27*2+32*3+16*4*3=342г/моль –
это будет 1моль,
а 34,2г
– 0,1моль
МCaCO3 = 40 + 12 = 16*3 = 100г/моль – это 1моль,
а 25г – это 0,25моль
МMgO = 24+ 16 = 40г/моль – это 1моль, а 0,3 моль
будут весить
40г/моль*0,3моль = 12г
1мольCl2 составит 71г/моль, а 2,5 моль =
71г/моль*2,5моль = 177,5г
МCaCO3 = 40 + 12 = 16*3 = 100г/моль – это 1моль,
а 25г – это 0,25моль
МMgO = 24+ 16 = 40г/моль – это 1моль, а 0,3 моль
будут весить
40г/моль*0,3моль = 12г
1мольCl2 составит 71г/моль, а 2,5 моль =
71г/моль*2,5моль = 177,5г
Слайд 14Практическое исследование
Задание №1.
Каждый день мы употребляем сахар,
например, когда пьем чай.
Но вы когда-нибудь задумывались:
1. сколько моль сахара содержится в кусочке рафинада?
2. какое количество сахарозы вы выпиваете с чаем?
Слайд 15
Карта исследования по теме:
«Количество вещества. Моль. Молярная масса».
Оборудование: Весы с
разновесами, мерный цилиндр, химический стакан, столовая ложка, фильтровальная бумага.
Вещества: Вода, сахар рафинад.
Порядок выполнения работы:
Вспомните правила взвешивания (см. Приложение 1).
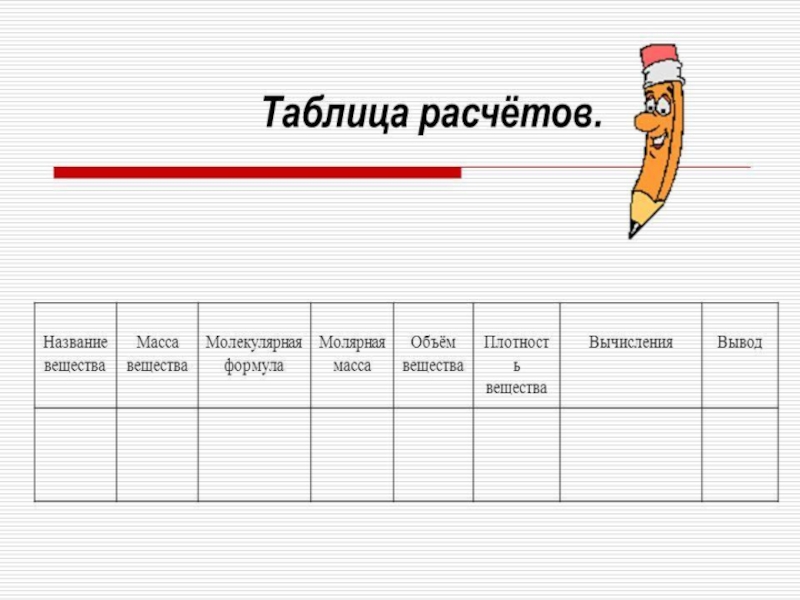
В таблице расчетов запишите молекулярную формулу сахара, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода, и одиннадцать атомов кислорода.
Подсчитайте её молекулярную массу и результат запишите в таблицу.
На весах взвесьте 1 кусочек рафинада, сделайте соответствующие расчёты в таблице и определите, какое количество сахарозы вы выпиваете с чаем.
Вещества: Вода, сахар рафинад.
Порядок выполнения работы:
Вспомните правила взвешивания (см. Приложение 1).
В таблице расчетов запишите молекулярную формулу сахара, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода, и одиннадцать атомов кислорода.
Подсчитайте её молекулярную массу и результат запишите в таблицу.
На весах взвесьте 1 кусочек рафинада, сделайте соответствующие расчёты в таблице и определите, какое количество сахарозы вы выпиваете с чаем.
Слайд 17Вывод:
Зная массу вещества и объём,
можно найти количество вещества, а по количеству вещества можно определить m, N, V, т.е. все эти величины взаимосвязаны.
д/з решить задачи из практикума
д/з решить задачи из практикума
Слайд 18Практикум по решению задач
I. Вычисление молярной массы
M = Mr∙1г/моль
Вычислите молярную массу
веществ:
1. М (О2) =
2. М (О3) =
3. М (Н2О2) =
4. М (Р2О5) =
5. М (Li2O) =
6. М (Н3РО4) =
II. Вычисление массы вещества по известному количеству вещества
m = M∙ y
Вычислите массу вещества, если его количество равно:
1. n(CaO) = 2 моль
2. n (SO2) = 4 моль
3. n(Na2S) = 0,2 моль
4. n(HNO3) = 0,5 моль
1. М (О2) =
2. М (О3) =
3. М (Н2О2) =
4. М (Р2О5) =
5. М (Li2O) =
6. М (Н3РО4) =
II. Вычисление массы вещества по известному количеству вещества
m = M∙ y
Вычислите массу вещества, если его количество равно:
1. n(CaO) = 2 моль
2. n (SO2) = 4 моль
3. n(Na2S) = 0,2 моль
4. n(HNO3) = 0,5 моль
Слайд 19III. Вычисление количества вещества по его массе
m
y=----
M
Найдите количество вещества, если его масса равна:
1. m (Fe2O3) = 80 грамм
2. m (FeS) = 22 граммa
3. m (H2SO4) = 196 граммa
4. m (O2) = 512 грамм
IV. Вычисление числа молекул в определённой массе вещества
N0 = y∙Na, Na = 6,02∙1023 моль-1 ; m
y=----
M
Сколько молекул содержится в веществе, если его масса равна:
1. m (NaOH) = 80 грамм
2. m (HNO3) = 32,5 грамм
3. m (H2SO4) = 147 грамм
4. m (O3) = 144 грамм
Найдите количество вещества, если его масса равна:
1. m (Fe2O3) = 80 грамм
2. m (FeS) = 22 граммa
3. m (H2SO4) = 196 граммa
4. m (O2) = 512 грамм
IV. Вычисление числа молекул в определённой массе вещества
N0 = y∙Na, Na = 6,02∙1023 моль-1 ; m
y=----
M
Сколько молекул содержится в веществе, если его масса равна:
1. m (NaOH) = 80 грамм
2. m (HNO3) = 32,5 грамм
3. m (H2SO4) = 147 грамм
4. m (O3) = 144 грамм