Калужской области
Учитель химии Корниенко Н.Н.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Презентации к урокам химии Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома 8 класс
Содержание
- 1. Презентации к урокам химии Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома 8 класс
- 2. Атом – это наименьшая частица вещества.2. Понятие
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
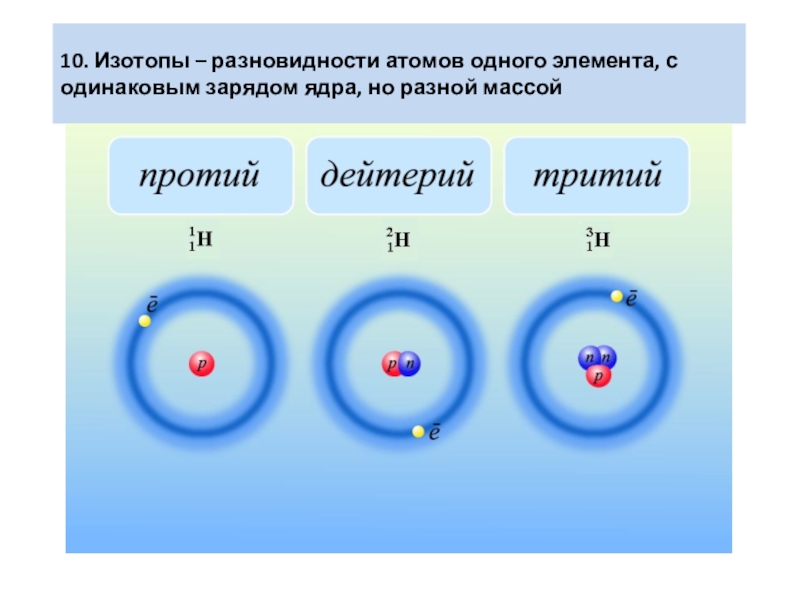
- 8. 10. Изотопы – разновидности атомов одного элемента, с одинаковым зарядом ядра, но разной массой
- 9. Слайд 9
- 10. Слайд 10
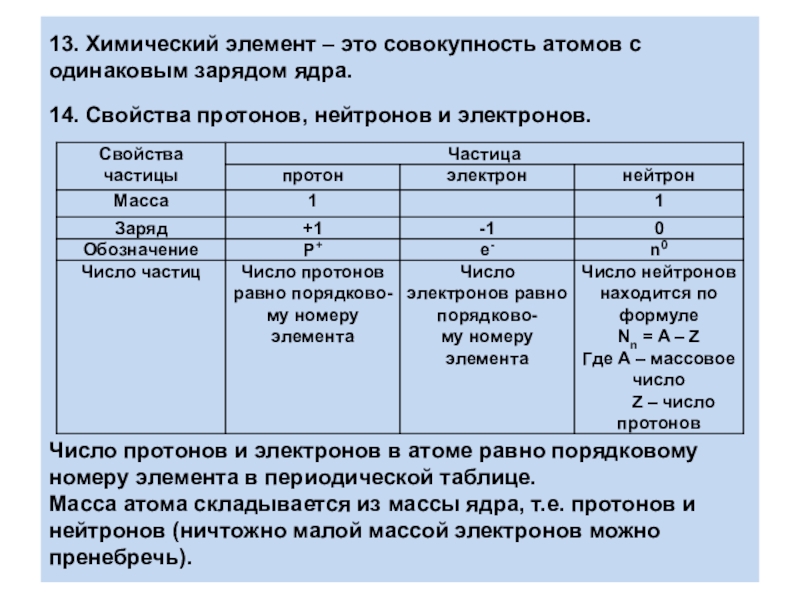
- 11. 13. Химический элемент – это совокупность атомов
- 12. Заполнить схему «Строение атома». Протоны. Обозначаются
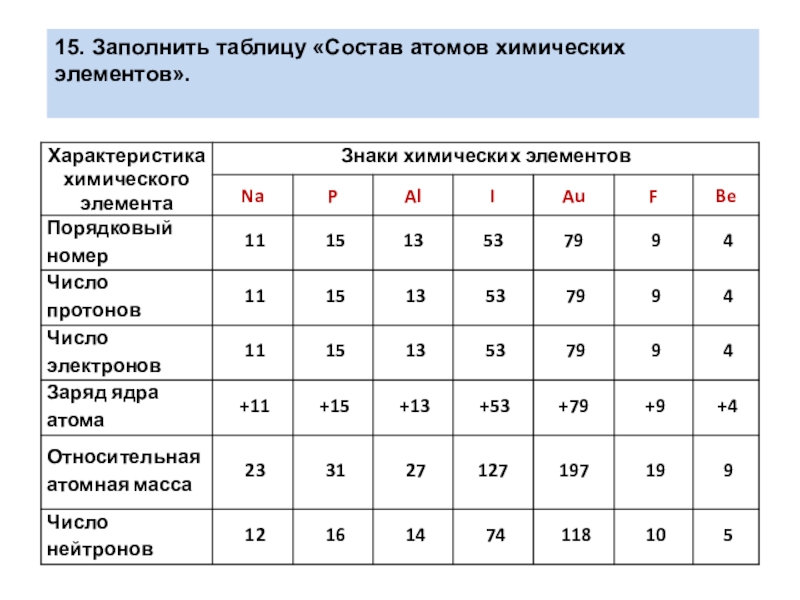
- 13. 15. Заполнить таблицу «Состав атомов химических элементов».
- 14. 15. Заполнить таблицу «Состав атомов химических элементов».
- 15. 16. Запишите названия, символы и «координаты» в
- 16. Восстановите схему строения атома:168Op+ = 8n0 = 8e- = 8
- 17. Восстановите схему строения атома:2311Nap+ = 11n0 = 12e- = 11
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
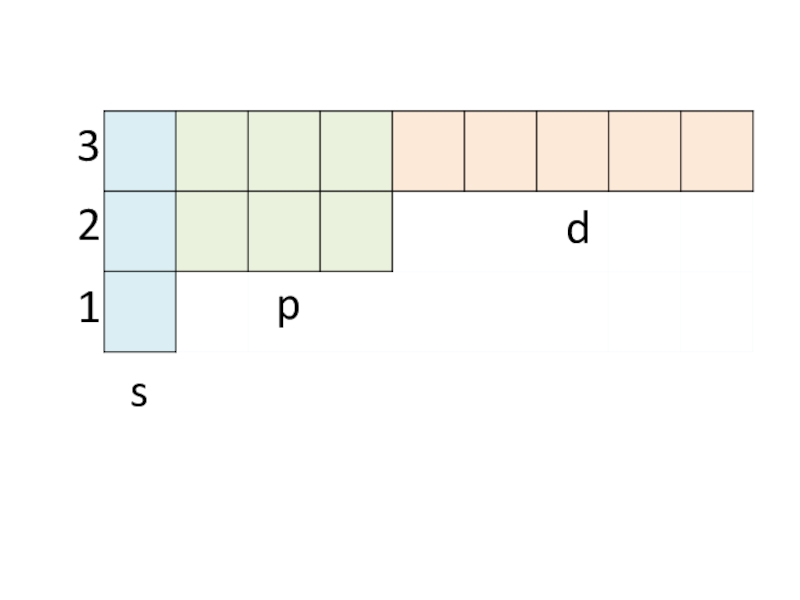
- 21. spd321
- 22. Слайд 22
- 23. Порядковый номер атома – …Физическая основа элемента
- 24. Слайд 24
- 25. Электроны в атоме располагаются на …Уровень –
- 26. Подуровень – это …Количество подуровней равно …На
- 27. При движении вокруг ядра электрон образует …Электронная
- 28. О каком химическом элементе идёт речь, если
- 29. Слайд 29
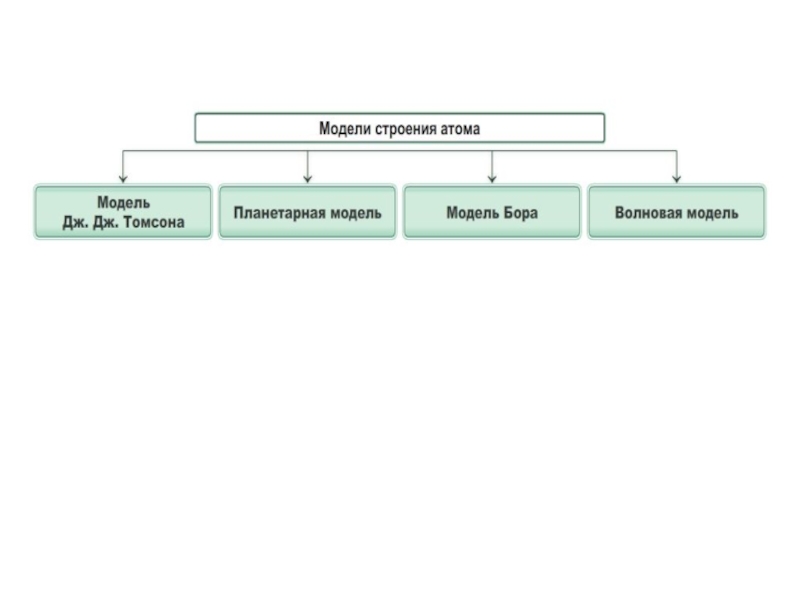
Атом – это наименьшая частица вещества.2. Понятие «атом» ввёл в науку древнегреческий философ Демокрит. «Атом» - означает «неделимый».3. Яблоко во столько же раз больше атома, во сколько Земля больше самого яблока.4. А.А. Беккерель открыл явление радиоактивности.
Слайд 2Атом – это наименьшая частица вещества.
2. Понятие «атом» ввёл в науку
древнегреческий философ Демокрит. «Атом» - означает «неделимый».
3. Яблоко во столько же раз больше атома, во сколько Земля больше самого яблока.
4. А.А. Беккерель открыл явление радиоактивности. Оно доказывало, что атом делим.
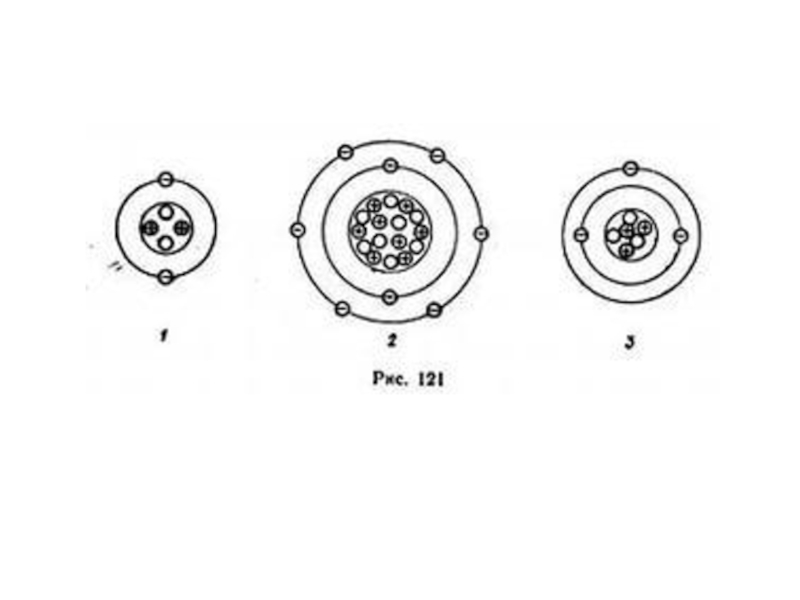
5. Атом состоит из ядра, включающего протоны и нейтроны, и движущихся вокруг электронов.
6. Существование ядра открыл Э. Резерфорд.
7. Электрон был открыт Д. Томпсоном. Название частице дал Д. Стони. Электрон в переводе с греческого – янтарь.
3. Яблоко во столько же раз больше атома, во сколько Земля больше самого яблока.
4. А.А. Беккерель открыл явление радиоактивности. Оно доказывало, что атом делим.
5. Атом состоит из ядра, включающего протоны и нейтроны, и движущихся вокруг электронов.
6. Существование ядра открыл Э. Резерфорд.
7. Электрон был открыт Д. Томпсоном. Название частице дал Д. Стони. Электрон в переводе с греческого – янтарь.
Слайд 810. Изотопы – разновидности атомов одного элемента, с одинаковым зарядом ядра,
но разной массой
Слайд 1113. Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
14.
Свойства протонов, нейтронов и электронов.
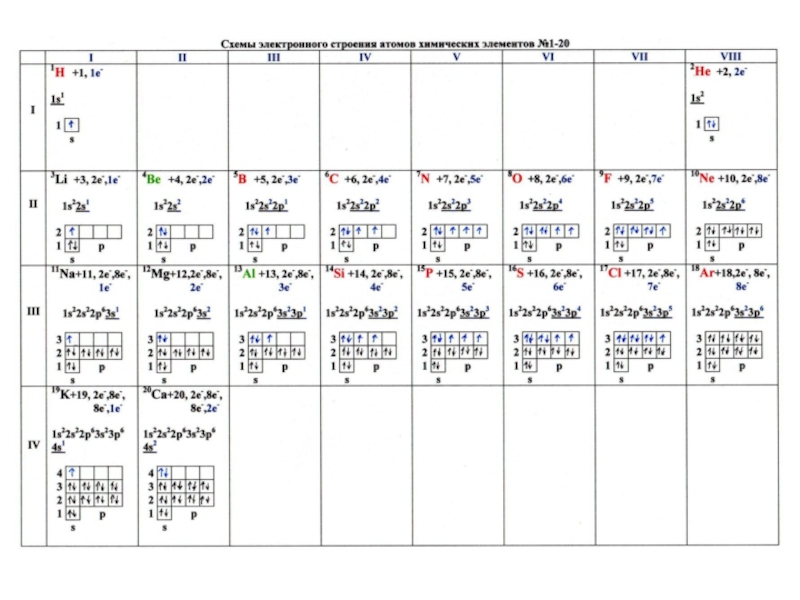
Число протонов и электронов в атоме равно порядковому номеру элемента в периодической таблице.
Масса атома складывается из массы ядра, т.е. протонов и нейтронов (ничтожно малой массой электронов можно пренебречь).
Число протонов и электронов в атоме равно порядковому номеру элемента в периодической таблице.
Масса атома складывается из массы ядра, т.е. протонов и нейтронов (ничтожно малой массой электронов можно пренебречь).
Слайд 12Заполнить схему «Строение атома».
Протоны. Обозначаются р+, имеют массу 1
и заряд +1
Число протонов равно порядковому номеру
Нейтроны. Обозначаются n0 , имеют массу 1 и заряд 0
Число нейтронов равно А – Z (Z – число протононов)
Электроны. Обозначаются е-, имеют массу 1/1840 от массы протона и заряд -1
Число электронов равно числу протонов
Число протонов равно порядковому номеру
Нейтроны. Обозначаются n0 , имеют массу 1 и заряд 0
Число нейтронов равно А – Z (Z – число протононов)
Электроны. Обозначаются е-, имеют массу 1/1840 от массы протона и заряд -1
Число электронов равно числу протонов
Слайд 1516. Запишите названия, символы и «координаты» в таблице Д.И. Менделеева химических элементов,
атомы которых состоят из:
А) 6 протонов, 6 нейтронов, 6 электронов: углерод, С, 2 период, 4 группа, А (главная) подгруппа.
Б) 12 протонов, 12 нейтронов, 12 электронов: магний, Mg, 3 период, 2 группа, А (главная) подгруппа.
В) 56 протонов, 81 нейтрон, 56 электронов: барий, Ba, 6 период, 2 группа, А (главная) подгруппа.
А) 6 протонов, 6 нейтронов, 6 электронов: углерод, С, 2 период, 4 группа, А (главная) подгруппа.
Б) 12 протонов, 12 нейтронов, 12 электронов: магний, Mg, 3 период, 2 группа, А (главная) подгруппа.
В) 56 протонов, 81 нейтрон, 56 электронов: барий, Ba, 6 период, 2 группа, А (главная) подгруппа.
Слайд 23Порядковый номер атома – …
Физическая основа элемента определяется …
Существуют изотопы серы
с массовыми числами 32, 33, 34 и 36. Чем различаются по составу их атомы?
Во что превратится атом химического элемента №11, если в него добавить или из него убрать один протон?
Во что превратится атом химического элемента №11, если в него добавить или из него убрать один протон?
Слайд 25Электроны в атоме располагаются на …
Уровень – это …
Количество уровней равно
…
Максимальное количество электронов на уровне определяется по формуле …
Определите элемент, атому которого соответствует схема строения : 2, 8, 5
Максимальное количество электронов на уровне определяется по формуле …
Определите элемент, атому которого соответствует схема строения : 2, 8, 5
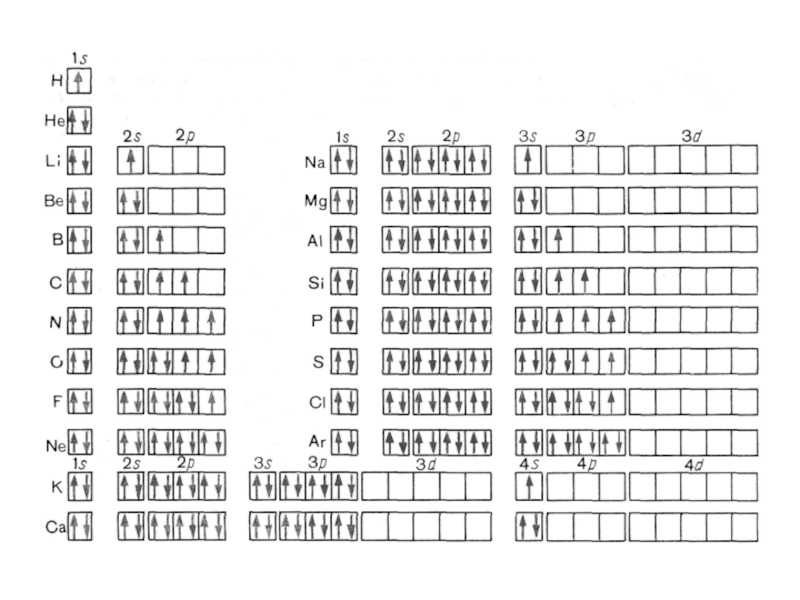
Слайд 26Подуровень – это …
Количество подуровней равно …
На первом уровне – s
На
втором – s, p
На третьем – s, p, d
На четвёртом – s, p, d, f
Максимальное количество s-электронов – 2
р-электронов – 6
d-электронов – 10
F-электронов - 14
На третьем – s, p, d
На четвёртом – s, p, d, f
Максимальное количество s-электронов – 2
р-электронов – 6
d-электронов – 10
F-электронов - 14
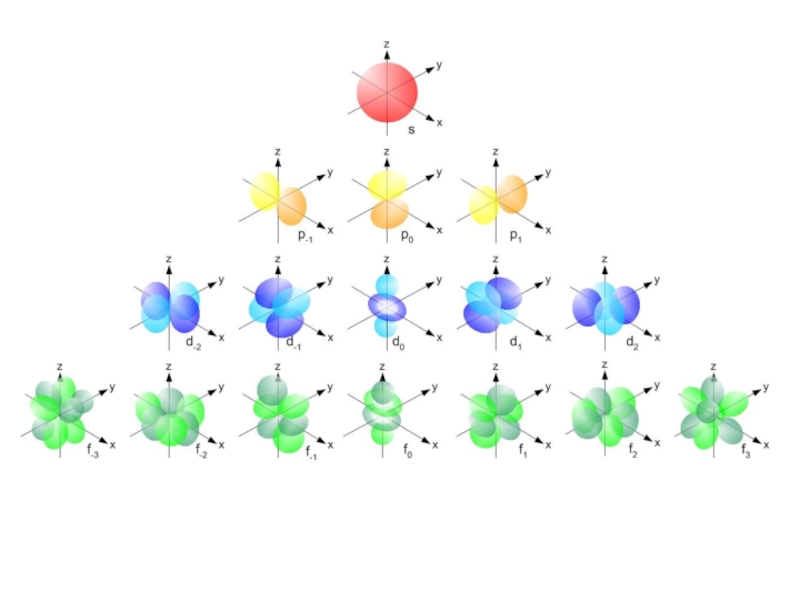
Слайд 27При движении вокруг ядра электрон образует …
Электронная орбиталь – это …
Различают
… орбитали.
На орбитали любой формы не может располагаться более …
Почему?
На орбитали любой формы не может располагаться более …
Почему?
Слайд 28О каком химическом элементе идёт речь, если известно, что он стоит
а V группе, главной (А) подгруппе, во втором периоде? Какое простое вещество он образует, где оно встречается?
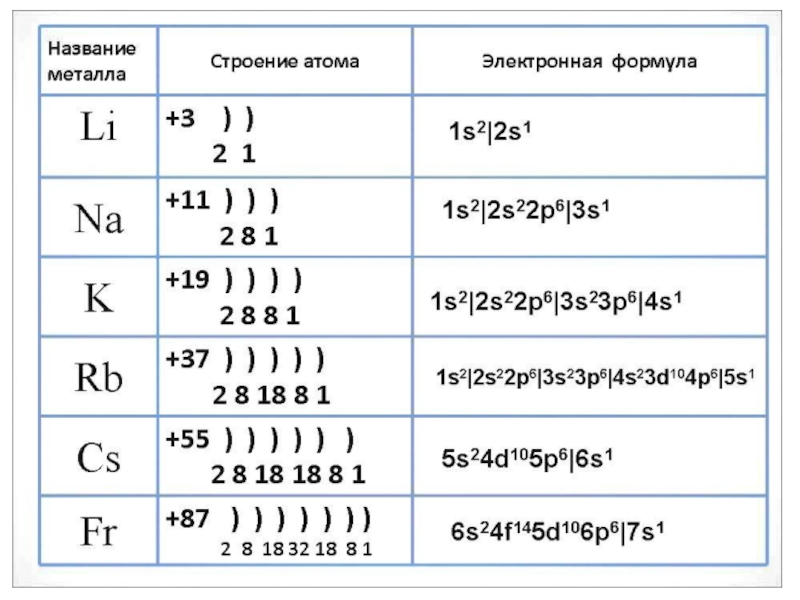
О каком химическом элементе идёт речь, если известно, что в электронной оболочке его атома четыре слоя, а на внешнем электронном слое находится один электрон? Какое значение для жизни человека имеет этот элемент?
О каком химическом элементе идёт речь, если известно, что в электронной оболочке его атома четыре слоя, а на внешнем электронном слое находится один электрон? Какое значение для жизни человека имеет этот элемент?