- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
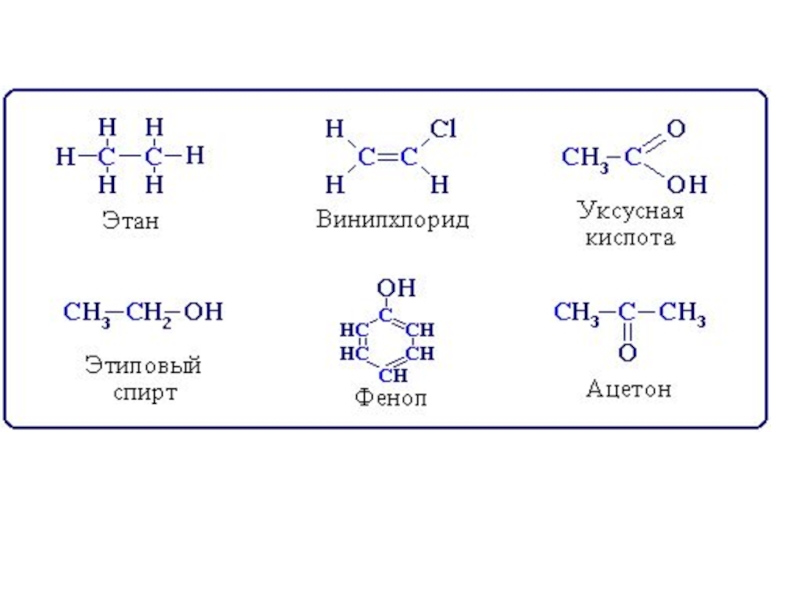
Презентация, доклад на тему Презенация Углеводороды. Химия. 10 класс
Содержание
- 1. Презенация Углеводороды. Химия. 10 класс
- 2. Органические соединения классифицируют на углеводороды и соединения, содержащие функциональные группы
- 3. Слайд 3
- 4. Углеводороды – органические соединения, образованные атомами углерода и водорода
- 5. Слайд 5
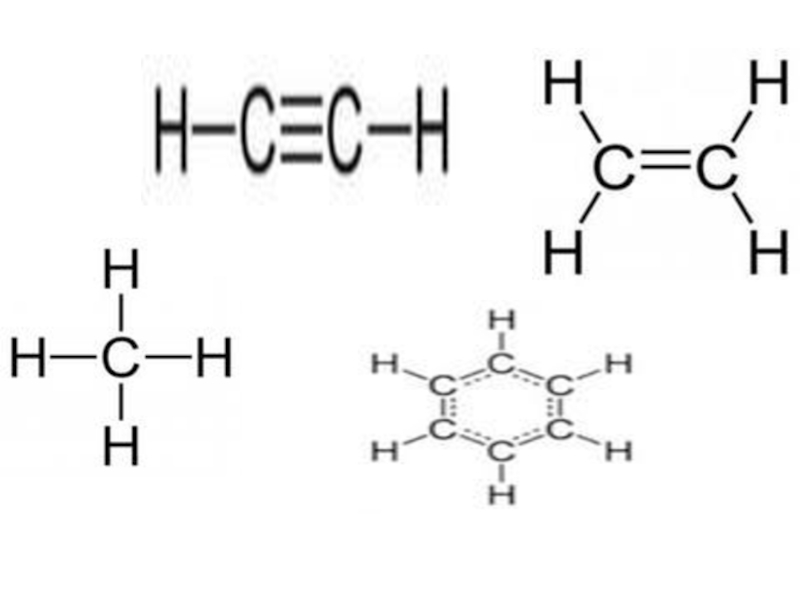
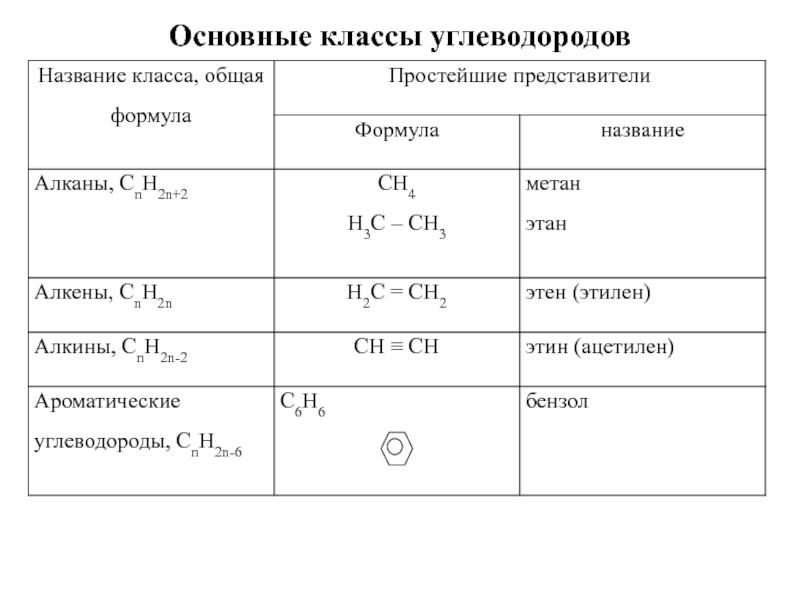
- 6. Основные классы углеводородов
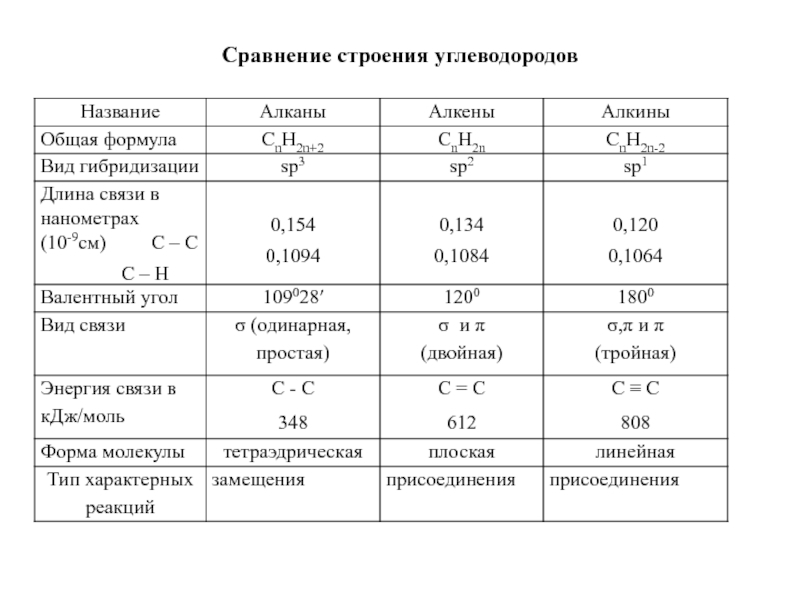
- 7. Предельные углеводороды - парафины - алканыCn H2n+2
- 8. Слайд 8
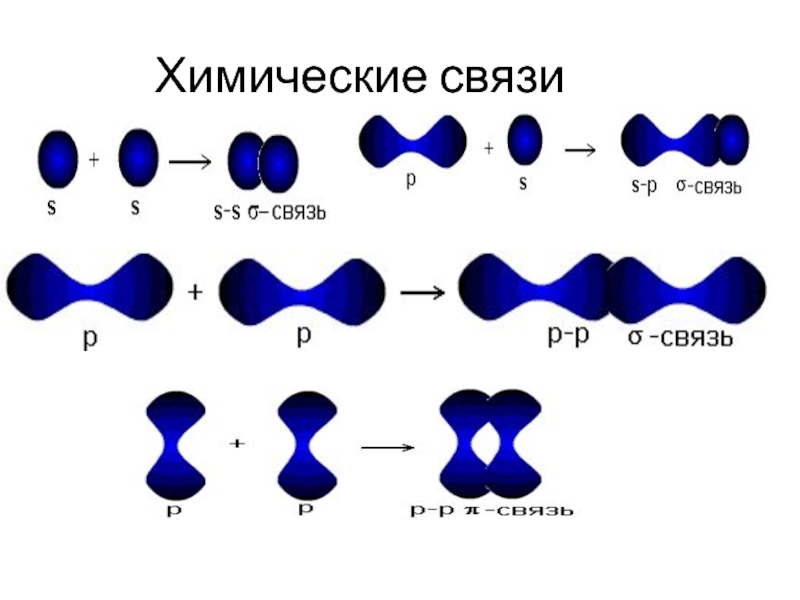
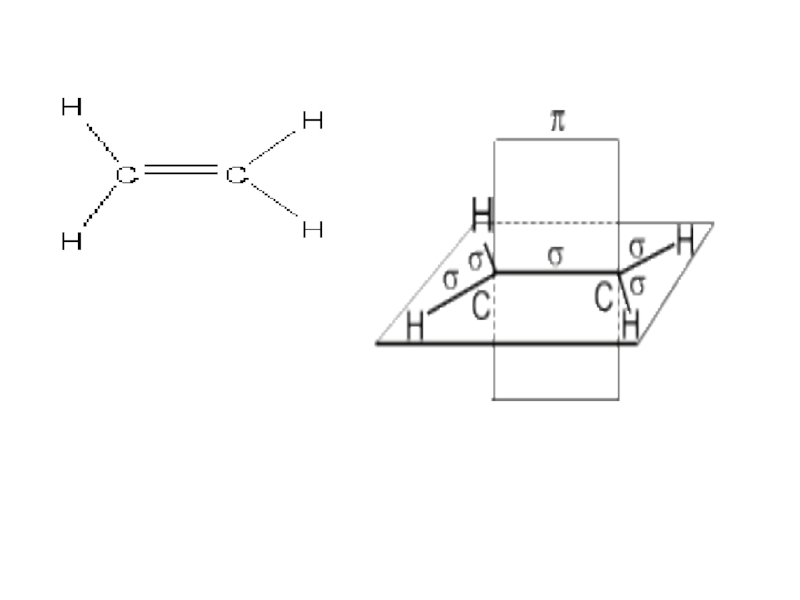
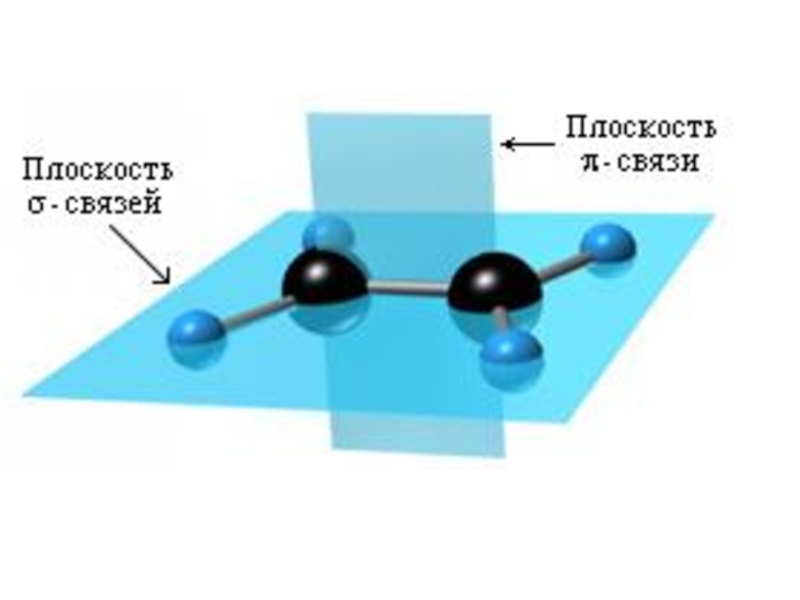
- 9. Химические связи
- 10. сигма-связь образуется, когда перекрывание электронных облаков
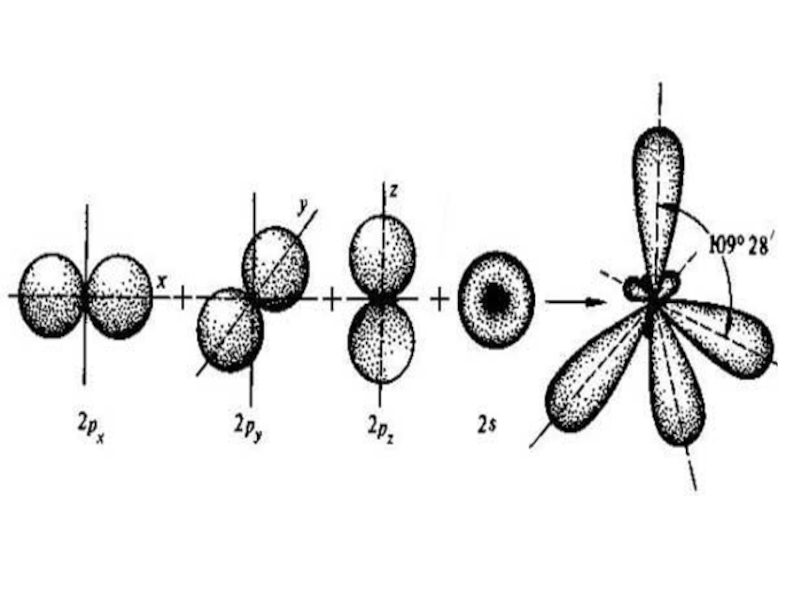
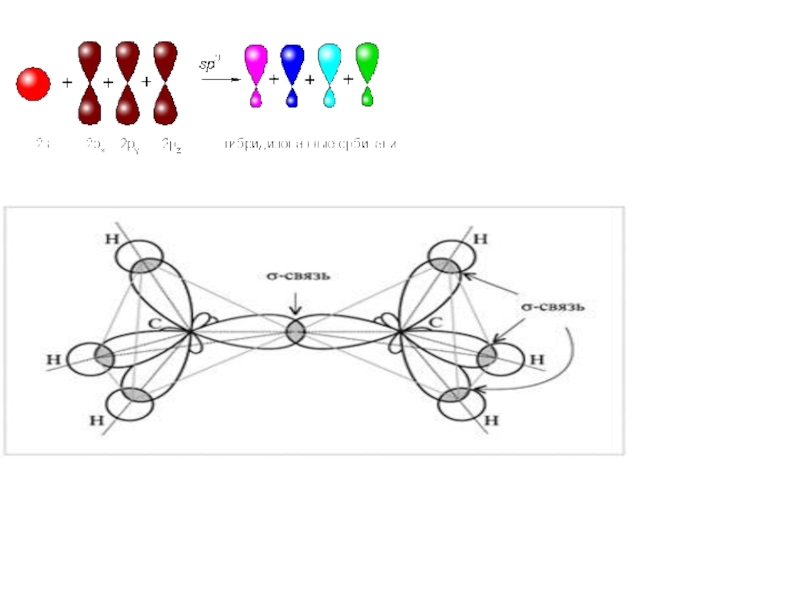
- 11. Гибридизация АО – это
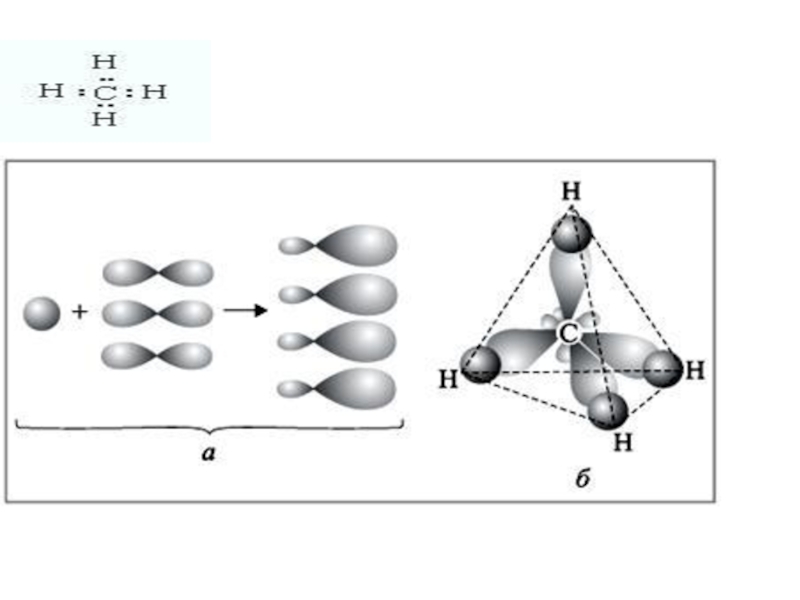
- 12. Атом углерода в
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
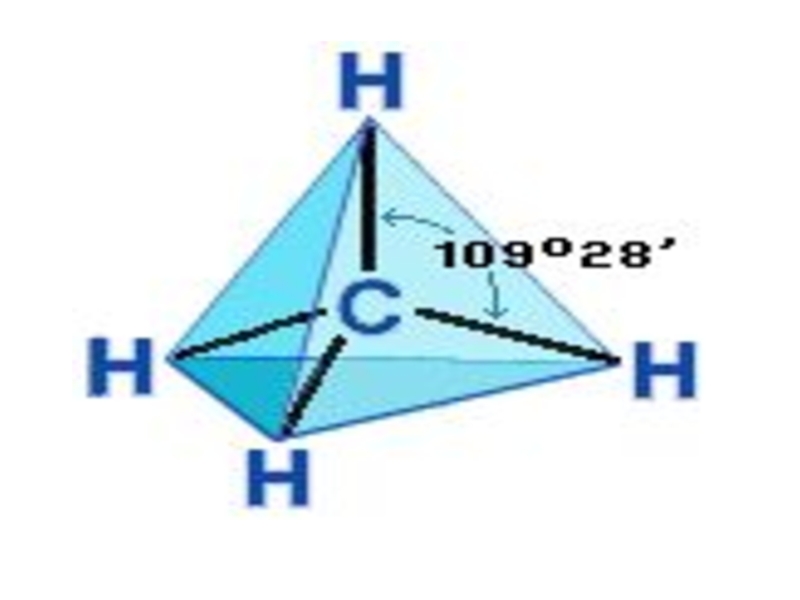
- 16. Оси sp³ - гибридных орбиталей направлены к
- 17. Слайд 17
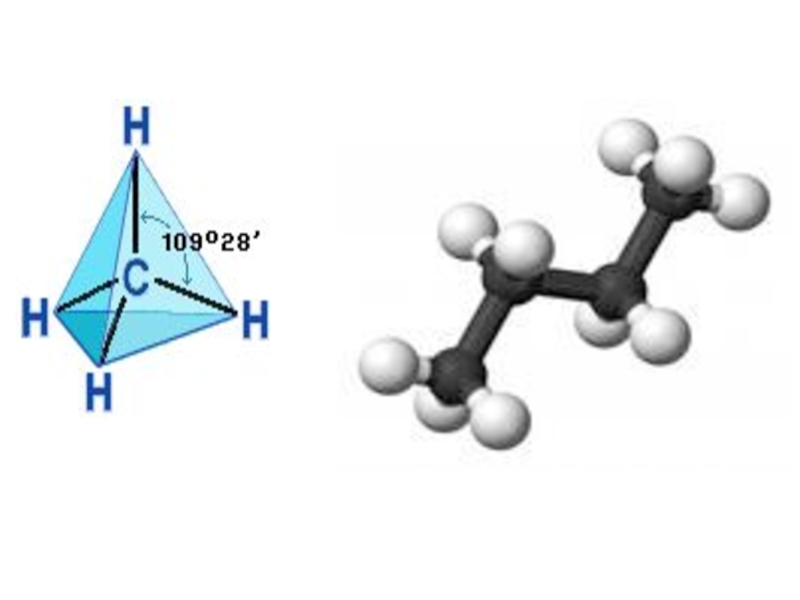
- 18. Сравнение строения углеводородов
- 19. Гомологический ряд –
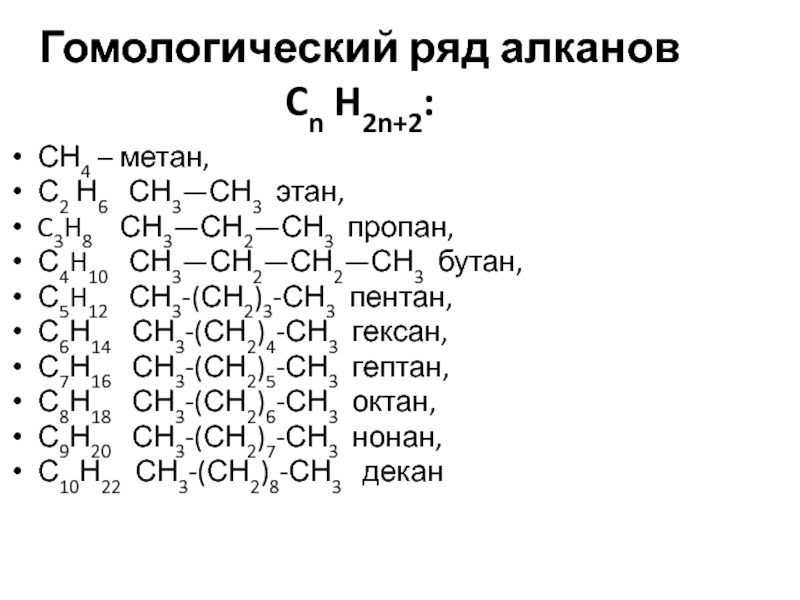
- 20. Гомологический ряд алканов Cn
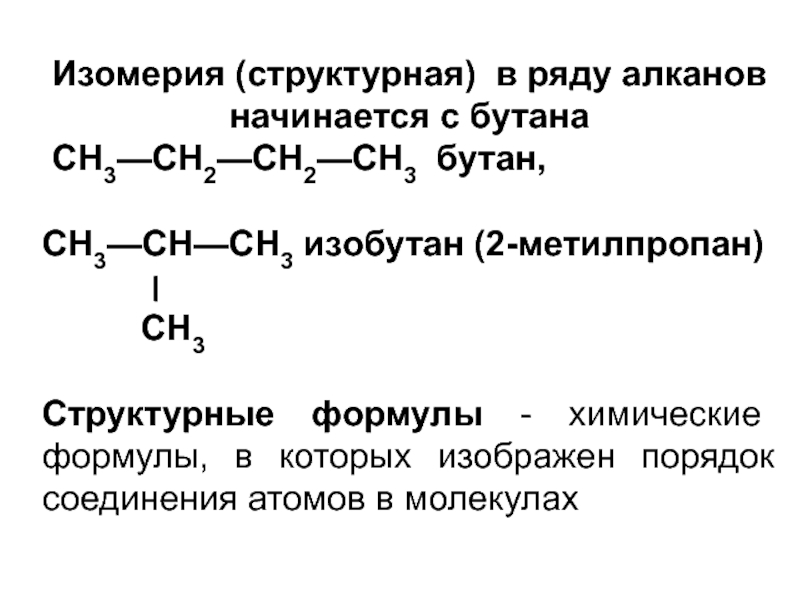
- 21. Изомерия (структурная) в ряду алканов начинается с
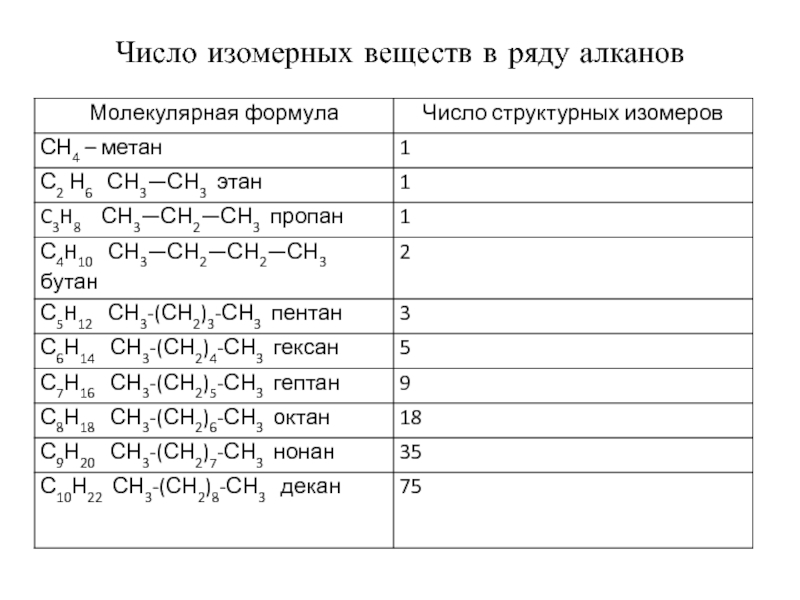
- 22. Число изомерных веществ в ряду алканов
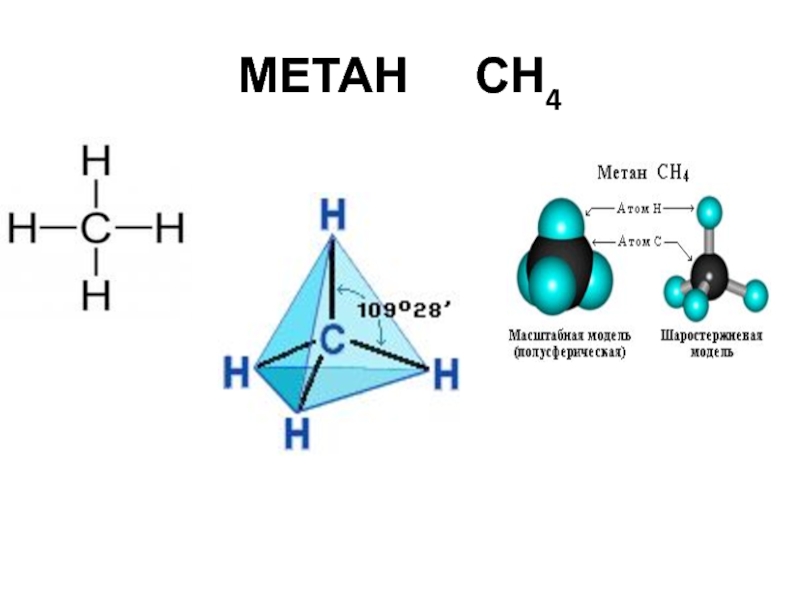
- 23. МЕТАН СН4
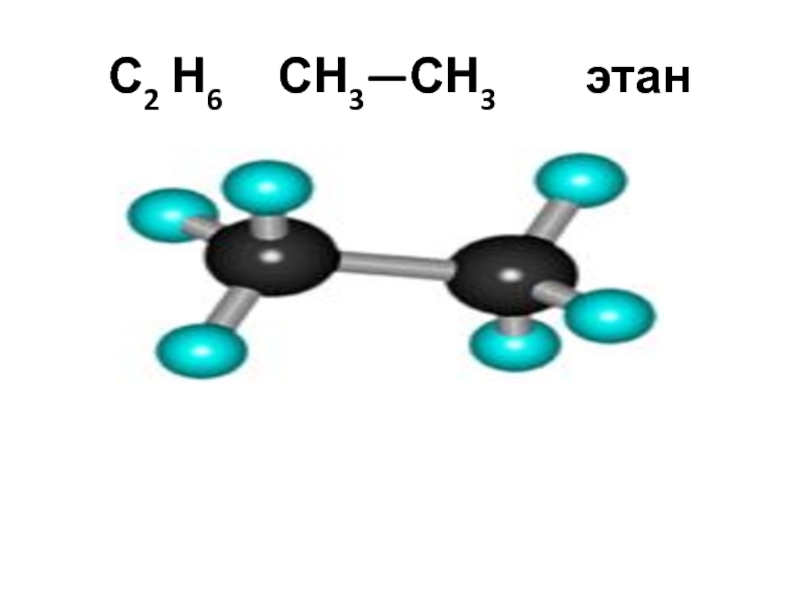
- 24. С2 Н6 СН3—СН3 этан
- 25. C3H8 СН3—СН2—СН3 пропан
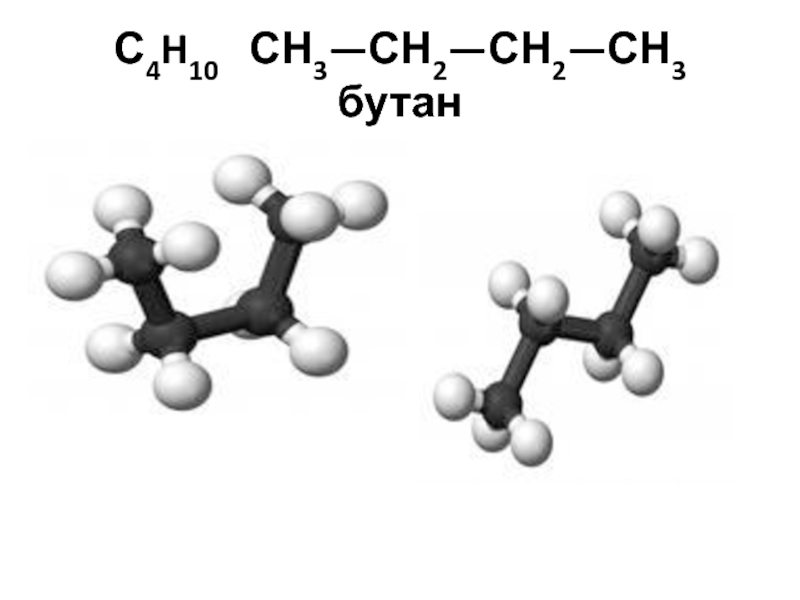
- 26. С4H10 СН3—СН2—СН2—СН3 бутан
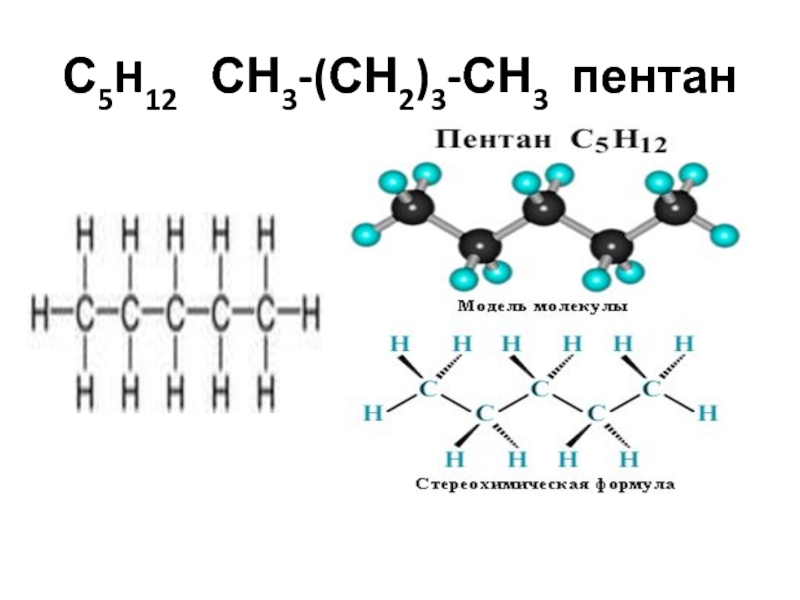
- 27. С5H12 СН3-(СН2)3-СН3 пентан
- 28. Физические свойстваС1-С4 – газы, С5-С16 – жидкости,
- 29. Метан СН4 –
- 30. Слайд 30
- 31. СН4 – газ без
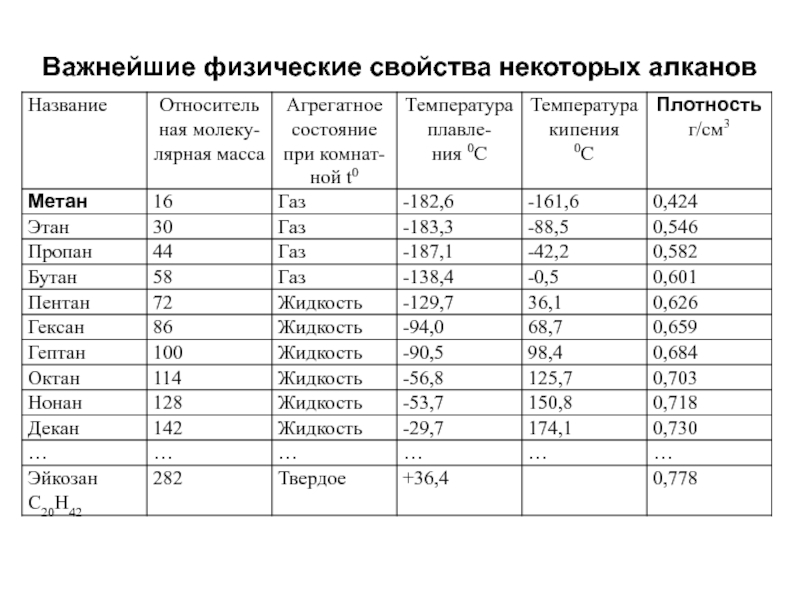
- 32. Важнейшие физические свойства некоторых алканов
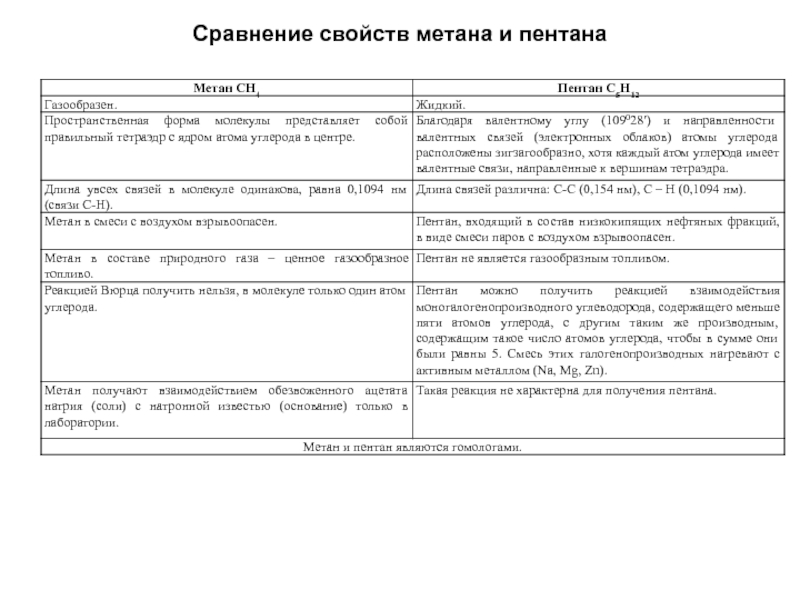
- 33. Сравнение свойств метана и пентана
- 34. Химические свойства алканов(характерны реакции замещения)
- 35. Реакции замещения (разрыв связи С—Н)Галогенирование (замещение атома
- 36. II. Реакции окисления1. Горение:CH4+2O2?CO2+2H2O (голубое пламя)2. Каталитическое
- 37. III. Разрыв связи С—С, крекинг:Каталитический – в
- 38. Получение алкановCH3COONa + NaOH? Na2CO3 +
- 39. Получение метана в лаборатории:Нагреванием обезвоженного ацетата натрия
- 40. Промышленные синтезы на основе метанаМетан – промышленный
- 41. Применение алканов Используются в качестве
- 42. Непредельные углеводороды. Алкены (этиленовые углеводороды) CnH2n
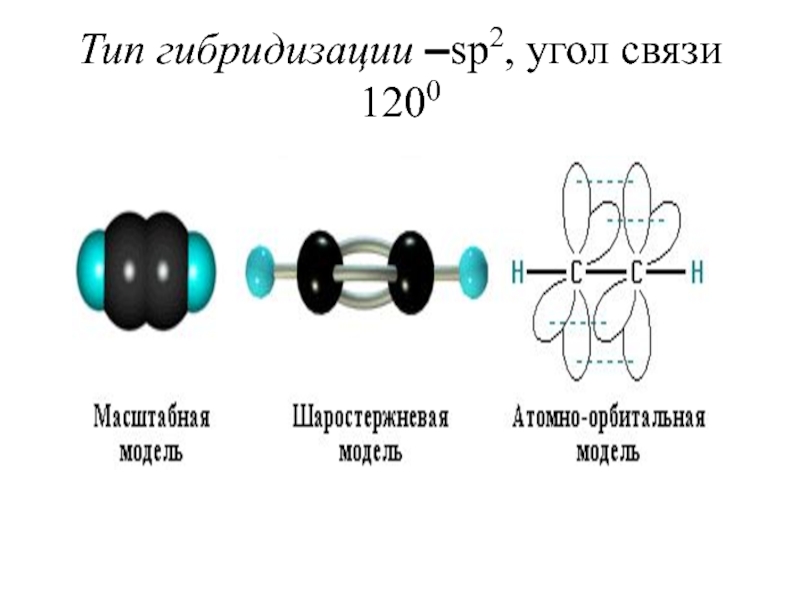
- 43. Тип гибридизации –sp2, угол связи 1200
- 44. Sp2 - гибридизация происходит при смешивании
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Слайд 48
- 49. Номенклатура АЛКЕНОВ Названия алкенов соответствуют алканам
- 50. Изомерия АЛКЕНОВПо положению двойной связи (начинается с
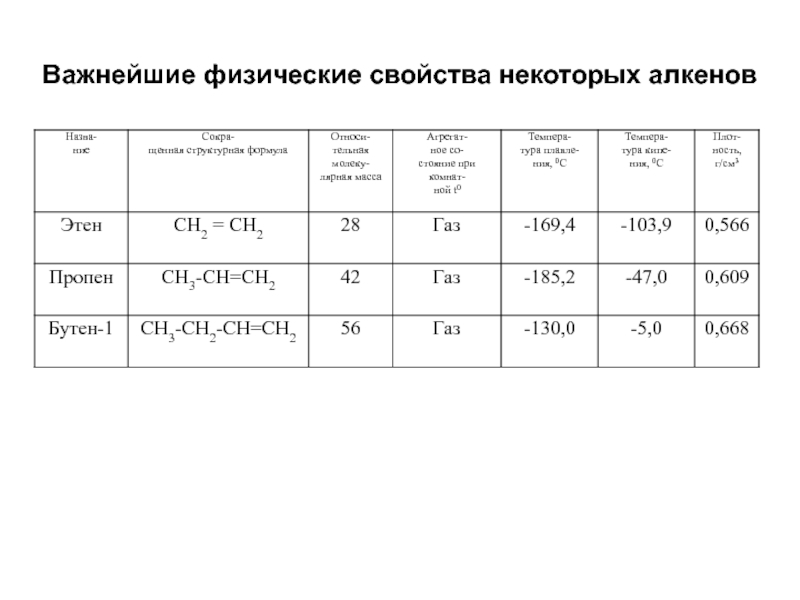
- 51. Важнейшие физические свойства некоторых алкенов
- 52. Этилен – бесцветный газ, почти без запаха,
- 53. Химические свойства АЛКЕНОВ Химические свойства алкенов
- 54. I. Реакции присоединенияПрисоединение воды (гидратация)—в присутствии серной
- 55. Присоединение водорода (гидрирование): СН2=СН2 + Н2 ?
- 56. II. Реакции окисленияГорение (с воздухом этилен и
- 57. III. Реакции полимеризацииПри повышенной температуре, давлении и
- 58. Получение АЛКЕНОВДегидрирование алканов (отщепление водорода) (t,
- 59. Сравнение свойств этилена и этана
- 60. Применение АЛКЕНОВДля производства пластмассДля синтеза этанола (этилового спирта)Этилен используется для ускорения созревания плодов
- 61. Синтезы на основе этилена:Этилен ?синтетический каучук;Этилен ?дихлорэтан?винилхлорид
- 62. Алкины – непредельные
- 63. Слайд 63
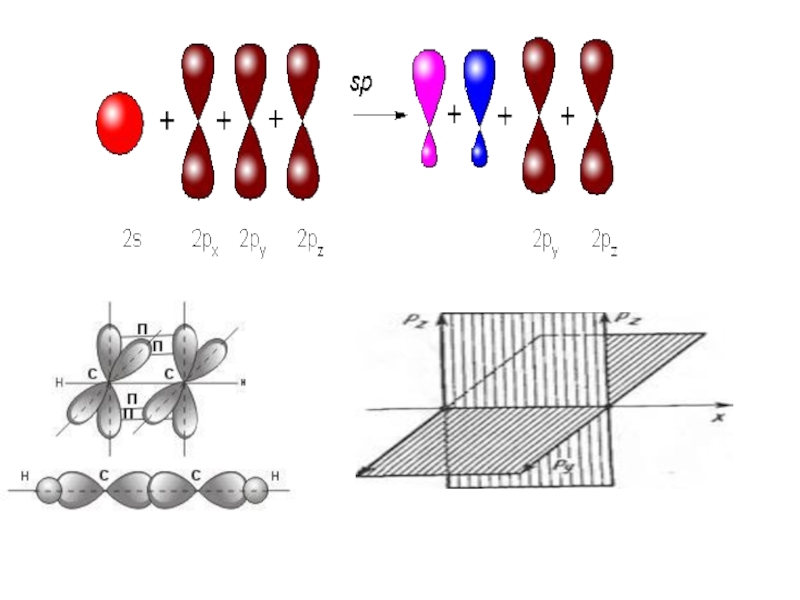
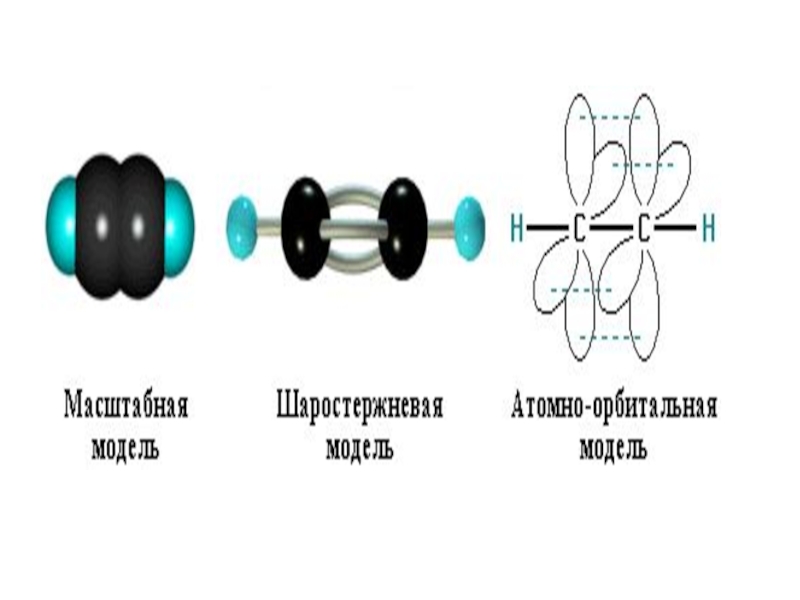
- 64. sp-гибридизация В случае sp-гибридизации образуются два гибридных
- 65. Слайд 65
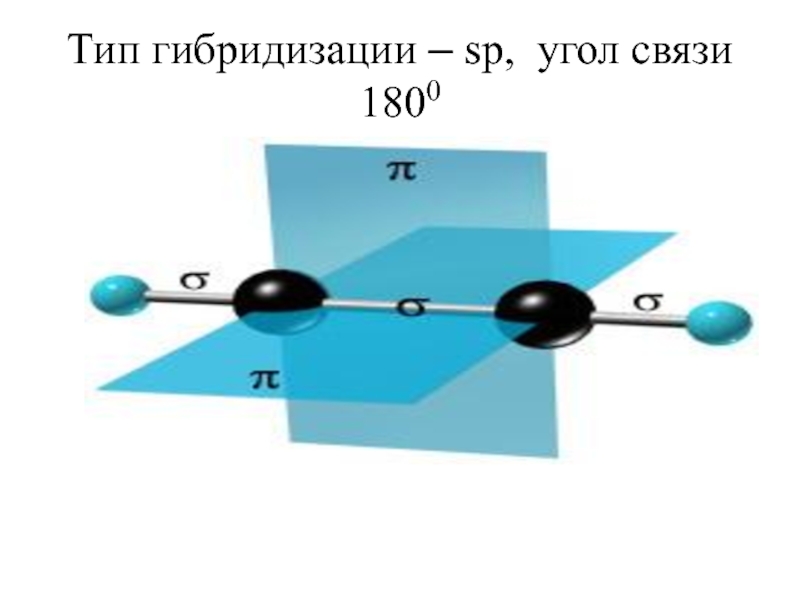
- 66. Тип гибридизации – sp, угол связи 1800
- 67. Слайд 67
- 68. Номенклатура АЛКИНОВ Названия образуют от названия соответствующего алкана путем замены суффикса –ан на -ин
- 69. Гомологи ацетилена:С2Н2
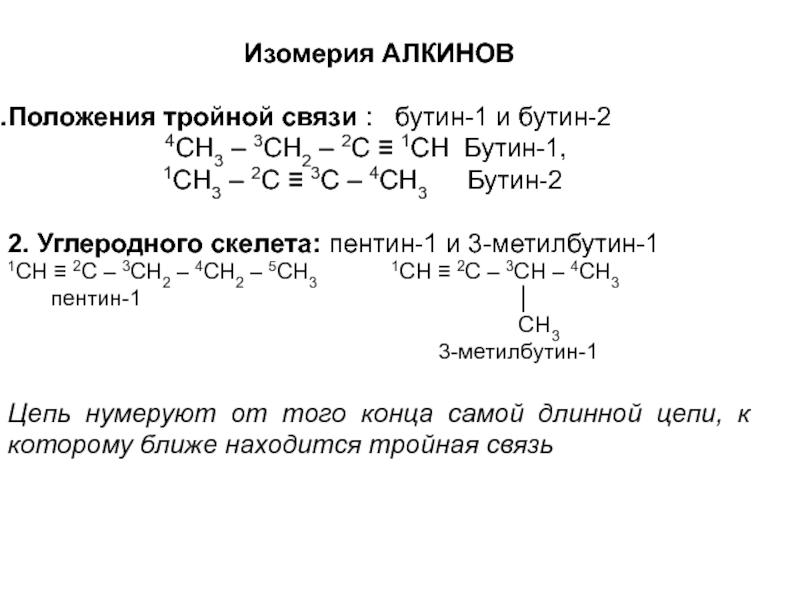
- 70. Изомерия АЛКИНОВПоложения тройной связи : бутин-1
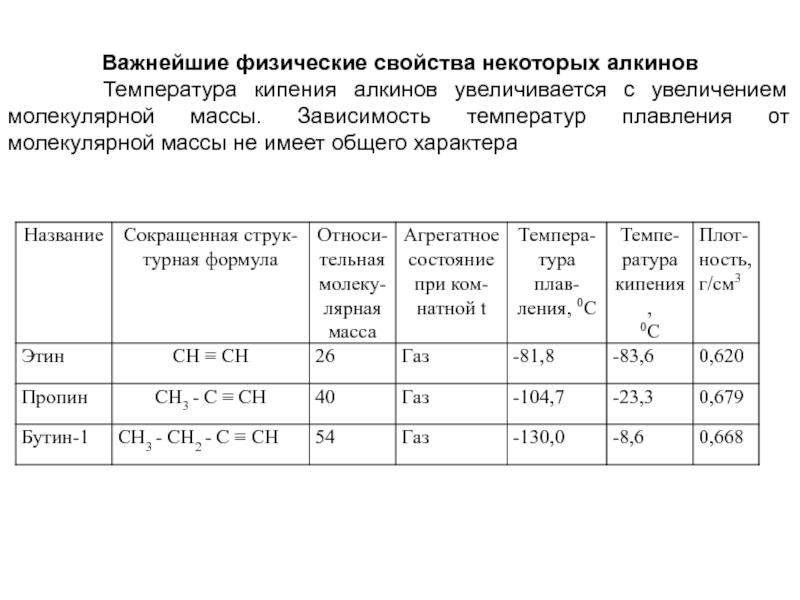
- 71. Важнейшие физические свойства некоторых алкинов
- 72. Ацетилен – газ легче
- 73. Химические свойства АЛКИНОВРеакции присоединения могут протекать в
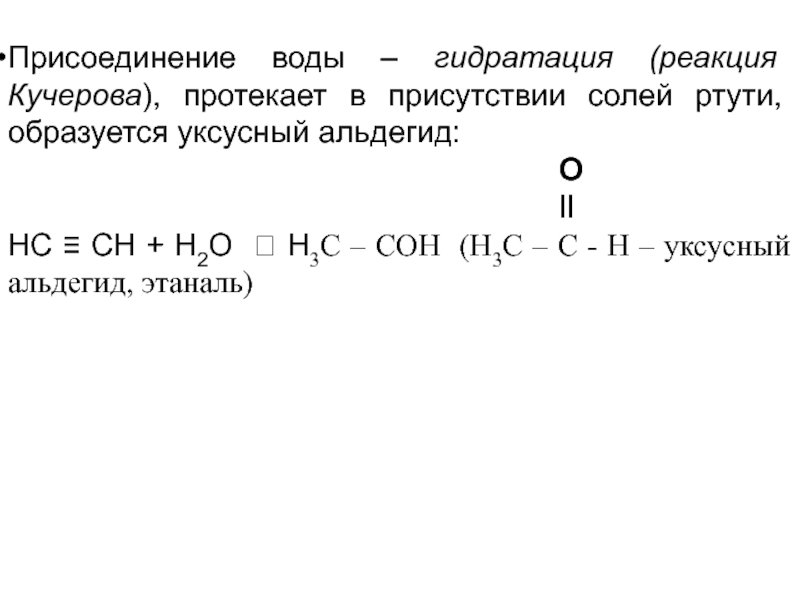
- 74. Присоединение воды – гидратация (реакция Кучерова), протекает
- 75. Присоединение хлороводорода: СН ≡ СН + НCI
- 76. II. Реакции окисленияГорение. На воздухе ацетилен горит
- 77. III. Реакции полимеризацииТримеризацией ацетилена получают бензол (пропускают
- 78. Получение АЦЕТИЛЕНАИз карбида кальция: СаС2 + Н2О
- 79. Применение АЛКИНОВПолучение уксусного альдегида и уксусной кислотыСинтез
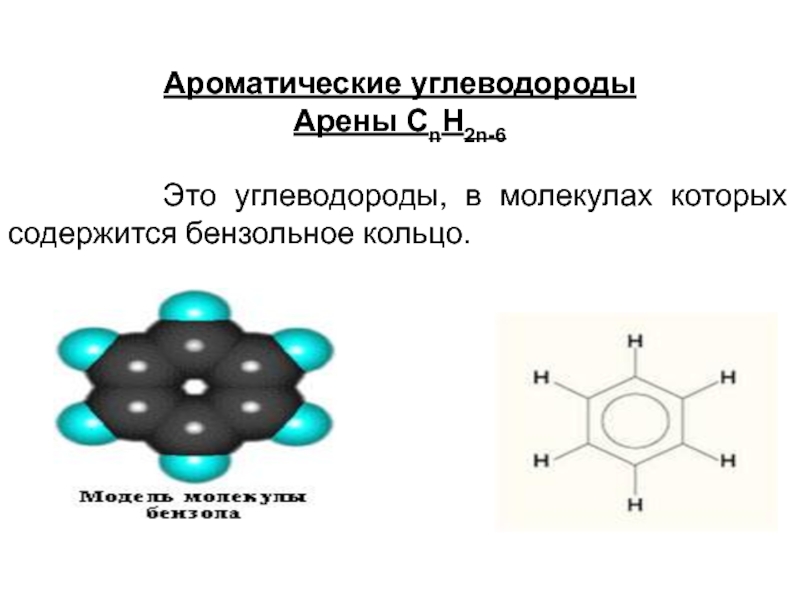
- 80. Ароматические углеводороды Арены СnH2n-6
- 81. В 1865 году немецкий химик Фидрих Август
- 82. Слайд 82
- 83. Слайд 83
- 84. Слайд 84
- 85. Слайд 85
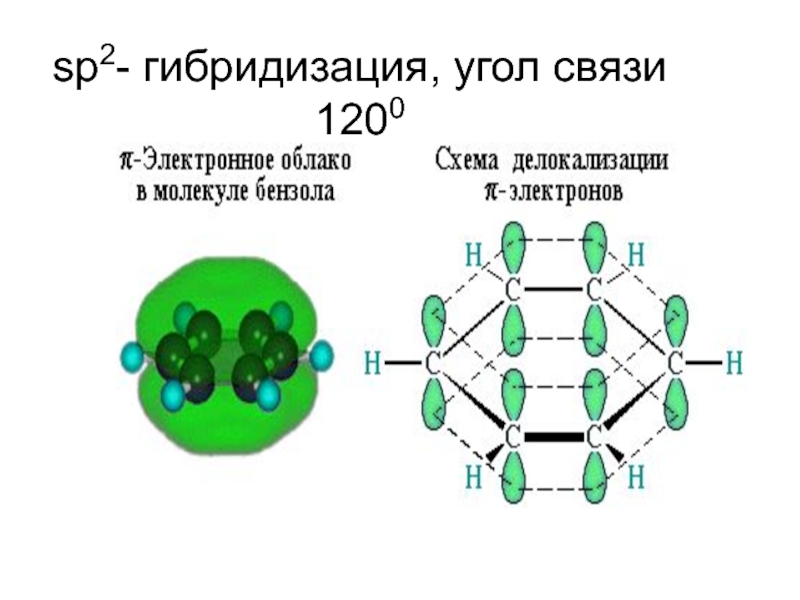
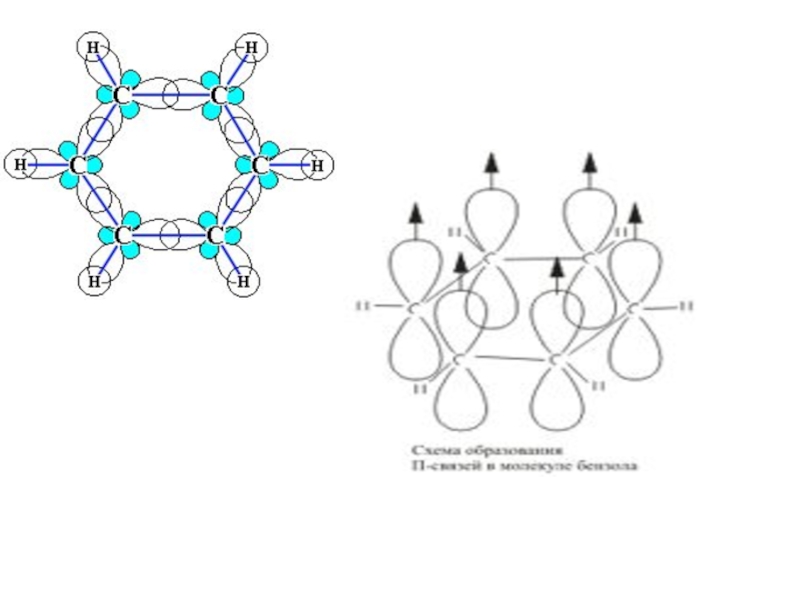
- 86. Молекула бензола плоская,
- 87. sp2- гибридизация, угол связи 1200
- 88. Слайд 88
- 89. Слайд 89
- 90. Физические свойства бензола Бензол
- 91. Химические свойстваI. Реакции замещения наиболее характерны (сходство
- 92. II. Реакции присоединения (сходство с непредельными
- 93. Получение БЕНЗОЛАТримеризацией ацетилена (реакция Зелинского-Казанского: 450-5000С, активированный
- 94. Применение Синтез красителей, медикаментов,
- 95. Химический тренажер1. Что такое изомеры? С какого
Слайд 2 Органические соединения классифицируют на углеводороды и соединения, содержащие
Слайд 7Предельные углеводороды - парафины - алканы
Cn H2n+2
Алканы –
Слайд 10 сигма-связь образуется, когда перекрывание электронных облаков происходит по линии, соединяющей
пи-связь образуется, когда перекрыва-ние электронных облаков происходит по обе стороны от линии, соединяющей центры атомов (вне плоскости нахождения ядер атомов), связь менее прочная, легко разрывается
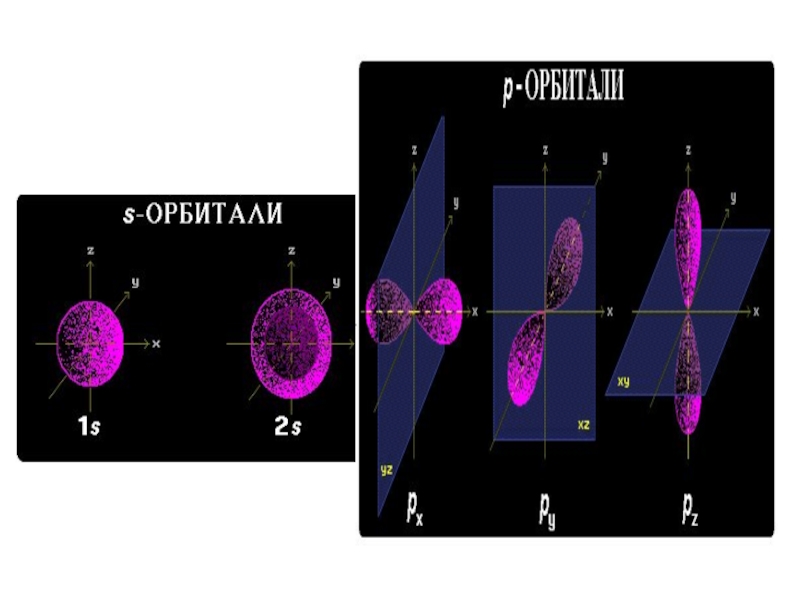
Слайд 11 Гибридизация АО – это взаимодействие (смешение) разных по
Слайд 12 Атом углерода в возбужденном состоянии обладает четырьмя
Слайд 16Оси sp³ - гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический
Слайд 19 Гомологический ряд – это ряд, составленный по
Слайд 20Гомологический ряд алканов
Cn H2n+2:
СН4 – метан,
С2 Н6
C3H8 СН3—СН2—СН3 пропан,
С4H10 СН3—СН2—СН2—СН3 бутан,
С5H12 СН3-(СН2)3-СН3 пентан,
С6Н14 СН3-(СН2)4-СН3 гексан,
С7Н16 СН3-(СН2)5-СН3 гептан,
С8Н18 СН3-(СН2)6-СН3 октан,
С9Н20 СН3-(СН2)7-СН3 нонан,
С10Н22 СН3-(СН2)8-СН3 декан
Слайд 21Изомерия (структурная) в ряду алканов начинается с бутана
СН3—СН2—СН2—СН3 бутан,
СН3—СН—СН3 изобутан (2-метилпропан)
׀
СН3
Структурные формулы - химические формулы, в которых изображен порядок соединения атомов в молекулах
Слайд 28Физические свойства
С1-С4 – газы, С5-С16 – жидкости, ›С16 – твердые вещества,
Слайд 29 Метан СН4 – первый представитель гомологического ряда
Слайд 35Реакции замещения (разрыв связи С—Н)
Галогенирование (замещение атома водорода атомом хлора или
СН4+CI2?СН3CI+НCI, СН3CI – хлористый метил или хлорметан;
СН3CI+CI2?CH2CI2+HCI, СН2CI2—дихлорметан,
CH2CI2+CI2?CHCI3+HCI, СHCI3—трихлорметан;
CHCI3+CI2?CCI4+HCI, CCI4—тетрахлорметан
Слайд 36II. Реакции окисления
1. Горение:
CH4+2O2?CO2+2H2O (голубое пламя)
2. Каталитическое окисление метана кислородом воздуха.
СН4 + [О] ? CH3OH - метиловый спирт,
CH4 + [О] ? HCOH – формальдегид
Слайд 37III. Разрыв связи С—С, крекинг:
Каталитический – в присутствии катализатора, при высоких
Термический—при высоких температурах (450-700º) и давлении. Молекула с большим числом атомов углерода расщепляется на молекулы с меньшим числом атомов: С4Н10? C2H6+C2H4 , СН4? С+2Н2
Дегидрирование: 2CH4 ? C2H2 + 3H2 (t0 = 15000C),
2CH4 ? CH2=CH2 + 2H2 (t0 , кат-р)
Слайд 38Получение алканов
CH3COONa + NaOH? Na2CO3 + CH4 (200°С),
С + 2Н2
СО + 3Н2? СН4 + Н2О (кат-р Ni, t).
Реакция Вюрца[1]:
С2Н5Br + 2Na + BrС2Н5 ? C2H5—C2H5 + 2NaBr
[1] Реакция, открытая в 1870 году французским ученым Вюрцем, используется для получения предельных углеводородов с большим числом атомов углерода из более низших углеводородов через образование моногалогенопроизводных, реагирующих с металлическим натрием. Натрий отрывает атомы галогенов, образуя галогенид. Освободившиеся радикалы соединяются в молекулы
Слайд 39Получение метана в лаборатории:
Нагреванием обезвоженного ацетата натрия с натронной известью (смесь
CH3 – COONa + NaO – H ? CH4↑ + Na2CO3
Взаимодействием карбида алюминия с соляной кислотой или водой при незначительном нагревании:
AI4C3 + 12HCI ? 4AICI3 + 3CH4↑
AI4C3 + 12HOH ? 4AI(OH)3↓ + 3CH4↑
Слайд 40Промышленные синтезы на основе метана
Метан – промышленный и бытовой газ, используется
Метан ?синтез-газ;
Метан ? водород ?мочевина;
Метан ?формальдегид ?фенолформальдегидная смола;
Метан ?метанол?лавсан;
Метан ?формальдегид ?муравьиная кислота;
Метан ?ацетилен ?этилен ?полиэтилен;
Метан ?ацетилен ?хлорэтен ?поливинилхлорид;
Метан ?ацетилен ?бензол ?производные бензола;
Метан ?хлорпроизводные растворители
Слайд 41Применение алканов
Используются в качестве топлива
В органическом синтезе
Путем дегидрирования получают непредельные углеводороды, водород и сажу
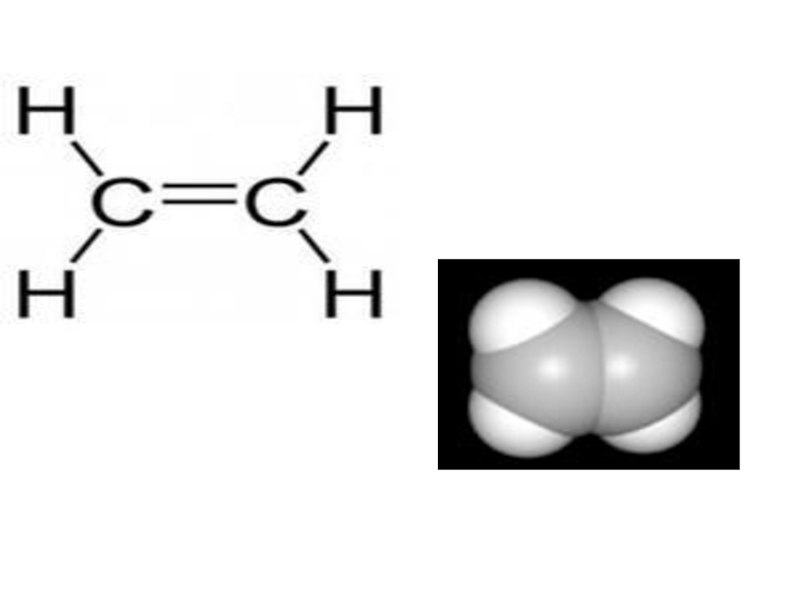
Слайд 42Непредельные углеводороды.
Алкены (этиленовые углеводороды)
CnH2n
Алкены –
Слайд 44Sp2 - гибридизация происходит при смешивании одной s- и двух
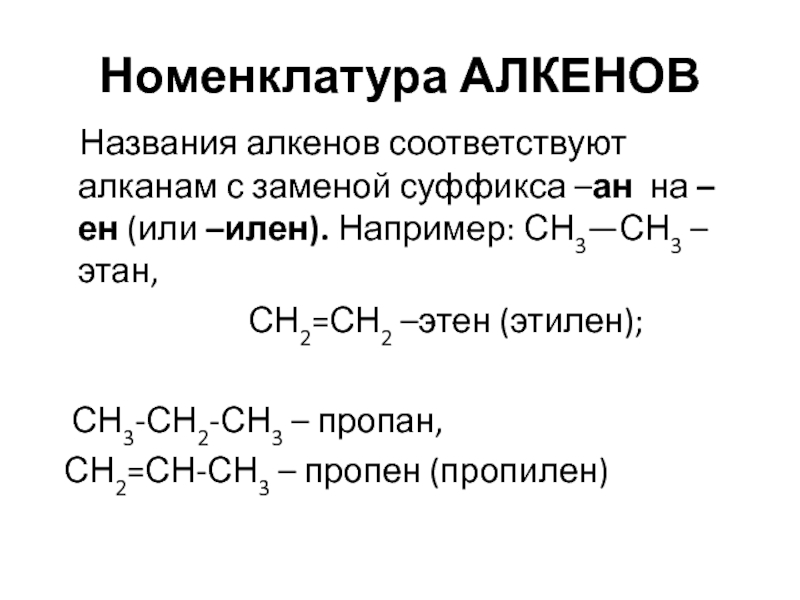
Слайд 49Номенклатура АЛКЕНОВ
Названия алкенов соответствуют алканам с заменой суффикса –ан
СН2=СН2 –этен (этилен);
СН3-СН2-СН3 – пропан,
СН2=СН-СН3 – пропен (пропилен)
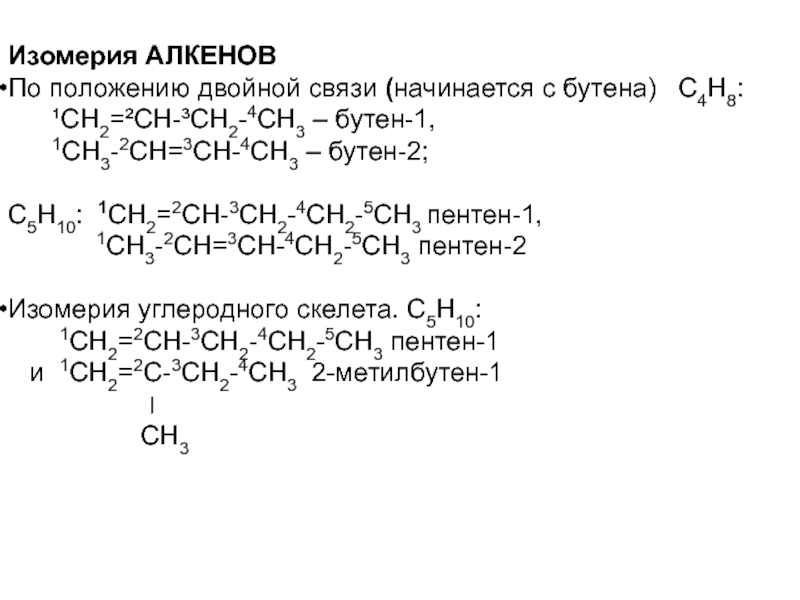
Слайд 50Изомерия АЛКЕНОВ
По положению двойной связи (начинается с бутена) С4Н8:
¹СН2=²СН-³СН2-4СН3 – бутен-1,
1СН3-2СН=3СН-4СН3 – бутен-2;
С5Н10: 1СН2=2СН-3СН2-4СН2-5СН3 пентен-1,
1СН3-2СН=3СН-4СН2-5СН3 пентен-2
Изомерия углеродного скелета. С5Н10:
1СН2=2СН-3СН2-4СН2-5СН3 пентен-1
и 1СН2=2С-3СН2-4СН3 2-метилбутен-1
׀
CH3
Слайд 52Этилен – бесцветный газ, почти без запаха, немного легче воздуха, плохо
С5—С18 – жидкости,
> C18 – твердые вещества
Слайд 53Химические свойства АЛКЕНОВ
Химические свойства алкенов определяются наличием в их
Слайд 54I. Реакции присоединения
Присоединение воды (гидратация)—в присутствии серной кислоты и при нагревании:
СН3-СН=СН2
пропен | пропанол-2
ОН
Присоединение галогеноводородов:
Н3С-СН=СН2 + Н-Br ? H3C-CH-CH3
пропен | 2-бромпропан
Br
Присоединение в примерах 1 и 2 происходит по правилу В. В. Марковникова: водород присоединяется к тому атому углерода при двойной связи, с которым связано больше атомов водорода (более гидрированный), а галоген или гидроксогруппа присоединяются к наименее гидрированному атому углерода при двойной связи
Слайд 55Присоединение водорода (гидрирование):
СН2=СН2 + Н2 ? СН3—СН3 (t, Pt).
Присоединение галогенов (протекает при обычных условиях):
Н2С = СН2 + Br2 ? H2C – CH2
Этен | | 1,2-дибромэтан
Br Br
Обесцвечивание бромной воды (и раствора перманганата калия – марганцовки) – качественная реакция на углеводороды ряда этилена
Слайд 56II. Реакции окисления
Горение (с воздухом этилен и его газообразные гомологи взрывоопасны):
С2Н4
Реакция Вагнера (окисление непредельных углеводородов раствором перманганата калия KMnO4 (обесцвечивание):
-2 -2 +7 -1 -1 +4
3СН2 = СН2 + 2KMnO4 + 4H2O ? 3CH2 – CH2 + 2KOH + 2MnO2
OH OH
2C-2 – 2е ? 2C-1 3 этилен - восстановитель
Mn+7 + 3e ? Mn+4 2 KMnO4 – окислитель
Слайд 57III. Реакции полимеризации
При повышенной температуре, давлении и в присутствии катализаторов молекулы
n CH2 = CH2 ? ( -- CH2 – CH2 --)n
этилен полиэтилен
Реакции полимеризации – соединение одинаковых молекул (мономеров) в более крупные за счет разрыва двойных связей.
Полиэтилен и полипропилен – ценные пластмассы
Слайд 58Получение АЛКЕНОВ
Дегидрирование алканов (отщепление водорода) (t, кат-р):
СН3 – СН3 ?СН2=СН2
Этан этен
2СН4 ? С2Н4 + 2Н2 (550-6500С, кат-р)
метан этен
Гидрирование алкинов (присоединение водорода):
СН ≡ СН + Н2 ? СН2 = СН2 (t, Pt)
Этин этен
Слайд 60Применение АЛКЕНОВ
Для производства пластмасс
Для синтеза этанола (этилового спирта)
Этилен используется для ускорения
Слайд 61Синтезы на основе этилена:
Этилен ?синтетический каучук;
Этилен ?дихлорэтан?винилхлорид ?поливинилхлорид;
Этилен ?полиэтилен;
Этилен ?этанол ?синтетические
Этилен?этиленгликоль?лавсан;
Этилен?уксусная кислота ?хлоруксусная кислота ?аминоуксусная кислота ?полипептиды;
Этилен ?ацетилен ?поливинилхлорид;
Этилен ?стирол ?полистирол
Слайд 62
Алкины – непредельные углеводороды, молекулы которых содержат
Алкины (ацетиленовые углеводороды)
Сn H2n-2
Слайд 64sp-гибридизация
В случае sp-гибридизации образуются два гибридных облака, которые лежат на
Так образуется ацетилен и его гомологи с общей формулой CnH2n - 2
Слайд 68Номенклатура АЛКИНОВ
Названия образуют от названия соответствующего алкана путем
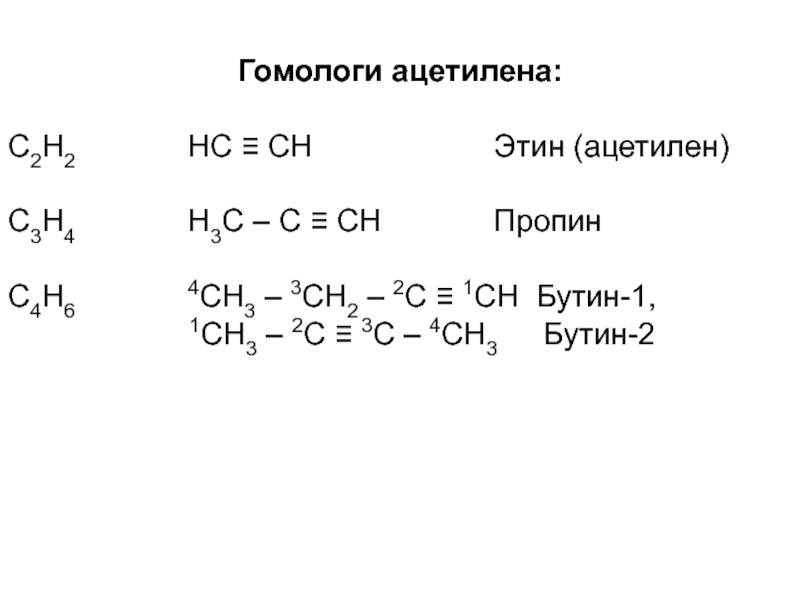
Слайд 69Гомологи ацетилена:
С2Н2 НС ≡ СН
С3Н4 Н3С – С ≡ СН Пропин
С4Н6 4СН3 – 3СН2 – 2С ≡ 1СН Бутин-1,
1СН3 – 2С ≡ 3С – 4СН3 Бутин-2
Слайд 70Изомерия АЛКИНОВ
Положения тройной связи : бутин-1 и бутин-2
1СН3 – 2С ≡ 3С – 4СН3 Бутин-2
2. Углеродного скелета: пентин-1 и 3-метилбутин-1
1СН ≡ 2С – 3СН2 – 4СН2 – 5СН3 1СН ≡ 2С – 3СН – 4СН3
пентин-1 │
СН3
3-метилбутин-1
Цепь нумеруют от того конца самой длинной цепи, к которому ближе находится тройная связь
Слайд 71Важнейшие физические свойства некоторых алкинов
Температура кипения алкинов увеличивается
Слайд 73Химические свойства АЛКИНОВ
Реакции присоединения могут протекать в две стадии за счет
Взаимодействие с галогенами (обесцвечивают бромную воду). Присоединение брома происходит в две стадии:
НС ≡ СН + Br2 ? СНBr = CHBr
1, 2-дибромэтен
CHBr = CHBr + Br2 ? CHBr2 – CHBr2 (1,1,2,2-тетрабромэтан)
Присоединение водорода - гидрирование (при повышенной температуре в присутствии катализаторов), протекает в две стадии:
НС ≡ СН + Н2 ? Н2С = СН2 (этилен),
Н2С = СН2 + Н2 ? СН3 – СН3 (этан)
Слайд 74Присоединение воды – гидратация (реакция Кучерова), протекает в присутствии солей ртути,
О
‖
НС ≡ СН + Н2О ? Н3С – СОН (Н3С – С - Н – уксусный альдегид, этаналь)
Слайд 75Присоединение хлороводорода:
СН ≡ СН + НCI ? CH2 = CHCI
Винилхлорид способен полимеризоваться:
СН2 = СН + СН2 = СН + … ? (-- СН2 -- СН --)n
│ │ │ поливинилхлорид
CI CI CI
Из поливинилхлорида получают химически и механически прочную пластмассу со свойствами диэлектрика, а также изготавливают искусственную кожу, плащи, клеенки
Слайд 76II. Реакции окисления
Горение. На воздухе ацетилен горит коптящим пламенем:
2С2Н2 + 5О2
Смеси ацетилена с воздухом или кислородом взрывоопасны.
Ацетилен обесцвечивает раствор перманганата калия (раствор марганцовки).
Обесцвечивание бромной воды (и раствора перманганата калия – марганцовки) – качественная реакция на ацетилен
Слайд 77III. Реакции полимеризации
Тримеризацией ацетилена получают бензол (пропускают ацетилен над активированным углем
3СН≡СН ? С6Н6
Слайд 78Получение АЦЕТИЛЕНА
Из карбида кальция:
СаС2 + Н2О ? С2Н2 + Са(ОН)2
Из
Слайд 79Применение АЛКИНОВ
Получение уксусного альдегида и уксусной кислоты
Синтез винилхлорида, а из него
Исходные вещества для синтеза каучука
Ацетилен используется для сварки и резки металлов
Слайд 80Ароматические углеводороды
Арены СnH2n-6
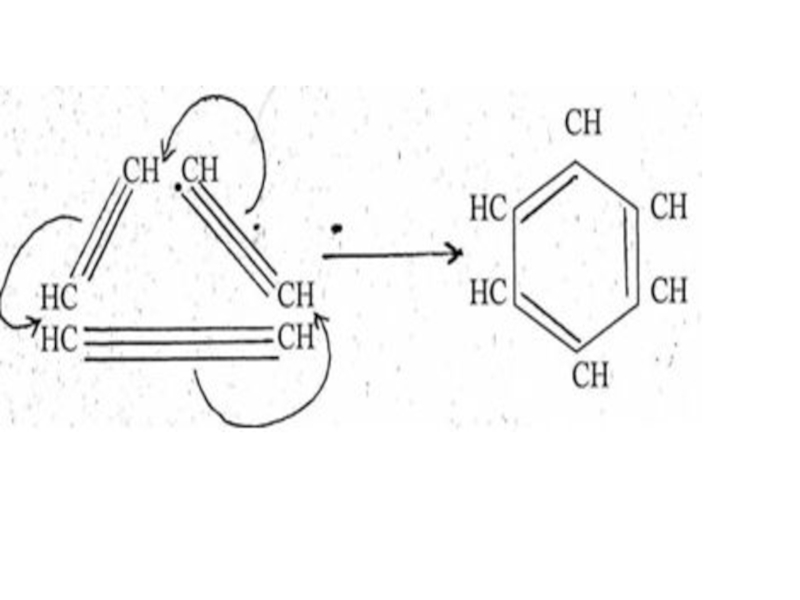
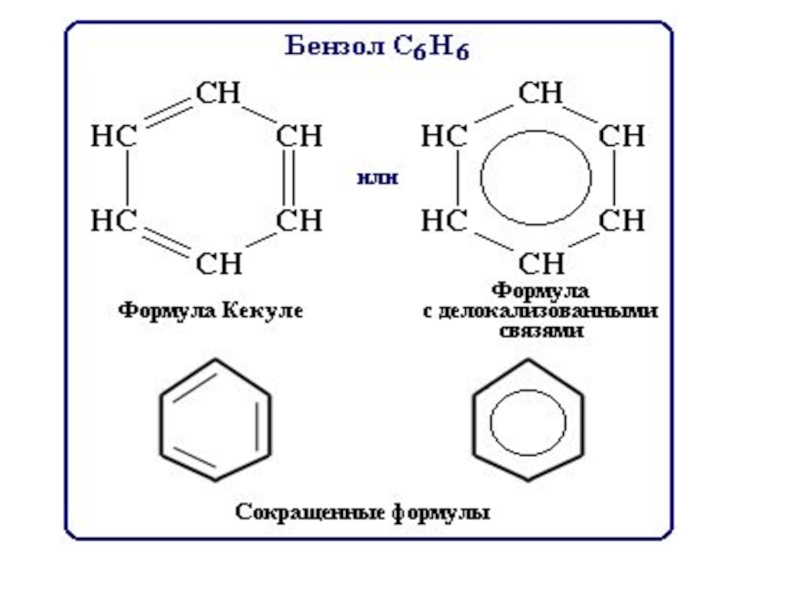
Слайд 81В 1865 году немецкий химик Фидрих Август Кекуле впервые пришел к
Слайд 84 Если формула Кекуле верна,
Исследование бензола физическими методами показало, что все расстояния в молекуле строго одинаковы и длинна связи С – С равна 0,140 нм, т.е. среднему значению между длинами простой и двойной связями
Слайд 86 Молекула бензола плоская, в ней все шесть
Слайд 90Физические свойства бензола
Бензол – бесцветная, нерастворимая в
Температура плавления 5,50 С
Слайд 91Химические свойства
I. Реакции замещения наиболее характерны (сходство с алканами):
Взаимодействие с
С6Н6 + Br2 ? C6H5Br + HBr
Взаимодействие с азотной кислотой (нитрование бензола) в присутствии серной кислоты конц.:
С6Н6 + НОNO2 ? C6Н5NO2 + H2O
Слайд 92II. Реакции присоединения
(сходство с непредельными углеводородами):
Присоединение хлора (на свету):
Присоединение водорода (гидрирование) – t0, кат-р:
С6Н6 + 3Н2 ? С6Н12 (циклогексан)
III. Реакции окисления
Бензол горит на воздухе коптящим пламенем:
2С6Н6 + 15О2? 12CO2 + 6H2O
Слайд 93Получение БЕНЗОЛА
Тримеризацией ацетилена (реакция Зелинского-Казанского: 450-5000С, активированный уголь):
Дегидрированием циклогексана (отщепление водорода):
С6Н12 ? С6Н6 + 3Н2 (t0, Pd).
Дегидроциклизацией алканов:
СН3—СН2—СН2—СН2—СН2—СН3 ? C6H6 + 4H2 (t0, Pt).
Перегонка каменноугольной смолы.
Ароматизация нефти (пиролиз, риформинг-процесс)
Слайд 94Применение
Синтез красителей, медикаментов, производство пластмасс и синтетических
Слайд 95Химический тренажер
1. Что такое изомеры? С какого углеводорода начинается изомерия у
2. Объясняет ли явление изомерии многообразие органических веществ? Ответ подтвердите примерами
3. Почему для непредельных углеводородов характерны реакции присоединения, а не замещения?
4. Укажите области применения непредельных углеводородов
5. Напишите формулы третьих членов гомологических рядов общей формулы: а) СnH2n, б) СnH2n-2.
6. На что влияет наличие пи-связей в молекуле: 1) на форму молекулы;
2) на тип реакций; 3) на прочность связи; 4) на глубину перекрывания электронных облаков.
7. Напишите формулы углеводородов с четырьмя атомами углерода в молекуле, названия которых оканчиваются на -ан, -ен, -ин.
8. Укажите области применения ацетилена.
9. Какие углеводороды называются аренами?
10. Зная молекулярную формулу бензола С6Н6, укажите, какие связи существуют между атомами углерода в молекуле бензола?
11. Укажите, к каким известным вам гомологическим рядам относятся следующие углеводороды: а) С6Н10; б) С6Н14; в) С6Н12; г) С3Н4; д) С6Н6;
е) С6Н12.