Л.,
учитель высшей квалификационной категории МОУ «СОШ № 3» г. Саранск
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Подготовка учащихся к ЕГЭ по химии в условиях развивающего обучения
Содержание
- 1. Подготовка учащихся к ЕГЭ по химии в условиях развивающего обучения
- 2. Цель технологии: обеспечить качественную подготовку учащихся к успешному результату ЕГЭ.
- 3. Задачи: 1. Вооружить учащихся современным инструментарием для
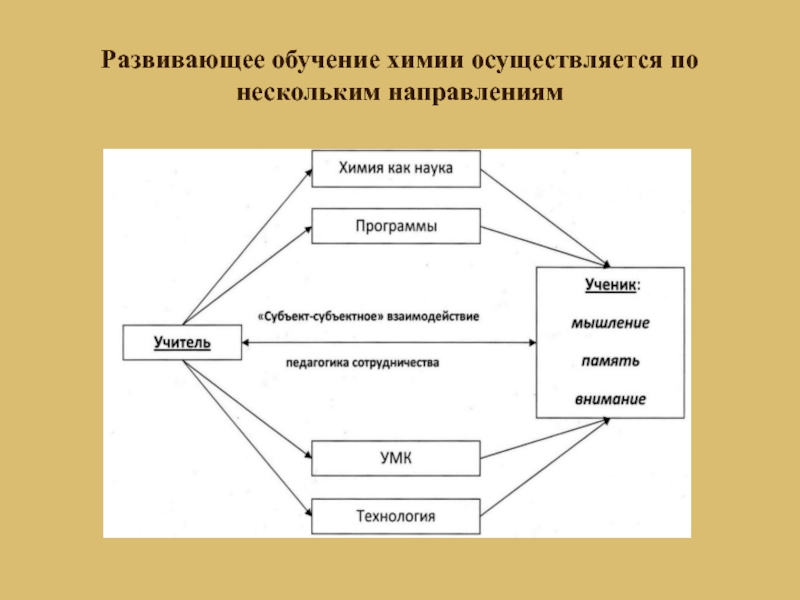
- 4. Развивающее обучение химии осуществляется по нескольким направлениям
- 5. Главные дидактические принципы развивающего обучения ∙ Научность
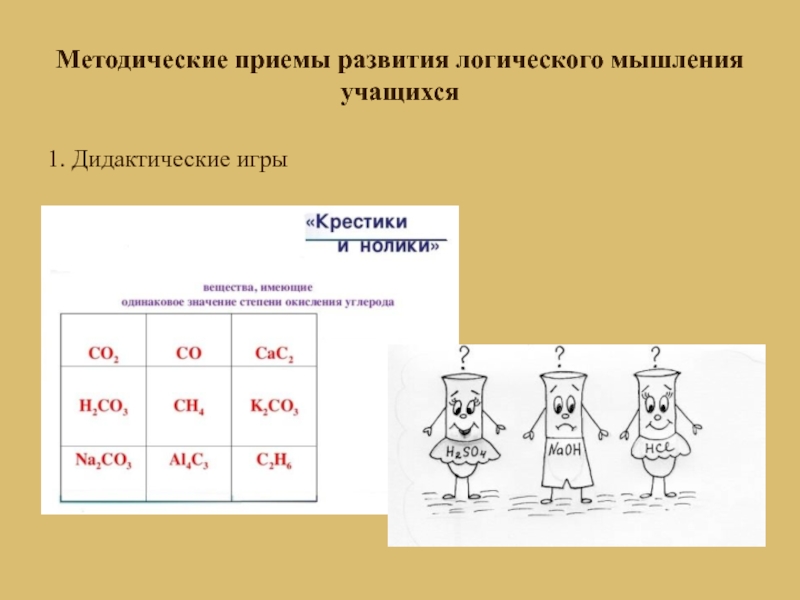
- 6. Методические приемы развития логического мышления учащихся1. Дидактические игры
- 7. Na + ? → NaOH + H2?
- 8. алкан → галоген-алкан → алкен
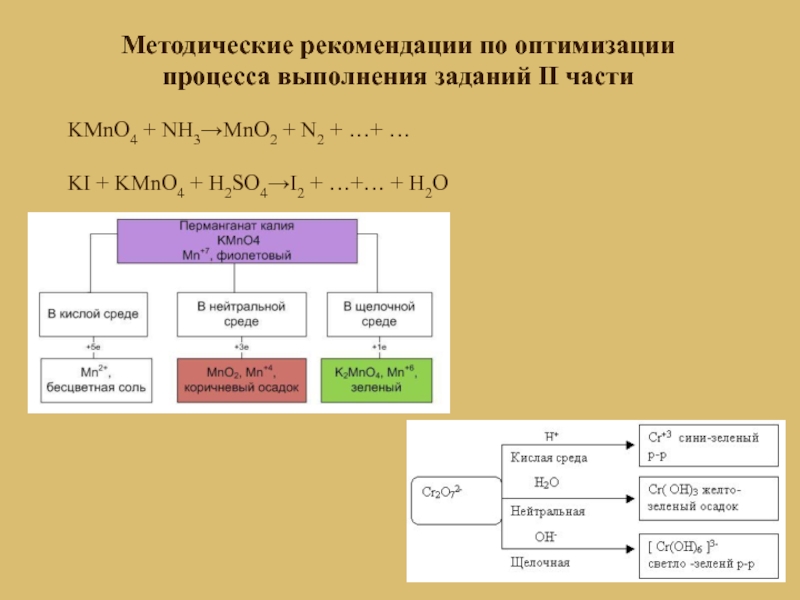
- 9. Методические рекомендации по оптимизации процесса выполнения заданий
- 10. Методические рекомендации по оптимизации процесса выполнения заданий
- 11. Особые случаи составления электронного балансаЕсли у элемента,
- 12. 3. Если в уравнении два окислителя или
- 13. Составление электронного баланса для органических реакций 3С-3Н3С-1Н2ОН+2КМn+7О4→3С-3Н3С+1ОН+2Мn+4О2+2КОН+2Н2ОС-1-2е
- 14. ∙ составьте уравнения возможных реакций; ∙ рассчитайте
- 15. Технологии контроля знаний 1. Устный контроль 2. Письменный контроль 3. Решение экспериментальных задач
Цель технологии: обеспечить качественную подготовку учащихся к успешному результату ЕГЭ.
Слайд 3Задачи:
1. Вооружить учащихся современным инструментарием для успешного постижения основ химии
и формирования ключевых компетенций;
2. Подобрать оптимальные дидактические средства, методические приёмы изучения программного материала, видов контроля и коррекции, необходимых для подготовки к ЕГЭ.
2. Подобрать оптимальные дидактические средства, методические приёмы изучения программного материала, видов контроля и коррекции, необходимых для подготовки к ЕГЭ.
Слайд 5Главные дидактические принципы развивающего обучения
∙ Научность
∙ Наглядность
∙ Доступность
∙ Принцип проблемно-интегративного обучения
∙ Принцип личностно-ориентированного подхода
∙ Обучение на высоком уровне трудности
∙ Организация здоровьесберегающего характера обучения
∙ Принцип «субъект-субъектного взаимодействия учителя и ученика»
Слайд 7Na + ? → NaOH + H2
? + BaCl2 → BaSO4
+ NaCl
Fe + ? → Cu + FeCl2
FeCl3 + ? → NaCl + ?
? → N2 + H2O
? → N2O + H2O
? + ? → AgCl + HNO3
? + ? → N2 + H2O
? + ? → CO2 + SO2 + H2O
? + ? → KCl + KClO3 + H2O
Fe + ? → Cu + FeCl2
FeCl3 + ? → NaCl + ?
? → N2 + H2O
? → N2O + H2O
? + ? → AgCl + HNO3
? + ? → N2 + H2O
? + ? → CO2 + SO2 + H2O
? + ? → KCl + KClO3 + H2O
2. Составление уравнений реакций по схемам
Слайд 8
алкан → галоген-алкан → алкен → спирт → альдегид
дигалоген-алкан → алкен → спирт → простой эфир (6 атомов С в молекуле)
3. Составление цепочек превращений веществ:
Слайд 9Методические рекомендации по оптимизации процесса выполнения заданий I части
1. Внимательно
читать задания и выделять ключевое слово или слова.
2. При наличии однозначно верного ответа остановиться на нём и не рассматривать другие.
3. Убирать «лишние» варианты.
4. Установите причинно-следственные связи и отбросьте неверные ответы.
5. Мысленное деление вариантов ответов на подгруппы и анализ полученных данных.
6. Знание физических свойств веществ, типов кристаллических решеток.
7. Знание химических свойств простых и сложных веществ, установление причинно-следственных связей.
8. Определение необходимого минимума знаний по теме.
2. При наличии однозначно верного ответа остановиться на нём и не рассматривать другие.
3. Убирать «лишние» варианты.
4. Установите причинно-следственные связи и отбросьте неверные ответы.
5. Мысленное деление вариантов ответов на подгруппы и анализ полученных данных.
6. Знание физических свойств веществ, типов кристаллических решеток.
7. Знание химических свойств простых и сложных веществ, установление причинно-следственных связей.
8. Определение необходимого минимума знаний по теме.
Слайд 10Методические рекомендации по оптимизации процесса выполнения заданий II части
KMnO4 +
NH3→MnO2 + N2 + …+ …
KI + KMnO4 + H2SO4→I2 + …+… + H2O
KI + KMnO4 + H2SO4→I2 + …+… + H2O
Слайд 11Особые случаи составления электронного баланса
Если у элемента, являющегося окислителем или восстановителем,
в левой и правой частях уравнения одинаковые индексы:
K2Cr2+6O7 + 3K2S+4O3+ 4H2SO4 = 4K2S+6O4 + Cr2+3(SO4)3 + 4H2O
2Cr+6 + 6e = 2Cr+ | 1
S+4 - 2e = S+6 | 3
2. Если в сложном веществе атомы одного элемента соединены между собой непосредственно, например: H2O2; Na2S2; C2H6:
H2O2-1 + 2 KI = 2KO-2H + J20
2 O-1 + 2e = 2 O-2 | 1
2 J-1 - 2e = J20 | 1
K2Cr2+6O7 + 3K2S+4O3+ 4H2SO4 = 4K2S+6O4 + Cr2+3(SO4)3 + 4H2O
2Cr+6 + 6e = 2Cr+ | 1
S+4 - 2e = S+6 | 3
2. Если в сложном веществе атомы одного элемента соединены между собой непосредственно, например: H2O2; Na2S2; C2H6:
H2O2-1 + 2 KI = 2KO-2H + J20
2 O-1 + 2e = 2 O-2 | 1
2 J-1 - 2e = J20 | 1
Слайд 123. Если в уравнении два окислителя или два восстановителя входят в
состав одного соединения то индексы из этого соединения переносятся в баланс:
4 Fe+2S2-1 + 11 O20 = 2 Fe2+3O3 + 8 S+4O2
Fe+2 - 1e = Fe+3 }
2 S-1 – 10e = 2 S+4 }-11e | 4
O20 + 4e =2 O20 | 11
4. Если в соединении элемент имеет дробную степень окисления, то в электронный баланс вносится индекс в виде коэффициента:
Fe3+8\3O4 + 10 HN+5O3 = 3 Fe+3(NO3)3 + N+4O2 + 5 H2O
3 Fe+8\3 – 1e = 3 Fe+3 | 1
N+5 + 1e = N+4 | 1
4 Fe+2S2-1 + 11 O20 = 2 Fe2+3O3 + 8 S+4O2
Fe+2 - 1e = Fe+3 }
2 S-1 – 10e = 2 S+4 }-11e | 4
O20 + 4e =2 O20 | 11
4. Если в соединении элемент имеет дробную степень окисления, то в электронный баланс вносится индекс в виде коэффициента:
Fe3+8\3O4 + 10 HN+5O3 = 3 Fe+3(NO3)3 + N+4O2 + 5 H2O
3 Fe+8\3 – 1e = 3 Fe+3 | 1
N+5 + 1e = N+4 | 1
Слайд 13Составление электронного баланса для органических реакций
3С-3Н3С-1Н2ОН+2КМn+7О4→3С-3Н3С+1ОН+2Мn+4О2+2КОН+2Н2О
С-1-2е → С+1
|3
Мn+7+3е → Мn+4 |2
Мn+7+3е → Мn+4 |2
При составлении электронного баланса для органических реакций можно пользоваться степенью окисления каждого атома углерода и вносить в баланс только те атомы, у которых изменилась степень окисления.
Слайд 14
∙ составьте уравнения возможных реакций;
∙ рассчитайте количества реагентов или продуктов
на основе данных задачи;
∙ проведите сравнения количеств веществ на основе стехиометрических коэффициентов
∙ проведите сравнения количеств веществ на основе стехиометрических коэффициентов
Задача 39
Слайд 15Технологии контроля знаний
1. Устный контроль
2. Письменный контроль
3. Решение
экспериментальных задач