Пак Е.С.
Учитель химии МБОУ Лицей №1
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Подготовка учащихся 9 классов к сдаче ОГЭ по химии. Из опыта работы.
Содержание
- 1. Подготовка учащихся 9 классов к сдаче ОГЭ по химии. Из опыта работы.
- 2. План подготовки Планирование консультаций с учениками 9-в.Занятия
- 3. План подготовки к ОГЭА3.Строение молекул. Химическая связь:
- 4. План подготовки к ОГЭА6.Химическая реакция. Условия и
- 5. План подготовки к ОГЭА7.Электролиты и неэлектролиты.Катионы и
- 6. План подготовки к ОГЭА9.Химические свойства простых веществ:
- 7. А13.Чистые вещества и смеси. Правила безопасной работы
- 8. План подготовки к ОГЭА14. Степень окисления химических элементов. Окислитель и восстановитель. Окислительно- восстановительные реакции.
- 9. Первые несколько минут в начале экзамена-самые нервные,
- 10. 4.Выясните сколько разделов, сколько вопросов, какие возможности
- 11. Психологическая подготовка к ОГЭ6.Если выбора у вас
- 12. 1.Правильно распорядиться своим временем.2.Составлять план на каждый
- 13. Как правильно подготовиться к ОГЭ5.Усвойте правило «3-х
- 14. Список используемой методической литературы.1.Библиотека Статград. Подготовка к
- 15. Химические свойства простых веществ: металлов и неметаллов.Пример
- 16. Химические свойства простых веществ: металлов и неметаллов2.Взаимодействие
- 17. Химические свойства простых веществ: металлов и неметаллов4.С
- 18. Химические свойства простых веществ: металлов и неметалловНеметаллы.
- 19. Химические свойства простых веществ: металлов и неметалловНеметаллы.Свойства
- 20. Химические свойства простых веществ: металлов и неметалловНеметаллы.
- 21. Пример:Составьте уравнения реакций, подтверждающих общие химические свойства
- 22. Пример(продолжение)Со сложными веществами –окислителями:S + 6 H
- 23. Задание №22Даны вещества: Zn. FeSO4
- 24. ОтветZn ---- Na2 [Zn (OH) 4]
- 25. амфотерностьВ нейтральной среде (чистая вода) амфотерные гидроксиды
- 26. амфотерностьВзаимодействие амфотерного гидроксида с кислотой:Zn(OH)2 + 2HCl
- 27. амфотерностьВзаимодействие амфотерного гидроксида с избытком раствора щелочи:Zn(OH)2
- 28. Изучая каждый вопрос из программы химии 9
- 29. Программа 9 классаИзучая подгруппу кислорода, азота, углерода.-строение
- 30. таблица
План подготовки Планирование консультаций с учениками 9-в.Занятия проводятся 1 раз в неделю.А1.Строение атома. Строение электронных оболочек атомов 20 элементов периодической системы Д.И.Менделеева.А2.Периодический закон и периодическая система химических элементов Д.И.Менделеева.•
Слайд 2План подготовки
Планирование консультаций с учениками 9-в.
Занятия проводятся 1 раз в
неделю.
А1.Строение атома. Строение электронных оболочек атомов 20 элементов периодической системы Д.И.Менделеева.
А2.Периодический закон и периодическая система химических элементов Д.И.Менделеева.
А1.Строение атома. Строение электронных оболочек атомов 20 элементов периодической системы Д.И.Менделеева.
А2.Периодический закон и периодическая система химических элементов Д.И.Менделеева.
•
Слайд 3План подготовки к ОГЭ
А3.Строение молекул. Химическая связь: ковалентная(полярная и неполярная), ионная,
металлическая.
А4.Валентность химических элементов. Степень окисления химических элементов.
А5.Простые и сложные вещества. Основные классы неорганических веществ.Номенклатура неорганических соединений.
А4.Валентность химических элементов. Степень окисления химических элементов.
А5.Простые и сложные вещества. Основные классы неорганических веществ.Номенклатура неорганических соединений.
Слайд 4План подготовки к ОГЭ
А6.Химическая реакция. Условия и признаки протекания химических реакций.
Химические уравнения. Сохранение массы веществ в химических реакциях. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии.
Слайд 5План подготовки к ОГЭ
А7.Электролиты и неэлектролиты.Катионы и анионы. Электролитическая диссоциация кислот,
солей( средних), щелочей.
А8.Реакции ионного
обмена и условия их
осуществления.
А8.Реакции ионного
обмена и условия их
осуществления.
Слайд 6План подготовки к ОГЭ
А9.Химические свойства простых веществ: металлов и неметаллов.
А10.Химические свойства
оксидов: основных , амфотерных, кислотных.
А11.Химические свойства оснований. Химические свойства кислот.
А12. Химические свойства солей (средних).
А11.Химические свойства оснований. Химические свойства кислот.
А12. Химические свойства солей (средних).
Слайд 7А13.Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Лабораторная
посуда и оборудование. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ и химических реакций в повседневной жизни. Разделение смесей и очистка веществ. Приготовление растворов.Химическое загрязнение окружающей среды и его последствия.
План подготовки к ОГЭ
Слайд 8План подготовки к ОГЭ
А14. Степень окисления химических элементов. Окислитель и восстановитель.
Окислительно- восстановительные реакции.
Слайд 9Первые несколько минут в начале экзамена-самые нервные, но они могут стать
самыми ценными, если вам удастся их разумно использовать.
1.Удостоверьтесь, что вы держите в руках то, что положено.
2.Выполните необходимые формальности- впишите свое имя, номер, дату, паспортные данные.
3.Внимательно прочитайте инструкцию, приведенные в бланках.
1.Удостоверьтесь, что вы держите в руках то, что положено.
2.Выполните необходимые формальности- впишите свое имя, номер, дату, паспортные данные.
3.Внимательно прочитайте инструкцию, приведенные в бланках.
Психологическая подготовка к ОГЭ
Слайд 104.Выясните сколько разделов, сколько вопросов, какие возможности есть у вас. Затем
уточните для себя, сколько времени вам отводится на все.
5.Определив, на какое количество вопросов вы должны ответить, составьте себе расписание экзамена. При этом зарезервируйте 15 мин в конце на проверку своих ответов. Посчитайте, сколько приблизительно времени вы потратите на выполнение каждой части.
5.Определив, на какое количество вопросов вы должны ответить, составьте себе расписание экзамена. При этом зарезервируйте 15 мин в конце на проверку своих ответов. Посчитайте, сколько приблизительно времени вы потратите на выполнение каждой части.
¯
Психологическая подготовка к ОГЭ
Слайд 11Психологическая подготовка к ОГЭ
6.Если выбора у вас нет, можете начать с
первого вопроса. Если есть возможность выбора, прочтите по очереди каждый вопрос медленно и спокойно и решите, на какие вопросы вы можете попытаться ответить. Аккуратно отметить эти вопросы «галочкой». Затем определите «плохие» вопросы и отметите их крестиком.
7.Не обращайте внимание на то, что вокруг уже строчат ответы! Многие спешат там, где следует проявить осторожность.
8.Начинайте отвечать с «хороших» вопросов.т.е. с тех, в ответах которых вы уверены.
7.Не обращайте внимание на то, что вокруг уже строчат ответы! Многие спешат там, где следует проявить осторожность.
8.Начинайте отвечать с «хороших» вопросов.т.е. с тех, в ответах которых вы уверены.
Слайд 121.Правильно распорядиться своим временем.
2.Составлять план на каждый день подготовки.
3.При подготовке к
экзаменам полезно структурировать материал за счет составления планов, схем и это обязательно нужно делать на бумаге.
4.Относитесь к стрессу как к источнику энергии. Каждую проблему, которую ставит жизнь, воспринимайте как вызов.
4.Относитесь к стрессу как к источнику энергии. Каждую проблему, которую ставит жизнь, воспринимайте как вызов.
Как правильно подготовиться к ОГЭ
Слайд 13Как правильно подготовиться к ОГЭ
5.Усвойте правило «3-х карандашей» а)Внимательно, прочтите вопросы.
Значком первого цвета отметьте вопросы, ответы на которые знаете хорошо и даже без подготовки можете ответить.
б)значком другого цвета пометьте вопросы, ответы на которые знаете слабо.
в)значком третьего цвета- вопросы , ответы на которые не знаете или знаете плохо. По отношению этих цветов вы увидите состояние своей подготовки.
б)значком другого цвета пометьте вопросы, ответы на которые знаете слабо.
в)значком третьего цвета- вопросы , ответы на которые не знаете или знаете плохо. По отношению этих цветов вы увидите состояние своей подготовки.
Слайд 14Список используемой методической литературы.
1.Библиотека Статград. Подготовка к ОГЭ.Диагностические работы по химии
2016 и 2017 год.
2.Химия. Тематический тренинг за курс основной школы. 9 класс.Авторы: В. Доронькин, А.Бережная, Т. Сажнева, В.Февралева.Издательство Легион. Ростов на Дону. 2016г.
3.Химия. 100 самых важных тем. Готовимся к ОГЭ и ЕГЭ. Автор: О.Мешкова.Москва, 2016.
2.Химия. Тематический тренинг за курс основной школы. 9 класс.Авторы: В. Доронькин, А.Бережная, Т. Сажнева, В.Февралева.Издательство Легион. Ростов на Дону. 2016г.
3.Химия. 100 самых важных тем. Готовимся к ОГЭ и ЕГЭ. Автор: О.Мешкова.Москва, 2016.
Слайд 15Химические свойства простых веществ: металлов и неметаллов.
Пример 1. Составьте уравнения реакций,
подтверждающих общие химические свойства металлов.(реакции пишу в виде схемы)
Ме- только восстановители: Ме - ne = Ме
1.Взаимодействие с неметаллами:
а) металл + кислород =оксид металла(или пероксид металла для очень активных металлов)
б)металл + неметалл= соль
Ме- только восстановители: Ме - ne = Ме
1.Взаимодействие с неметаллами:
а) металл + кислород =оксид металла(или пероксид металла для очень активных металлов)
б)металл + неметалл= соль
Слайд 16Химические свойства простых веществ: металлов и неметаллов
2.Взаимодействие с кислотами:
Металл+ кислота= соль
+ водород
(металлы-левее водорода в ряду активности, кислоты- кроме азотной кислоты).
3.С соединениями менее активных металлов:
а)Ме+ МеО = Ме + МО
б)Ме + МеАn=Ме An +Me
(металлы-левее водорода в ряду активности, кислоты- кроме азотной кислоты).
3.С соединениями менее активных металлов:
а)Ме+ МеО = Ме + МО
б)Ме + МеАn=Ме An +Me
Слайд 17Химические свойства простых веществ: металлов и неметаллов
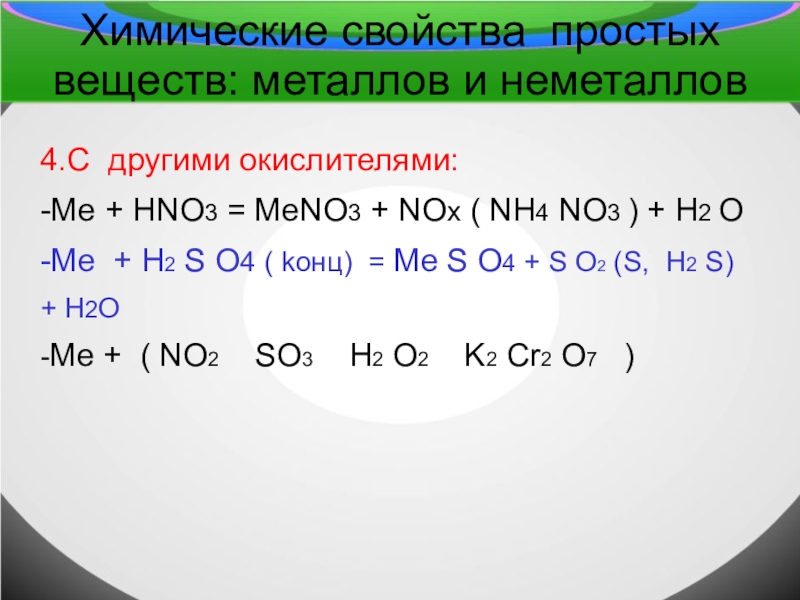
4.С другими окислителями:
-Ме + HNO3
= MеNO3 + NOx ( NH4 NO3 ) + H2 O
-Mе + H2 S O4 ( koнц) = Mе S O4 + S O2 (S, H2 S)
+ H2O
-Mе + ( NO2 SO3 H2 O2 K2 Cr2 O7 )
-Mе + H2 S O4 ( koнц) = Mе S O4 + S O2 (S, H2 S)
+ H2O
-Mе + ( NO2 SO3 H2 O2 K2 Cr2 O7 )
Слайд 18Химические свойства простых веществ: металлов и неметаллов
Неметаллы. Свойства окислителя
неМ(0)
+ ne = не М(-n)
C металлами неМ + Ме = Ме Аn
C менее активными металлами:
неМ + неМ =реакция соединения(особые свойства простых веществ)
C металлами неМ + Ме = Ме Аn
C менее активными металлами:
неМ + неМ =реакция соединения(особые свойства простых веществ)
Слайд 19Химические свойства простых веществ: металлов и неметаллов
Неметаллы.Свойства окислителя:
Со сложными веществами, в
состав которых входит элемент-восстановитель(!!! Особые свойства веществ)
Слайд 20Химические свойства простых веществ: металлов и неметаллов
Неметаллы. Свойства восстановителя:
неМ(0) -
ne = неМ(+n)
С более активными металлами(!!!особые свойства веществ)
Со сложными веществами, в состав которых входит элемент –окислитель.(!!! Особые свойства веществ)
С более активными металлами(!!!особые свойства веществ)
Со сложными веществами, в состав которых входит элемент –окислитель.(!!! Особые свойства веществ)
Слайд 21Пример:
Составьте уравнения реакций, подтверждающих общие химические свойства неметаллов:
С металлами: Cl2
+2 Na =2 Na Cl
С неметаллами 2 Р +3 Сl2 = 2 PCl3
Cо сложными веществами –восстановителями: 2Fe Cl2 + Cl2 = 2 FeCl3
С неметаллами 2 Р +3 Сl2 = 2 PCl3
Cо сложными веществами –восстановителями: 2Fe Cl2 + Cl2 = 2 FeCl3
Слайд 22Пример(продолжение)
Со сложными веществами –окислителями:
S + 6 H NO3(конц) =
H2 SO 4 +6 NO2 + 2 H2O
Слайд 23Задание №22
Даны вещества: Zn. FeSO4 х 7 H2 O
растворы Mg Cl2 . H2 S O4 . Ca(NO3 )2
Na OH. Используя воду и необходимые вещества только из этого списка, получите в две стадии сульфат цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Na OH. Используя воду и необходимые вещества только из этого списка, получите в две стадии сульфат цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Слайд 24Ответ
Zn ---- Na2 [Zn (OH) 4] ---- Zn
SO4
Zn + 2 NaOH + 2 H2 O= Na2 [Zn ( OH)4 ] + H2
Na2 [Zn ( OH)4 ] +2 H2 SO4 = N2 SO4 + ZnSO4
4H 2O
Zn + 2 NaOH + 2 H2 O= Na2 [Zn ( OH)4 ] + H2
Na2 [Zn ( OH)4 ] +2 H2 SO4 = N2 SO4 + ZnSO4
4H 2O
Слайд 25амфотерность
В нейтральной среде (чистая вода) амфотерные гидроксиды практически не растворяются в
воде и не диссоциируют на ионы. Они растворяются в кислотах и щелочах.
Слайд 26амфотерность
Взаимодействие амфотерного гидроксида с кислотой:
Zn(OH)2 + 2HCl = ZnCl 2 +
2 H2 O
Взаимодействие с щелочами: (сплавление)
Zn(OH)2 +2NaOH = Na 2 ZnO2 + 2H2O
цинкат натрия
Al(OH)2 + NaOH = NaAlO2 +2H2 O
метаалюминат натрия
Взаимодействие с щелочами: (сплавление)
Zn(OH)2 +2NaOH = Na 2 ZnO2 + 2H2O
цинкат натрия
Al(OH)2 + NaOH = NaAlO2 +2H2 O
метаалюминат натрия
Слайд 27амфотерность
Взаимодействие амфотерного гидроксида с избытком раствора щелочи:
Zn(OH)2 +2NaOH = Na2 [Zn(OH)4
]
тетрагидроксоцинкат натрия
Al(OH)3 + NaOH = Na [Al(OH)4 ] тетрагидроксоалюминат натрия
или Na3 [Al (OH)6 ] гексагидроксогидрат натрия
тетрагидроксоцинкат натрия
Al(OH)3 + NaOH = Na [Al(OH)4 ] тетрагидроксоалюминат натрия
или Na3 [Al (OH)6 ] гексагидроксогидрат натрия
Слайд 28Изучая каждый вопрос из программы химии 9 класса, провожу параллель с
вопросами из заданий ОГЭ.
Например: Элементы неметаллы в Периодической системе Д.И. Менделеева. Простые и сложные вещества. Водородные и кислородные соединения неметаллов. П.12,13,14.
Например: Элементы неметаллы в Периодической системе Д.И. Менделеева. Простые и сложные вещества. Водородные и кислородные соединения неметаллов. П.12,13,14.
Программа 9 класса
Слайд 29Программа 9 класса
Изучая подгруппу кислорода, азота, углерода.
-строение атома
-изменение металлических и неметаллических
свойств в группах и подгруппах.
Химические связи.
Строение кристаллических решеток.
Химические связи.
Строение кристаллических решеток.






















![Подготовка учащихся 9 классов к сдаче ОГЭ по химии. Из опыта работы. ОтветZn ---- Na2 [Zn (OH) 4] ---- Zn SO4Zn + ОтветZn ---- Na2 [Zn (OH) 4] ---- Zn SO4Zn + 2 NaOH + 2](/img/thumbs/ecfb64ab9b562f81340154d7b79e705c-800x.jpg)


![Подготовка учащихся 9 классов к сдаче ОГЭ по химии. Из опыта работы. амфотерностьВзаимодействие амфотерного гидроксида с избытком раствора щелочи:Zn(OH)2 +2NaOH = Na2 [Zn(OH)4 амфотерностьВзаимодействие амфотерного гидроксида с избытком раствора щелочи:Zn(OH)2 +2NaOH = Na2 [Zn(OH)4 ]](/img/thumbs/58fb84428d4d1736022bcc7c9159468a-800x.jpg)